Журнал «Травма» Том 20, №5, 2019
Вернуться к номеру
Перспективи застосування екзосом у клінічній практиці
Авторы: Музиченко П.Ф., Черняк В.А., Шевченко О.О., Левон М.М.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
Мета. У даній роботі зібрані матеріали, присвячені пошуку нових методик діагностики та лікарських засобів нового покоління, заснованих на клітинних технологіях, що будуть використовуватись в онкології, ортопедії-травматології та лікуванні захворювань серцево-судинної системи. Матеріали та методи. Досліджуватись будуть екзосоми, що містяться в плазмі крові, сечі та інших біологічних рідинах, із яких можна отримати мікро-РНК для фенотипування, ідентифікації клітин та діагностики патологічних процесів. Результати. Екзосоми, виділені із гемопоетичних стовбурових клітин, здатні захищати пошкоджені клітини від загибелі, стимулюючи відновлення поділу клітин, тому що на поверхні екзосом синтезуються ростові антиапоптозні фактори, що може бути використано при лікуванні гострого ішемічного інсульту, інфаркту міокарда, ішемії нижніх кінцівок, затримки зрощення кісткової тканини та інших тяжких захворювань. Екзосоми також можуть використовуватись у клінічній практиці як транспортери для певних видів ліків, що доставляють їх до клітин-мишеней, знижуючи можливість мутацій, особливо при онкозахворюваннях. Висновки. Успішне запровадження цих засобів у практичну медицину дозволить покращити діагностику та лікування багатьох перерахованих вище захворювань та значно скоротити смертність від них.
Цель. В данной работе собраны материалы, посвященные поиску новых методик диагностики и лекарственных средств нового поколения, основанных на клеточных технологиях, которые будут использоваться в онкологии, ортопедии-травматологии и лечении заболеваний сердечно-сосудистой системы. Материалы и методы. Исследоваться будут экзосомы, находящиеся в плазме крови, моче и других биологических средах, из них можно получить микро-РНК для фенотипирования, идентификации клеток, а также диагностики патологических процессов, которые в них происходят. Результаты. Экзосомы, выделенные из гемопоэтических стволовых клеток, способны защищать поврежденные клетки от гибели, стимулируя возобновление деления клеток, потому что на поверхности экзосом синтезируются ростовые антиапоптозные факторы, которые могут быть использованы при лечении острого ишемического инсульта, инфаркта, ишемии нижних конечностей. Экзосомы также могут использоваться в клинической практике в качестве транспортеров специфических лекарств, доставляющих их к клеткам-мишеням, снижая возможность мутаций, особенно при онкологических заболеваниях. Выводы. Успешное внедрение этих средств в практическую медицину позволит значительно улучшить диагностику и лечение многих перечисленных выше заболеваний и сократить смертность от них.
Background. This paper deals with the materials on the search for new diagnostic methods and new-generation drugs based on cellular technologies that will be used in oncology and for the treatment of cardiovascular diseases. Materials and methods. The exosomes in the blood plasma, urine and other biological fluids are studied, which can be a source of micro-RNA for phenotyping, cell identification and diagnosis of pathological processes that occur in them. Results. Exosomes isolated from hematopoietic stem cells can protect damaged cells from death by stimulation of the resumption of cell division because on the surface of exosomes growth factors are being produced that could be used for the treatment of acute ischemic stroke, infarction, ischemia of the lower limbs. Exosomes could also be used in clinical practice and as a transporter of specific drugs, delivering them to target cells, redu-cing the possibility of mutations, especially in cancer and other serious diseases. Conclusions. The successful implementation of these tools in medical practice will significantly reduce mortality from the aforementioned diseases.
екзосоми; міжклітинні комунікації; клітини-мішені; онкологія; регенерація; кісткова система; серцево-судинні захворювання
экзосомы; межклеточные коммуникации; клетки-мишени; онкология; регенерация; костная система; сердечно-сосудистые заболевания
exosomes; intercellular communication; target cells; oncology; regeneration; skeletal system; cardiovascular diseases
Вступ
Одна із найважливіших проблем молекулярної медицини — це діагностика і лікування онкологічних захворювань. Дослідження показали, що інколи клітини злоякісних пухлин «викидають» мікробульбашки, вивільняючи крихітні частинки РНК, які, потрапляючи в здорові клітини, перетворюють їх на ракові. Це позаклітинні везикули, діаметр яких 35–90 нанометрів, вони виділяються в міжклітинний простір клітинами різних тканин і органів. Вони знайдені також у тканинних рідинах організму — у сироватці крові, сечі, спинномозковій рідині та слині. Їх порожнина має цитоплазму і включає різні види білків, мікро-РНК та ліпіди. Ці бульбашки отримали назву «екзосоми» [3].
Значний інтерес викликає їх потенційна роль у розвитку різних захворювань — від серцево-судинних до онкологічних. По-перше, є підстави вважати, що поява злоякісних новоутворень значно збільшує кількість екзосом у різних біологічних рідинах людини. По-друге, аналіз білкового профілю і РНК, що міститься в екзосомах, дає змогу судити про їх тканинне походження і патологічні зміни в певній тканині. Можна очікувати, що розширення методичного арсеналу, що використовується сьогодні для дослідження екзосом, дозволить отримувати додаткову інформацію про це нове фундаментальне біологічне явище.
Екзосоми були вперше описані у 1983 році при дослідженні диференціювання ретикулоцитів. У 1985 році було продемонстровано, що екзосоми змінюють структуру мембран ретикулоцитів шляхом видалення рецепторів трансферину.
Спочатку екзосоми розглядалися як «резервуари» — сміттеві контейнери для видалення надлишку цитоплазми і сприймались як продукт життєдіяльності клітин. У кінці 1990-х років було показано, що екзосоми беруть участь у регуляції імунних реакцій організму, що свідчить про їх важливу роль у забезпеченні міжклітинної взаємодії.
У 2007 році в бульбашках були виявлені мікро-РНК та мРНК, які є переносниками генетичної інформації до клітин-мішеней. Це значно підвищило інтерес до цих позаклітинних везикул. При вивченні культур ембріональних стовбурових клітин було доведено, що екзосоми здатні до горизонтального перенесення мРНК між клітинами. Екзосоми переносять до попередників клітин крові специфічні мРНК, що призводить до фенотипових змін клітин-реципієнтів.
Зараз існує думка, що нуклеїнові кислоти, які переносяться екзосомами, беруть участь у епігенетичному успадковуванні, тобто спадкових змінах у фенотипі або експресії генів, що викликаються механізмами, які не пов’язані зі зміною послідовності ДНК [3].
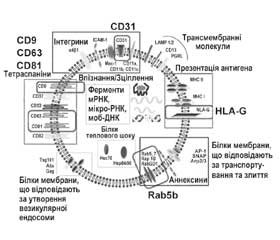
Спочатку екзосоми утворюються всередині клітини — шляхом брунькування у порожнину, що називається ендосомою. Коли у цій порожнині накопичується достатня кількість екзосом, подальша їх доля залежить від того, якими ліпідами промаркована мембрана ендосоми. Якщо ендосома помічена лізобіфосфатидиловою кислотою (фосфатидилінозитол-3-фосфат) і містить убіквінинові білки, то її вміст буде знищено: вона зіллється з лізосомою. Якщо ж мембрана ендосоми містить цераміди, то вона зіллється с поверхневою мембраною клітини, і більшість екзосом виштовхнеться у позаклітинне середовище.
Механізм поглинання клітинами ссавців екзосом наразі погано вивчений. Цей механізм містить ендоцитоз, який активується екзосомою шляхом фосфорилювання позаклітинної регульованої кінази-1/2 (ERK1/2), що передає цей сигнал на білок теплового шоку 27 (HSP27). Процес ендоцитозу негативно регулюється білком кавеоліном-1.
До складу екзосом входять білки, ліпіди, мікро-РНК, уміст яких неодмінно залежить від типу клітин, що їх виділили, а також їх фізіологічного стану.
Екзосоми містять такі складові:
— анексини (Rab5b, AP-1, SNAP, Arp2/3) — речовини, що регулюють процес злиття їх мембрани з мембраною клітини;
— білки ESCRT — ендосомний комплекс сортування, що забезпечує мiжклітинну передачу білків та РНК;
— CD63, CD81, CD9 — трансмембранні білки — маркери екзосом;
— PDCD6IP — білок екзосом, який бере участь у запрограмованій клітинній смерті;
— мембранні білки головного комплексу гістосумісності МНС та білки стресу, або білки теплового шоку (HSP60, HSP70, HSP90) [1].
В організмі людини і тварини екзосоми виконують різні функції:
1. Міжклітинна комунікація. Клітини комунікують з іншими клітинами за допомогою екзосом. У деяких випадках везикули зв’язуються з сусідніми клітинами і виділяють мікро-РНК усередину клітини [1].
2. Імуномодулююча функція. Екзосоми транспортують на собі білки головного комплексу гістосумісності — МНС класу І та ІІ, необхідного для імунної відповіді, у спеціалізовані Т-лімфоцити. Також на їх мембрані наявний спеціальний рецептор HLA-G, що забезпечує презентацію антигена. NK-клітини також виділяють екзосоми. Вони мають речовини, що при взаємодії з мембраною клітини (ракові клітини) викликають її апоптоз [2].
3. Поширення вірусів і пухлинних клітин. Пухлини і віруси здатні поширюватись за допомогою екзосом. Везикули пухлин інгібують імунну відповідь і провокують метастазування. До того ж вони здатні доставляти мікро-РНК у здорову клітину, змінюючи цим експресію генів і порушуючи їх адекватну роботу.
4. Регенеративна функція. Екзосоми відіграють важливу роль у відновленні пошкоджених органів. Позаклітинні везикули секретують гемопоетичні стовбурові клітини, які мають унікальну здатність захищати клітини, що залишилися в пошкоджених тканинах, від загибелі та стимулювати їх поділ. Це відбувається через те, що мембрани цих везикул багаті на біологічно активні ліпіди, а на поверхні екзосом синтезуються ростові та антиапоптозні фактори [1].
Матеріали та методи виділення екзосом
Дослідження екзосом мають велике практичне значення. Наприклад, вони можуть багато сказати про стан організму. З екзосом, що містяться в плазмі крові, сечі та інших біологічних рідинах, можна отримати мікро-РНК для діагностики.
Екзосоми містять білки, мікро-РНК та мРНК тієї клітини, з якої вони походять. Це дозволяє використовувати їх для фенотипування та ідентифікації клітин та патологічних процесів, що в них відбуваються. Особливе значення мають екзосоми, що утворюються в онкотрансформованих клітинах.
Підготовчий етап у дослідженні екзосом полягає у використанні перещеплюваних культур клітин людини ECV-304 (трансформовані клітини ендотелію), клітин гліоми-Т і гліоми-В (первинні лінії гліального походження). Ці клітини культивують у середовищі DMEM або RPMI-1640, яке містить 5 % ембріональної сироватки, без антибіотиків, в атмосфері 5% СО2 при 37 °С.
У міру зростання клітин збирають культуральне конденсоване середовище (КС), проводять послідовне центрифугування в режимі 2000 і 10 000 g для видалення з КС мертвих клітин і їх уламків, далі отримане КС об’ємом 500 мл концентрують за допомогою ультрафільтрації до кінцевого об’єму 10 мл. Надалі для виділення екзосом з отриманих препаратів концентрованого КС можна застосувати такі підходи:
1. Ультрацентрифугування проводять на центрифузі в режимі 100 000 g протягом 2 годин. Після центрифугування надосадову рідину збирають в окрему пробірку і досліджують методом лазерної кореляційної спектроскопії (ЛКС) для перевірки видалення з неї часточок екзосомального розміру, осад розчиняють в максимальному об’ємі фосфатно-сольового буфера і повторно центрифугують при тих же умовах. Отриманий осад розчиняють в 100 мкл води, розбивають на аліквоти, які заморожують при –80 °С для подальших протеомних досліджень.
2. Імуноосадження екзосом з концентрованим КС проводять за допомогою імуноафінної хроматографії з використанням антитіл, що зв’язують білкові маркери, часто спостерігаються на поверхні екзосом. Як антигени маркерів екзосом використовують головний комплекс гістосумісності першого типу (HLA-ABC), присутній на поверхні практично всіх різновидів клітин, і прийнятий поверхневий маркер екзосом — тетраспанін CD63. Моноклональні антитіла до HLA-ABC або СD63 (Becman Coulter) додають до досліджуваного концентрованого КС і інкубують протягом 1–2 годин при 4 °C, після чого додають 100 мкл розчину білок-асефарози. Після 2-годинної інкубації при 4 °C надосадову рідину збирають в окрему пробірку для контролю видалення з КС часточок екзосомального розміру (за допомогою ЛКС), а імунопреципітат збирають центрифугуванням (3000 g, 5 хв при 4 °C). Осад промивають 2–4 рази в 1 мл фосфатно-сольового буфера і центрифугують при тих же умовах. Отриманий осад розчиняють в 100 мкл стандартного електрофоретичного буфера і заморожують при –80 °С для подальших протеомних досліджень.
Для протеомних досліджень використовують такі методи:
1. Одновимірний електрофорез препаратів екзосом. Його проводять в присутності SDS з концентрацією поліакриламіду 10 % у розділеному гелі та 5 % у концентрованому гелі. Аналізовані зразки поміщають у стандартний буфер для нанесення (0,065 М Тріс, рН 6,8, 2 % SDS, 1 % ДТТ, 10 % гліцерину, 0,01 % бромфенолового блакитного) і прогрівають на водяній бані протягом 2 хв. Зразки білка наносять в кількості 10–30 мкг на доріжку. Концентрацію білка в зразках вимірюють за допомогою методу Бредфорда. Білки після електрофорезу в ПААГ фарбують за допомогою барвника Кумассі R350.
2. Двовимірний електрофорез (2DE). Для 2DE використовують методичні підходи, описані раніше. Зразки, що містять до 2 мг білка, розчиняють в 100 мкл лізуючого буфера (7 М сечовини, 2 М тіосечовини, 4 % CHAPS, 1 % ДTT, 2 % IPG буфера, pH 3–10, суміш протеазних інгібіторів, 0,001 % бромфенолового блакитного). Білки поділяють ізоелектрофокусуванням, використовуючи 7-сантиметрові смужки (рH 3,0–10,0). Зразки в лізуючому буфері (50–500 мкг) змішують з регідруючим буфером (7 М сечовини, 2 М тіосечовини, 2 % CHAPS, 0,3 % ДTT, 2 % IPG буфер, діапазон pH той же, що і в смужці, 0,001 % бромфенолового блакитного) в кінцевому об’ємі 200 мкл. Щоб підготувати смужки для поділу в першому напрямку, їх замочують при 10 °C, поміщаючи гелем вниз до регідруючого розчину в спеціальній кюветці. Потім ведуть ізоелектрофокусування при 20 °C. Смужки перед другим напрямом вимочують (2 × 10 хв) у врівноваженому розчині (65 мМ Тріс-HCl, pH 6,8, 6 M сечовини, 2 % SDS і 30 % гліцерину), що містить спочатку 1 % ДTT, а потім 5 % йодацетаміду. Кожну смужку потім поміщають зверху на гель іншого напрямку і закріплюють заливкою 1 мл гарячого розчину (0,5%) агарози, що містить електродний буфер TGS (25 мМ Тріс, pH 8,3, 200 мМ гліцин і 0,1 % SDS).
3. Мас-спектрометрія. Після поділу за допомогою 2DE і фарбування Кумассі R350 шматочки гелю діаметром 1–1,5 мм, які відповідають білковим плямам, вирізають, використовуючи наконечники для мікропіпеток, і частково знебарвлюють за допомогою 15-хвилинної інкубації в 500 мкл 50% ацетонітрилу (ACN), що містить 25 мМ бікарбонату амонію (АБК). Далі шматочки стискають 10-хвилинною інкубацією в 200 мкл 100% ACN. ACN видаляють, і гель висушують протягом як мінімум 20 хв на центрифузі. Висушені шматочки гелю вимочують протягом 25 хв на льоду в 12 мкл 25-мМ розчину бікарбонату амонію, що містить трипсин. Надлишок розчину видаляють, додають 10 мкл розчину 25-мМ АБК і проводять протеоліз білка інкубацією при 37 °С протягом не менше 4 год. Продукти гідролізу змішують (по 1 мкл) прямо на пластинці для мас-спектроскопії з матриксом CHCA (α-cyano-4 hydroxycinnamic acid), розчиненим у концентрації 10 мг/мл в 50% ACN, що містить 0,1 % трифтороцтової кислоти, кристалізують в потоці повітря і аналізують. Спектри отримують в режимі відображення, використовуючи приблизно 50–100 лазерних пострілів по всій площі мішені. Сумарні спектри аналізують, використовуючи спеціальні програми.
Результатом подібного екзосомального дослідження є формування білкового профілю, що дозволяє провести ідентифікацію та діагностику стану певної тканини або органа [4].
Обговорення
Завдяки своїй високій специфічності дії екзосоми можуть використовуватися у клінічній практиці як транспортери для певних видів ліків, що доставляють їх до клітин-мишеней, знижаючи можливість мутацій, особливо при онкозахворюваннях [5].
Крім того, по екзосомах, які є в плазмі крові, сечі, слині та інших біологічних середовищах, є можливість встановити не тільки діагноз, але і стадію захворювання, що дозволить відмовитись від біопсії.
Екзосоми, виділені із гемопоетичних стовбурових клітин, здатні захищати пошкоджені клітини від загибелі, стимулюючи відновлення поділу клітин, тому що на поверхні екзосом синтезуються ростові антиапоптозні фактори, що може бути використано при лікуванні гострого ішемічного інсульту, інфаркту міокарда, ішемії нижніх кінцівок, затримки регенерації кісткової тканини та інших тяжких захворювань.
Висновки
Отже, незважаючи на те, що функції екзосом знаходяться на стадії дослідження і повністю не вивчені, потрібно дійти висновку, що за допомогою екзосом у найближчі роки будуть зроблені значні кроки в діагностиці та терапії тяжких захворювань.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
1. Джагаров Д.Э. Экзосома — механизм координации и взаимопомощи клеток организма. Биомолекула. 2013.
2. Джагаров Д.Э. Экзосомы — бутылочная почта организма. Химия и жизнь — XXI век. 2013. № 6. С. 6-9.
3. Куприн А.С. Строение и функции экзосом. Роль экзосом в патологических процессах. Молодежный научный форум «Естественные и медицинские науки»: электр. сб. ст. по мат-лам XXIII междунар. студ. науч.-практ. конф. № 4(22).
4. Штам Т.А., Нарыжный С.Н., Ланда С.Б., Бурдаков В.С., Артамонова Т.О., Филатов М.В. Получение и анализ экзосом, секретируемых злокачественно трансформированными клетками человека в системах in vitro. Цитология. 2012. Т. 54. № 5. С. 430-438.
5. Чевкина Е.М., Щербаков А.М., Журавская А.Ю. Экзосомы и передача (эпи)генетической информации опухолевыми клетками. Успехи молекулярной онкологии. 2015. С. 125-140.

/85-1.jpg)