Статтю опубліковано на с. 69-72
Актуальність проблеми
Посттравматичне порушення кісткової регенерації при лікуванні хворих з переломами, особливо з огляду на зростання частки високоенергетичної травми та травматизму в цілому, є актуальною проблемою ортопедії й травматології. Останнє десятиліття як в Україні, так і у світі, за даними офіційної статистики, травматизм серед загальної захворюваності населення посідає четверте місце з динамікою зростання. За даними різних авторів, кількість хворих з порушенням консолідації переломів коливається від 15,5 до 27 % [2, 7, 8]. Варто відмітити, що проблема порушення репаративних процесів при травмі може виникати незалежно від використання тієї чи іншої методики оперативного лікування, а їх першопричиною може бути цілий комплекс факторів.
Уперше науковим вивченням причин порушення консолідації та визначенням поняття «хибний суглоб» займались ще у ХІХ столітті G. Bezier та Claudius. У 1973 році B.G. Weber, О. Cech запропонували свою класифікацію, згідно з якою псевдоартрози залежно від активності перебігу відновних процесів було розподілено на біологічно реактивні (вітальний тип) та біологічно ареактивні (авітальний тип) [12]. Дана класифікація враховувала конкретні причини порушення консолідації і, відповідно, наштовхувала на кардинально різні підходи до лікування. Також вона стала фундаментом для формування сучасних поглядів на класифікацію порушень зрощення переломів, зокрема класифікацію АО [13]:
1. Сповільнена консолідація.
2. Діафізарні незрощення:
— гіпертрофічне незрощення;
— аваскулярне незрощення з втратою кісткової тканини та без неї;
— атрофічне незрощення;
— псевдоартроз.
Кожен ортопед-травматолог, проводячи операцію, ставить за мету надійну та анатомічну фіксацію уламків, тобто лише допомагає природним механізмам організму. Проте ця допомога концентрується на дотриманні важливого балансу між створенням сприятливих умов для формування регенерату та мінімальною травматизацією тканин. Основним з постулатів АО є твердження, що перелом — це в першу чергу травма м’яких тканин з пошкодженою кісткою всередині [13]. Відповідно підхід до лікування переломів завжди має бути комплексним та зваженим, орієнтованим на забезпечення п’яти основних факторів впливу на перебіг зрощення (згідно з «діамантовою» концепцією): механічна стабільність уламків, стан локального кровопостачання, дефіцит кісткової тканини, рівень активності клітинних елементів, гуморальних факторів росту [14]. На сучасному етапі розвитку ортопедії й травматології кожен лікар має досить великий перелік пристроїв, що можуть забезпечити успіх оперативного лікування: інтрамедулярні блоковані та неблоковані стрижні, накісткові пластини різних модифікацій, у тому числі типів LISS та MIPO, позавогнищеві спицеві та стрижневі фіксатори. Незважаючи на все сказане, неможливо виділити золотий стандарт металоостеосинтезу (МОС), який би міг повною мірою гарантувати зрощення перелому [2, 3].
Відомі негативні фактори впливу на репаративні процеси поділяються на доопераційні: високоенергетична травма, відкриті переломи, повторні репозиції, супутня соматична патологія, порушення обміну речовин; операційні: невдала репозиція, неадекватно широкий операційний доступ, скелетування уламків, пошкодження живильних судин, розсвердлювання кістковомозкового каналу) та післяопераційні (неадекватність фіксації й навантаження) [1].
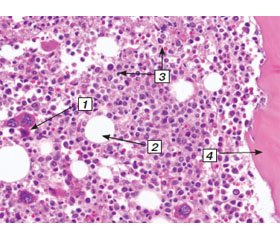
До цього часу головною концепцією лікування при порушенні репаративної регенерації переломів була й залишається вичікувальна тактика з фізіотерапевтичною стимуляцією та повторним хірургічним лікуванням, що включає висічення рубцево змінених тканин, декортикацію, один із методів кісткової пластики та ре-МОС. Незважаючи на всі зусилля, довгоочікуваного зрощення в багатьох випадках досягти не вдається. Саме тому пошук нових, більш ефективних методів лікування триває. Деякого поширення в останні роки набувають стимуляційні методики лікування хворих зі сповільненою консолідацією, такі як введення між уламками плазми, збагаченої тромбоцитами, фракції білків BMP, цільної автокрові, окремих клітинних фракцій червоного кісткового мозку. Відомо, що частота порушень консолідації змінюється з віком та при ускладнених переломах [3, 5–7]. Цих хворих об’єднує стан червоного кісткового мозку в цілому та недостатня кількість поліпотентних клітин-попередників остеогенезу, які визначають рівень репаративної потенції кістки. Адже, на відміну від дитячих довгих трубчастих кісток та плоских кісток у дорослих, порожнини трубчастих кісток у дорослому віці заповнені жовтим кістковим мозком, вміст у якому гуморальних факторів росту та мультипотентних мезенхімальних стовбурових клітин значно нижчий, ніж у червоному кістковому мозку, що добре видно на гістологічних препаратах (рис. 1, 2).
/70.jpg)
Мета роботи: оптимізація процесів консолідації у хворих з посттравматичним порушенням остеорегенерації кістки за рахунок пункційного введення нативного автологічного кісткового мозку, індукованого кристалічним хімотрипсином.
Матеріали та методи
Проведено ретроспективний аналіз історій хвороби і проспективне спостереження за 44 пацієнтами з порушенням консолідації переломів. Усі хворі були віком від 20 до 70 років. Розподіл за статтю: 77,5 % чоловіків та 22,5 % жінок. Більшість хворих (65,9 %) належали до соціально активної, працездатної групи громадян. У частини хворих (38,6 %) спостерігалось порушення зрощення перелому внаслідок високоенергетичної травми. Судинні порушення виявлено в 15,9 % пацієнтів. У переважної більшості пацієнтів (79,5 %) сповільнення зрощення кісток можна було пов’язати з наявністю багатоуламкового перелому. Усім хворим, які отримували стандартне комплексне лікування, нами застосовувалась методика автотрансплантації нативного кісткового мозку, індукованого кристалічним хімотрипсином, яку розробив та впровадив В.Й. Зоря [4]. У своїй роботі ми керувались загальновідомою інформацією [10, 11] про те, що, крім клітин-попередників, кістковий мозок включає живильні речовини, стимулятори остеогенезу, біологічно активні речовини, уламки спонгіозної кісткової тканини. При введенні між уламками кісток кісткового мозку він може сприяти запуску механізму репаративної регенерації й стимулювати зрощення. Використання кристалічного хімотрипсину зумовлене тим, що він впливає на нормалізацію окислювально-відновних процесів, покращує засвоєння тканинами кисню, активує процеси колагеноутворення, обмін глікозаміногліканів і амінополісахаридів, лізує некротизовані тканини, тим самим відкриває доступ до гаверсових каналів. В експериментах виявлено також позитивний вплив трипсинізації кісткового мозку на ефективність утворення колоній фібробластів у моношарових культурах. До вибірки потрапили 44 пацієнти з такими діагнозами: сповільнена консолідація перелому; перелом, що не зрісся; гіпертрофічне та аваскулярне незрощення. В усіх випадках на момент проведення пункційної стимуляції уламки були стабільно фіксовані за рахунок накісткових, інтрамедулярних фіксаторів та стрижньових і спицевих апаратів зовнішньої фіксації. Клінічні випадки з дефектом кісткової тканини, міграцією металофіксаторів та нестабільністю основних уламків в групу не потрапили, оскільки вимагали проведення повторного оперативного лікування.
Першим етапом проведення пункційної стимуляції остеогенезу нативним кістковим мозком, індукованим кристалічним хімотрипсином, було проведення напередодні шкірної проби на чутливість до кристалічного хімотрипсину. Алергічна реакція спостерігалась лише в одного пацієнта, тому він до вибірки не потрапив. Отже, в стерильних умовах проводили установку 1–2 голок Касирського або ін’єкційних голок товщиною 15 gauge у щілину між уламками, орієнтуючись за рентгенівськими знімками та пальпаторно, за необхідності виконували рентгенологічний контроль.
Забір пунктату кісткового мозку проводили за допомогою пункційної голки MCN22 товщиною 15G у стерильних умовах з гребеня клубової кістки, помістивши попередньо в шприц кристалічний хімотрипсин 20–40 мг. Зважаючи на те, що при аспірації значної кількості кісткового мозку з одного доступу його якісний склад погіршується, цільовою кількістю було 5 мл. Після чого отриману суміш нативного кісткового мозку разом з хімотрипсином через попередньо встановлені голки вводили в зону перелому, ділянки проколів заклеювали асептичними пов’язками.
Результати досліджень та їх обговорення
Запальних, гнійних, алергічних чи інших ускладнень у короткостроковому періоді нами не було виявлено, що певною мірою свідчить про безпечність даного методу для здоров’я пацієнта. Серед технічних складностей методу варто відмітити, що в деяких випадках ущільнення тканин між уламками заважало нагнітанню, вимагаючи значних зусиль для введення всього об’єму трансплантату.
Рентгенологічний контроль проводили в період 4–6 тижнів після стимуляції, під час його було виявлено формування кісткової мозолі з подальшим її ущільненням та консолідацією перелому. Загалом при лікуванні посттравматичних порушень кісткової регенерації пункційним введенням автологічного кісткового мозку, індукованого кристалічним хімотрипсином, ми отримали такі результати: зрощення відбулось в усіх випадках зі сповільненою консолідацією — у 34 пацієнтів (100 %), при переломах, що не зрослись, — у 9 з 10 пацієнтів (90,0 %), загалом у 43 з 44 пацієнтів (97,7 %). Питання такої стимуляції остеогенезу потребує подальшого опрацювання та порівняльного аналізу, з можливим подальшим розширенням показань.
Висновки
1. Автотрансплантація нативного кісткового мозку при порушеннях консолідації переломів стимулює репаративну регенерацію та сприяє зрощенню перелому.
2. Методика забору та введення пунктату кісткового мозку відрізняється відносною технічною простотою виконання та малоінвазивністю, що вказує на можливість її впровадження в клінічну практику за умови подальшого удосконалення та вивчення віддалених результатів лікування.
3. Під час комплексного лікування з додатковою стимуляцією остеогенезу нативним кістковим мозком, індукованим кристалічним хімотрипсином, 44 пацієнтів з порушенням консолідації переломів зрощення досягнуто в 43 випадках (97,7 %) та не виявлено ускладнень, що певною мірою дозволяє говорити про безпечність та ефективність методики.
Список литературы
1. Андрейчин В.А., Білінський П.І. Системний аналіз оперативного методу лікування діафізарних переломів і фактори впливу на репаративну регенерацію // Травма. — 2014. — № 6.
2. Анкін М.Л., Шмагой В.Л. Значимість патогенетичного підходу та обсягу реостеосинтезу в лікуванні порушень консолідації переломів діафіза кісток гомілки // Травма. — 2015. — № 2.
3. Горидова Л.Д., Дедух Н.В. Репаративная регенерация кости в различных условиях // Травма. — 2009. — № 1.
4. Зоря В.И., Ярыгин Н.В., Азарян Г.Р. и др. Пат. 2195216 от 17.11.00. Способ ускоренного сращения костных отломков.
5. Камінська М.О., Дігтяр В.А., Харитонюк Л.М., Садовенко О.Г. Лікування посттравматичних порушень репаративної регенерації переломів кісток у дітей // Травма. — 2012. — № 2.
6. Климовицький В.Г. Симпозіум «Переломи, що не зрослися, та хибні суглоби» / Климовицький В.Г. // Травма. — 2012. — № 4. — 166-174.
7. Климовицкий В.Г., Черныш В.Ю. Частота замедленной консолидации переломов у пострадавших разных возрастных групп и влияние на нее остеотропной терапии // Травма. — 2011. — № 3.
8. Корж Н.А. Репаративная регенерация кости: современный взгляд на проблему / Корж Н.А., Дедух Н.В. // Ортопедия, травматология и протезирование. — 2006. — № 1 — С. 77-89.
9. Лациник Н.В. Влияние трипсинизации костного мозга на эффективность образования колоний фибробластов в монослойных культурах / Н.В. Лациник, С.Ю. Сидорович, А.Я. Фриденштейн // Бюллетень эксперим. биологии и медицины. — 1981. — Т. 92, № 9. — С. 356-358.
10. Лациник Н.В., Горская Ю.Ф., Грошева А.Г. и др. Содержание стромальных колониеобразующих клеток (КОКф) в костном мозге мышей и клональная природа образуемых ими колоний фибробластов // Онтогенез. — 1986. — Т. 17, № 1. — С. 27-35.
11. Фриденштейн А.Я., Чайлахян Р.К., Герасимов Ю.В. Пролиферативные и дифференциальные потенции скелетогенных костномозговых колониеобразующих клеток // Цитология. — 1986. — Т. 28, № 3. — С. 341-349.
12. Weber B.G., Cech O. Pseudarthrosen. Pathophysiologie, biomechanik, therapie, ergebnisse. — Bern-Stuttgart-Wien: Hans Huber, 1973. — 237 p.
13. Thomas P. Rüedi, Richard E. Buckley, Christopher G. Morgan. AO Principles of fracture management. — 2nd expended edition by AO published. — 2007. — Р. 10-25, 504-520.
14. Giannoudis F. Enhancement of fracture healing with the diamond contept: The role of the biological chamber / F. Giannoudis // Injury. — 2011. — 42. — P. 1191-1193.

/70.jpg)