Журнал «Травма» Том 15, №1, 2014
Вернуться к номеру
Патогенетическое обоснование применения бисфосфонатов при постменопаузальном остеопорозе
Авторы: Орленко В.Л. - Государственное учреждение «Институт эндокринологии и обмена веществ им. В.П. Комиссаренко НАМН Украины», г. Киев
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
В статье представлены современные данные о проблеме остеопороза, его высокой распространенности, описаны особенности бессимптомного течения с последующим развитием серьезных осложнений. В формировании остеопоротических изменений в костях важная роль принадлежит нарушениям в гормональной регуляции ремоделирования. Целый ряд системных гормонов оказывает влияние на обмен в костной ткани: глюкокортикоиды, тироксин, эстрогены, соматотропный гормон и другие. Детально описаны диагностические маркеры синтеза и резорбции костной ткани. Особое внимание уделено лечению бисфосфонатами — препаратами с антирезорбтивной активностью, детально обосновано их патогенетическое применение у пациенток с постменопаузальным остеопорозом.
У статті представлені сучасні дані про проблеми остеопорозу, його високу поширеність, описані особливості безсимптомного перебігу з подальшим розвитком серйозних ускладнень. У формуванні остеопоротичних змін у кістках важлива роль належить порушенням гормональної регуляції ремоделювання. Ціла низка системних гормонів впливає на обмін в кістковій тканині: глюкокортикоїди, тироксин, естрогени, соматотропний гормон та інші. Детально описані діагностичні маркери синтезу та резорбції кісткової тканини. Особливу увагу приділено лікуванню бісфосфонатами — препаратами з антирезорбтивною активністю, детально обґрунтовано їх патогенетичне застосування у пацієнток із постменопаузальним остеопорозом.
The authors present the current data on the problem of osteoporosis, its high prevalence, they describe the features of asymptomatic course with subsequent development of serious complications. An important role in osteoporotic changes in the bones belongs to disturbances in hormonal regulation of remodeling. A number of systemic hormones affect bone tissue metabolism: glucocorticoids , thyroxine, estrogens, growth hormone, etc. Diagnostic markers of synthesis and resorption of bone tissue are described in detail. Particular attention is paid to the treatment with bisphosphonates — drugs with antiresorptive activity, their pathogenetic use in patients with postmenopausal osteoporosis has been justified in detail.
остеопороз, цикл ремоделирования, бисфосфонаты, маркеры синтеза и резорбции костной ткани.
остеопороз, цикл ремоделювания, бісфосфонати, маркери синтезу та резорбції кісткової тканини.
osteoporosis, remodeling cycle, bisphosphonates, markers of synthesis and resorption of bone tissue.
Статья опубликована на с. 27-35
Остеопороз (ОП) — прогрессирующее системное заболевание скелета, характеризующееся снижением костной массы и нарушением микроархитектоники костной ткани, что приводит к повышению хрупкости костей и увеличению риска переломов. По мнению ряда исследователей, это заболевание, особенно в развитых странах, приобрело характер «безмолвной эпидемии». Остеопороз занимает особое место в группе заболеваний костно-мышечной системы в связи с высокой распространенностью, длительным бессимптомным течением и последующим развитием серьезных осложнений. Особую актуальность проблема ОП приобретает у женщин в период постменопаузы, когда потеря костной массы провоцируется возрастными гормональными изменениями.
Наиболее полная статистика по этой проблеме собрана в США. Ежегодно фиксируется 1,5 млн переломов, связанных с остеопорозом, из них 700 тыс. переломов позвоночника, 250 тыс. переломов шейки бедра, 250 тыс. переломов дистального отдела лучевой кости и 300 тыс. переломов в других частях скелета. Риск переломов позвоночника, шейки бедра и дистального отдела лучевой кости составляет 40 % для белых женщин и 15 % для белых мужчин в возрасте 50 лет и старше. До 50 % больных с переломом шейки бедра не могут обходиться без посторонней помощи, а от 15 до 20 % больных умирают в течение 1 года. Количество остеопоротических переломов в мире увеличивается и с 1,7 млн в 1990 г. возрастет до 6,3 млн в 2050 г. [1, 2].
В связи с этим остеопороз становится важной социально-экономической проблемой. Необходимо подчеркнуть, что заболевание протекает асимптомно до тех пор, пока не случится низкоэнергетический перелом. Он — самое распространенное осложнение остеопороза: остеопоротические переломы отмечаются у половины всех женщин, находящихся в периоде постменопаузы, а также у мужчин старших возрастных групп [3]. По данным Российской ассоциации по ОП, каждые 5 минут в России происходит перелом шейки бедра, вызванный ОП, а в год из-за него происходит 9 млн переломов периферического скелета и более 3 млн случаев переломов позвонков (www.osteoporoz.ru). Пациенты, перенесшие один остеопоротический перелом, имеют высокий риск повторных переломов. Социальная значимость остеопороза определяется его последствиями — переломами позвонков и костей периферического скелета, что приводит к росту заболеваемости, инвалидности и смертности среди женщин пожилого возраста. Среди городского населения России у 24 % женщин в возрасте 50 лет и старше отмечают по крайней мере один клинически выраженный перелом. В России ежегодная частота переломов дистального отдела предплечья у женщин старше 50 лет составляет 563,8 на 100 000 населения того же возраста, проксимального отдела бедренной кости — 122,5 на 100 000. Предполагают, что увеличение продолжительности жизни женщин до 80 лет приведет к возрастанию частоты переломов шейки бедренной кости до 6,25 млн в 2050 г. и превысит показатели 1990 г. (1,66 млн) более чем в 3 раза. Следовательно, наиболее важной целью лечения ОП является предотвращение переломов [4].
Согласно классификации системный ОП подразделяется на первичный и вторичный. К первичному ОП относится постменопаузальный (первый тип), сенильный (второй тип, или инволюционный), ювенильный и идиопатический. Ко вторичному ОП приводят заболевания эндокринной системы, органов пищеварения, почек, крови, ревматизм, системные заболевания. Факторы риска развития ОП: женский пол, генетические или конституциональные, наследственные факторы (семейные формы, переломы у матери), хрупкое телосложение, длинная шейка бедра, позднее менархе (после 15 лет), ранняя менопауза (до 45 лет), более 3 родов или отсутствие родов, длительная лактация (более 6 мес.), ранняя овариэктомия, ановуляция, олиго-, аменорея. Неправильный образ жизни и питания: дефицит питания и кальция, злоупотребление кофе, алкоголем, курение, интоксикации, малоподвижный образ жизни, длительная иммобилизация, длительное парентеральное питание, низкая масса тела. К заболеваниям, предрасполагающим к развитию ОП, относятся нервная анорексия, гастродуоденальная и гепатобилиарная патология и связанная с ними мальабсорбция, первичный гиперпаратиреоидизм, тиреотоксикоз, первичный гипогонадизм, пролактинома, гиперкортицизм, ревматоидный артрит, хроническая обструктивная патология легких, хроническая неврологическая патология, хронические заболевания почек, диабет I типа, состояние после трансплантации, а также длительная терапия кортикостероидами, антикоагулянтами, антиконвульсантами, антацидами, хемотерапия, лечение гонадотропин-РГ (агонист- или антагонист-терапия) и др. Доля постменопаузального остеопороза среди всех форм остеопороза составляет 85 %. Частота постменопаузального остеопороза в развитых странах среди женщин белой расы составляет 25–40 %. При денситометрическом обследовании в соответствии с критериями ВОЗ остеопороз выявлен у 30,5–33,1 % женщин в возрасте 50 лет и старше [2, 5].
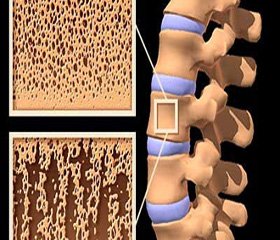
Костная ткань является разновидностью соединительной и вместе с хрящевой образует скелет. Для выполнения своих функций (движение, защита внутренних органов, костного мозга и нервной системы) скелет должен быть прочным, а следовательно, жестким и гибким одновременно. Жесткость кости придают минералы (кальций, фосфор), а гибкость — органический матрикс (коллаген I типа и неколлагеновые белки: остеокальцин, остеонектин, остеопонтин и др.). В течение всей жизни человека, начиная с рождения и дальше, и жесткость, и гибкость кости снижаются, поскольку происходит потеря минералов и повреждение матрикса. Для того чтобы противостоять этим проявлениям старения, в кости существует процесс постоянного обмена (ремоделирования), обеспечивающий обновление всего скелета 3–4 раза за жизнь. Способность костной ткани к самостоятельному ремоделированию способствует не только адаптации и обновлению, но и заживлению переломов, трещин, а также микропереломов. Таким образом, ремоделирование кости — это процесс, работающий в течение всей жизни и направленный на восстановление и сохранение скелета как структурного и функционального органа [6].
Ремоделирование выполняется двумя основными клетками костной ткани: остеокластами, резорбирующими кость, и остеобластами, формирующими новую кость. Остеокласты — многоядерные гигантские клетки, происходящие из мононуклеарных фагоцитов, продуцируемых гематопоэтической системой. Прикрепившись к кости, остеокласты начинают продуцировать множество протеолитических ферментов, разрушающих матрикс кости, а также ионы водорода, рассасывающие кристаллы гидроксиапатита. Весь процесс резорбции кости занимает обычно несколько дней. Процесс костеобразования, продолжающийся несколько недель, выполняется остеобластами. Последние происходят из предшественников — мезенхимальных или стромальных стволовых клеток. Остеобласты значительно меньше размером, чем остеокласты, и имеют одно ядро. Они синтезируют остеоид, органический матрикс кости, и ответственны за дальнейшую его минерализацию. Примерно один из десяти остеобластов при образовании нового костного матрикса остается замурованным внутри и превращается в остеоцит.
Костное ремоделирование — гомеостатический процесс, вовлекающий повторные циклы резорбции и депозиции новой кости. В норме ежедневно в различных частях скелета работают от 2 до 5 млн единиц (мест) костного ремоделирования, каждая из которых состоит из нескольких остеокластов и множества остеобластов. Важно понимать, что все процессы тесно взаимосвязаны: костная резорбция предшествует костеобразованию и связана с целым рядом сложнейших метаболических изменений. Предшественники остеобластов вырабатывают ряд веществ, способных связываться с рецепторами остеокластов, и, как это ни парадоксально, усиливают дифференцировку и активацию остеокластов. Ведущую роль среди них играют макрофаг-колониестимулирующий фактор (М-КСФ) и лиганд RANK (рецептор активации фактора NF-kB). Мононуклеары обеспечивают условия для работы новых остеобластов, синтезирующих компоненты органического матрикса для восстановления дефекта кости. Активация одних клеток приводит к активации других, так что количество резорбированной ткани соответствует количеству вновь образованной кости. Затем наступает период относительного покоя, сменяющийся периодом незначительной активности клеток, далее проходит новый цикл ремоделирования. Дефицит эстрогенов после наступления менопаузы приводит к увеличению скорости костного ремоделирования, при этом увеличивается количество резорбированной кости и снижается объем вновь образованной, что приводит к потере массы кости и ее структурным нарушениям. Постменопаузальный ОП характеризуется гиперактивностью остеокластов, приводящей к столь высокой скорости потери кости, что для компенсации последствий работы нескольких аномально активированных остеокластов требуется несколько месяцев деятельности многочисленных остеобластов. В связи с указанным процессом за первые 10 лет от наступления менопаузы женщина теряет 20–30 % трабекулярной и 5–10 % кортикальной кости. Одновременно ухудшается качество кости: уменьшается ее объем и толщина трабекул, снижается их количество [7, 8].
В менопаузе происходит резкое снижение синтеза половых гормонов яичниками, и через 3–5 лет он практически прекращается. Снижение уровня эстрогенов ведет к ускорению костного обмена, что проявляется потерей костного вещества. Стартовая минеральная плотность костной ткани (МПКТ) и скорость потери костного вещества определяют риск развития остеопороза. В старости сниженная мобильность, недостаточные инсоляция и потребление кальция и витамина D относятся к типичным факторам риска развития остеопороза. Дефицит витамина D приводит к ускоренному костному обмену в результате развития вторичного гиперпаратиреоза. Таким образом, половые гормоны оказывают выраженное влияние на костную ткань в пубертатном и репродуктивном периодах. На тесную взаимосвязь половых гормонов и костной системы указывают: раннее закрытие зон роста трубчатых костей и остановка роста при преждевременном половом созревании; позднее закрытие зон роста трубчатых костей при задержке полового созревания; низкая МПКТ при дисгенезии гонад и первичной аменорее; снижение МПКТ при вторичной гипер- и гипогонадотропной аменорее, при гиперпролактинемии, после овариэктомии, в постменопаузе; высокая МПКТ у женщин с гиперандрогенией; снижение МПКТ на фоне заместительной гормональной терапии более 6 мес.; торможение процессов резорбции костей (по данным денситометрии) и повышение МПКТ на фоне заместительной гормональной терапии половыми гормонами. Ясно, что эстрогены у женщин и андрогены у мужчин чрезвычайно важны для формирования и поддержания достаточной костной массы [5, 15].
До 1988 г. влияние эстрогенов на костную ткань объясняли различными опосредованными механизмами: снижением синтеза кальцитонина и всасывания кальция в кишечнике, а также снижением реабсорбции кальция почками и усилением синтеза паратгормона и др. В последующем эстрогеновые рецепторы были обнаружены на остеокластах, остеоцитах, на трабекулярных активных и неактивных остеобластах, а также на костных эндотелиальных клетках. Исследования последних лет выявили способность эстрогенов оказывать прямой тормозящий эффект на продукцию нескольких лизосомальных ферментов в остеокластах, тормозя таким образом резорбцию костной ткани. Непрямое влияние эстрогенов на остеокласты может осуществляться посредством стимуляции инсулиноподобных факторов роста и остеокальцина, способствующих формированию костей и даже использующихся для терапии остеопороза. Защитный эффект эстрогенов на костную ткань реализуется через активацию кальцитонина, оказывающего ингибирующее действие на остеокласты, а также через снижение чувствительности рецепторов костной ткани к паратгормону, который оказывает стимулирующий эффект на остеокласты. Эстрогены могут также ингибировать продукцию интерлейкина-6, тем самым снижая активность остеокластов [16].
В эксперименте показано, что эстрогены и антиэстрогены в равной степени защищают кость посредством стимуляции синтеза ТФР-b3. Установлено также, что эстрогены оказывают прямое влияние на почки, усиливая реабсорбцию кальция. Поэтому в постменопаузе на фоне дефицита эстрогенов реабсорбция кальция в почках снижается [17].
Влияние эндогенного прогестерона на костную ткань изучено пока недостаточно. В эксперименте показано, что прогестерон оказывает прямой стимулирующий эффект на остеобласты, синтез цитокинов и ИПФР-II. В ответ на введение прогестерона костная масса увеличивается. Таким образом, низкая пиковая масса костной ткани и ускоренная потеря ее в постменопаузе на фоне дефицита половых гормонов ведут к развитию постменопаузального остеопороза.
Коварство ОП состоит в том, что на ранних стадиях заболевание протекает бессимптомно. До недавнего времени единственным методом, способным оценить качество кости, было рентгенологическое исследование. Однако это малоинформативный метод, так как рентгенологически диагноз ОП можно установить лишь при потере более 25–30 % костной массы или в том случае, если пациент перенес несколько переломов.
За последние несколько десятилетий было разработано много методов, позволяющих с высокой степенью точности измерять костную массу количественно в различных участках скелета (фотонная или рентгеновская денситометрия, компьютерная томография, абсорбциометрия). Полезную информацию об обмене костной ткани позволяют получить некоторые инвазивные методы. Гистоморфологический анализ гребня подвздошной кости дает возможность оценить скорость образования костной ткани на клеточном и тканевом уровне, однако информации о величине костной резорбции недостаточно. Кроме того, исследование обмена костной ткани ограничивается небольшой областью губчатого вещества и внутренней поверхностью кортикального слоя, что не всегда отражает происходящее в других отделах скелета. Хотя рентгеновская денситометрия на сегодняшний день является золотым стандартом диагностики остеопороза, она имеет некоторые недостатки: не позволяет прогнозировать уровень потери костной массы, оценка изменения плотности костной ткани возможна только через 1,5–2 года после назначения терапии, отсутствует возможность быстрой коррекции терапии остеопороза. В настоящее время остеопороз может быть диагностирован на ранних стадиях его развития, так как современные методы обследования позволяют выявить наличие не только остеопороза, но и остеопении, т.е. начальных проявлений патологического процесса, что позволяет оценить риск переломов задолго до их возможного возникновения и предупредить это тяжелое осложнение. Другим неинвазивным методом оценки костного метаболизма является определение биохимических маркеров, которые позволяют оценить скорость протекания процессов костного ремоделирования уже через 3–4 мес. от начала терапии [1, 19].
Скорость образования или разрушения матрикса костной ткани может оцениваться либо при измерении активности специфических ферментов костеобразующих или костеразрушающих клеток, либо путем определения компонентов, поступающих в кровоток во время синтеза или резорбции кости. Хотя эти показатели делятся на маркеры синтеза и резорбции кости, следует учитывать, что в патологических условиях, когда процессы перестройки костной ткани сопряжены и изменены в одном направлении, любой из указанных маркеров будет отражать суммарную скорость метаболизма кости. Биохимические маркеры невозможно разделить в зависимости от изменений обмена в разных отделах костей, т.е. в губчатом или компактном веществе. Они отражают итоговые изменения резорбции и костеобразования, направленные в ту или иную сторону.
Маркеры формирования костной ткани
Остеокальцин — основной неколлагеновый белок костного матрикса, который синтезируется остеобластами. Синтез остеокальцина зависит от витамина К и D, что до некоторой степени снижает чувствительность и специфичность определения остеокальцина как маркера метаболизма костной ткани. Но именно его концентрация в крови отражает метаболическую активность остеобластов костной ткани, поскольку остеокальцин крови — результат нового синтеза, а не высвобождения его при резорбции кости. Он синтезируется остеобластами во внеклеточное пространство кости, часть попадает в кровоток, где он и может быть определен. Высокий уровень паратгормона подавляет выработку белка остеобластами, в результате чего снижается его концентрация в костной ткани и в крови. По мнению многих авторов, этот показатель — возможный прогностический индикатор усиления заболевания костей.
Кальцитонин — полипептидный гормон, выделяемый С-клетками щитовидной железы. Основной эффект кальцитонина — снижение уровня кальция в крови и отложение в кости. По своему действию является антагонистом паратгормона. Кальцитонин действует через специфические рецепторы (в костях, почках), в результате чего тормозится резорбция костей и выход кальция из кости.
Костный фермент щелочной фосфатазы (bALP). Его исследование, наряду с общей активностью щелочной фосфатазы, существенно повышает информативность при дифференциальной диагностике заболеваний скелета и печени. Щелочная фосфатаза костного происхождения содержится в мембране остеобластов. В качестве показателя ремоделирования чаще всего используется общая активность щелочной фосфатазы в сыворотке, но он характеризуется низкой чувствительностью и специфичностью, так как причины существенного повышения сывороточного уровня щелочной фосфатазы могут быть различными. Например, у пожилых пациентов это может быть следствием дефекта минерализации костной ткани или влиянием одного из многих лекарственных препаратов, которым свойственно повышать активность печеночного изофермента.
Маркеры состояния обмена
Паратгормон является одним из основных регуляторов кальциево-фосфорного обмена, синтезируется паращитовидными железами в ответ на уменьшение внеклеточной концентрации кальция. Он активирует резорбцию костной ткани и приводит к поступлению кальция и фосфора в кровь.
Тиреотропный гормон, наоборот, способствует усвоению кальция и препятствует его выводу из костной ткани. Между тем уровень кальция в крови должен быть постоянным, если его мало, то риск развития сердечной патологии высок и регуляторная система нашего организма идет на все, чтобы содержание кальция в крови было нормальным, забирая его у скелета, мышц.
Кальций, фосфор — основные минеральные компоненты костной ткани. Разные формы и стадии остеопороза могут проявляться различными сдвигами в концентрациях этих минералов.
Витамин D общий. Другой аспект проблемы нарушения кальциевого гомеостаза — дефицит витамина D. Хорошо известно, что с возрастом наблюдается прогрессирующее снижение кишечной абсорбции не только кальция, но и витамина D, а также уменьшение образования витамина D в коже. В 2006 году группа экспертов Американского национального фонда по изучению остеопороза показала, что лечение препаратами кальция и витамина D экономически эффективно и выгодно в целях профилактики остеопороза.
Маркеры резорбции костной ткани
Для оценки эффективности лечения остеопороза используют, как правило, маркеры резорбции, поскольку их снижение под влиянием терапии начинается уже через 2–3 недели и достигает плато через 3–6 месяцев. Выявление нормального или значительно повышенного уровня маркера резорбции при однократном определении уже имеет диагностическое значение. Увеличение маркеров резорбции опережает увеличение маркеров образования на несколько месяцев.
Деоксипиридинолин (ДПИД). На сегодняшний день ДПИД считают самым адекватным маркером резорбции кости. Костный коллаген характеризуется наличием поперечных связей между отдельными молекулами коллагена, которые играют большую роль в его стабилизации и представлены в виде деоксипиридинолина. Выход ДПИД в сосудистое русло из кости происходит в результате его разрушения остеокластами. ДПИД не подвергается дальнейшим метаболическим превращениям и выводится с мочой в неизмененном виде. Его экскреция повышается при многих видах остеопороза.
Beta–Cross Laps (С-концевые телопептиды альфа-цепи коллагена 1-го типа) образуются при деградации коллагена 1-го типа, который составляет более 90 % органического матрикса кости. Измерение beta-Cross Laps позволяет оценить темпы деградации относительно старой костной ткани. В норме малые фрагменты коллагена, образующиеся при его деградации, поступают в кровь и выводятся почками с мочой. У пациентов со сниженной функцией почек содержание beta-Cross Laps в сыворотке крови возрастает вследствие снижения экскреции. При патологическом увеличении резорбции костной ткани (пожилой возраст, остеопороз) коллаген 1-го типа деградирует в большом объеме, что приводит к повышению уровня фрагментов коллагена в крови. Таким образом, определение уровня биохимических маркеров резорбции и ремоделирования кости позволяет: при профилактическом обследовании выявить пациентов с метаболическими нарушениями процессов ремоделирования и резорбции костной ткани; оценить и прогнозировать уровень потери костной массы; оценить эффективность проводимой терапии уже через 2–3 месяца [20, 21].
Прогностическая значимость определения маркеров
Высокие уровни маркеров резорбции костей, превышающие норму в 2 раза, связывают с двукратным увеличением риска переломов; пациенты с остеопорозом, имеющие уровни маркеров резорбции костей, превышающие нормы в 3 и более раза, имеют, как правило, другую метаболическую костную патологию (включая злокачественную). Таким образом, показаниями к исследованию маркеров метаболизма костной ткани являются: определение риска развития остеопороза; мониторинг в период мено- и постменопаузы; мониторинг при проведении гормональной заместительной терапии; оценка эффективности терапии антирезорбционными препаратами.
Маркеры костного ремоделирования, особенно маркеры резорбции, позволяют выявить пациентов со значительно увеличенным костным ремоделированием при нормальной минеральной плотности кости. В дальнейшем у таких пациентов происходит потеря кости. Поэтому желательно провести лечебно-профилактические мероприятия еще до снижения костной массы [1–4, 17].
Таким образом, своевременная комплексная диагностика функционального состояния костной ткани позволит адекватно выявить нарушения и правильно назначить терапию, направленную на снижение резорбции или повышение костеобразования.
Согласно клиническим рекомендациям по профилактике и ведению больных с остеопорозом Российской ассоциации по остеопорозу (2012), диагноз постменопаузального остеопороза устанавливается:
— клинически на основании перенесенного при минимальной травме или спонтанного перелома (кроме переломов пальцев или черепа, нехарактерных для остеопороза) при исключении других причин перелома;
— при измерении МПКТ методом двухэнергетической рентгеновской абсорбциометрии (DXA). Постменопаузальный остеопороз диагностируется при Т-критерии –2,5 и ниже [5].
Менопаузальная потеря костной массы может варьировать от 1 до 5 % в год. Женщины с высокой скоростью потери костной массы (3–5 %) имеют более высокий риск переломов (около 35 % от всех женщин в период менопаузы) и нуждаются в раннем начале лечения.
В последние годы спектр медикаментов для лечения остеопороза значительно расширился благодаря появлению новых высокоэффективных препаратов. Бисфосфонаты и стронция ранелат применяются на сегодняшний день чаще других и рассматриваются в качестве первой линии терапии остеопороза [5, 16].
Бисфосфонаты являются стабильными аналогами естественно образующихся пирофосфатов. Они встраиваются в костный матрикс, надолго там сохраняются и подавляют костную резорбцию за счет снижения активности остеокластов. В настоящее время в клинической практике используется несколько бисфосфонатов (алендронат, ризедронат, ибандронат, золедроновая кислота) с различными путями и режимами введения. Пероральные бисфосфонаты имеют низкую биодоступность, а также обладают рядом побочных действий, в частности могут вызывать воспалительные поражения и эрозии нижнего отдела пищевода. Для профилактики этого побочного эффекта и повышения биодоступности таблетку бисфосфоната необходимо принимать утром натощак, запив 1–1,5 стакана воды, после чего в течение 40–60 минут не принимать горизонтальное положение и не есть. Такая особенность в случае ежедневного или еженедельного приема приводила к низкой приверженности пациентов к соблюдению рекомендаций. Известно, что через год продолжают лечение только 30 % тех больных, кто принимает бисфосфонаты ежедневно, и около 45 % тех, кто принимает их раз в неделю [23].
В последнее время появились новые бисфосфонаты, показавшие высокую эффективность и хорошую переносимость при более редком приеме, что повышает комплайентность и приверженность пациентов к лечению. Это ибандронат, который принимается внутрь в виде таблетки 150 мг 1 раз в месяц или внутривенно в дозе 3 мг 1 раз в 3 мес., показан при постменопаузальном остеопорозе; и золедроновая кислота, которая назначается 1 раз в год (5 мг).
Среди препаратов, подавляющих костную резорбцию, бисфосфонаты наиболее широко применяются в терапии остеопороза и другой патологии костей [4, 22, 23]. Это класс лекарственных препаратов, созданных на основе неорганических пирофосфатов, синтетические производные фосфоновых кислот, которые отличаются по своей химической структуре заменой атома кислорода в молекуле пирофосфата на атом углерода — Р–С–Р. Кроме того, в структуре боковых цепей бисфосфонатов имеются два радикала, один из которых облегчает физико-химическое связывание бисфосфонатов с гидроксиапатитом, а другой — определяет биологическое действие препаратов на костные клетки. Селективное действие бисфосфонатов на костную ткань связано с их высоким сродством c кристаллами гидроксиапатита кости. Это свойство определяет их способность откладываться в местах образования новой кости. Бисфосфонаты сохраняются в местах нового костеобразования до тех пор, пока не произойдет замена старой кости на новую. Основным фармакологическим эффектом бисфосфонатов является снижение костного ремоделирования с более выраженным угнетением костной резорбции, чем костеобразования, а также снижение частоты активации ремоделирования. Препараты уменьшают или предупреждают отрицательное влияние на кость практически всех известных стимуляторов резорбции. Проникая в костную ткань, бисфосфонаты концентрируются вокруг остеокластов, создавая высокую концентрацию в лакунах резорбции. В исследованиях in vitro было показано, что бисфосфонаты влияют на глубину лакун резорбции, уменьшая ее [24].
Антирезорбционная активность отдельных препаратов из этой группы существенно варьирует, что связано с особенностями химической структуры.
Ниже перечислим бисфосфонаты в зависимости от их активности (по отношению к этидроновой кислоте):
— этидроновая кислота (ксидифон, дидронель) — 1;
— клодроновая кислота (бонефос, лодронат, остак), тилудроновая кислота (скелид) — 10;
— памидроновая кислота (аредиа, аминомакс) — 100;
— алендроновая кислота (фосамакс, остеотаб) — 1000;
— ризедроновая кислота (актонель), ибандроновая кислота (Бонвива), золедроновая кислота (зомета, акласта) — 10 000 [22].
Первое поколение бисфосфонатов — этидронат, клодронат динатрий и тилудронат не содержат в своей структуре атомов азота, метаболизируются остеокластами внутриклеточно до цитотоксичных аналогов аденозинтрифосфата.
Азотсодержащие бисфосфонаты блокируют синтез фарнезилдифосфатсинтазы и снижают образование мевалоната, который необходим для поддержания нормальной цитоархитектоники и жизнедеятельности остеокластов [21, 22]. Последние являются более сильными ингибиторами остеокластической активности и остеолизиса, чем препараты, не содержащие в своей структуре азота [24]. Структурные отличия в азотсодержащей цепочке бисфосфонатов также влияют на их эффективность в отношении ингибирования костной резорбции.
Бисфосфонаты захватываются остеокластами, где они нарушают формирование цитоскелета, необходимого для прикрепления остеокласта к костной ткани, а также снижают секрецию лизосомальных ферментов. Клеточный механизм действия бисфосфонатов заключается в прямом ингибировании активности остеокластов, их подвижности, а также блокировании связывания остеокластов с костной тканью [25]. Присутствие атома азота в боковой цепи объясняет особый механизм действия азотсодержащих бисфосфонатов, связанный со способностью ингибировать процесс модификации белков в остеокластах, что ведет к апоптозу зрелых клеток и подтверждается появлением специфических изменений в клетке и структуре ядра [26]. Действие азотсодержащих бисфосфонатов, кроме того, ведет к потере клетками–предшественниками остеокластов способности дифференцировки и созревания, что в дальнейшем влечет за собой уменьшение популяции остеокластов. Однако точный молекулярный механизм действия бисфосфонатов до сих пор не выяснен.
Наряду с антирезорбционными эффектами бисфосфонаты обладают тормозящим влиянием на процессы минерализации тканей скелета и мягких тканей [24]. Остеобласты также являются потенциальными мишенями для бисфосфонатов, поскольку влияют на функциональную активность остеокластов. Данные in vitro свидетельствуют о том, что под влиянием бисфосфонатов остеобласты снижают секрецию остеокластстимулирующего фактора [22–24].
Помимо антирезорбционного действия, бисфосфонаты обладают рядом анаболических эффектов, поскольку блокируют апоптоз остеобластов и остеоцитов и стимулируют образование новой кости [26]. Важно отметить положительное влияние бисфосфонатов на механическую прочность кости. Длительное применение бисфосфонатов сопровождается положительными изменениями микроархитектоники кости, увеличением толщины трабекул. Так, гистоморфометрическое исследование костных биоптатов показало, что микроархитектоника кости у женщин, получавших лечение бисфосфонатами в течение 5–10 лет, соответствует микроархитектонике пременопаузальных женщин [24]. Всасывание препаратов происходит частично в желудке, и в основном — в тонком кишечнике. При пероральном приеме бисфосфонатов всасывается 1–10 % препарата, однако от 20 до 50 % всосавшегося препарата депонируется в костях. Процесс всасывания снижается при их приеме одновременно с пищей, а также в присутствии солей кальция и железа. Также абсорбционный процесс уменьшают средства антацидного ряда. В костной ткани они сохраняются в течение очень длительного времени, практически всю оставшуюся часть жизни индивидуума. Бисфосфонаты не метаболизируются в организме и выводятся с мочой в неизмененном виде [27].
Одним из условий эффективного лечения остеопороза бисфосфонатами при наличии у больного гипокальциемии является обязательная ее коррекция до начала терапии. Длительная терапия бисфосфонатами эффективна при дополнительном приеме солей кальция (1–1,5 г/сут) и 500 МЕ витамина D [6, 8, 17]. Интервал между приемом бисфосфонатов и других лекарственных препаратов должен составлять как минимум 1 ч.
Терапия остеопороза, являющегося тяжелым хроническим заболеванием, должна проводиться в течение длительного времени. В связи с этим нередко на практике возникает проблема приверженности больных к лечению, тесным образом связанная с эффективностью терапии. Широкие клинические перспективы имеет бисфосфонат нового поколения Бонвива (ибандроновая кислота), основное преимущество которого состоит не только в большей антирезорбтивной активности, но и в возможности применения 1 таблетки 1 раз в месяц при терапии больных остеопорозом. Так, при изучении возможности ибандроновой кислоты вызывать угнетение костной резорбции на модели ретиноидиндуцированной костной резорбции было показано ее значительное преимущество перед памидроновой и алендроновой кислотами [24].
Бонвива (ибандроновая кислота) относится к азотсодержащим бисфосфонатам третьего поколения и используется в терапии остеопороза перорально по 150 мг 1 раз в месяц. После всасывания Бонвива быстро распределяется, и 40–50 % дозы препарата, находящегося в системной циркуляции, связывается с костной тканью и накапливается в ней, что соответствует концепции о высоком сродстве препарата с гидроксиапатитом кости. После связывания с минералами кости высвобождение препарата осуществляется чрезвычайно медленно. Биодоступность не снижается, если принимать пищу не ранее чем через 1 ч после приема препарата. Как и другие бисфосфонаты, Бонвива не метаболизируется в организме и в неизмененном виде экскретируется с мочой. Клиренс ибандроновой кислоты зависит от функции почек. Часть препарата, связавшаяся с костной тканью, не элиминируется из организма до тех пор, пока в этом участке кости не завершится процесс костного ремоделирования. Согласно данным экспериментальных исследований, период полувыведения Бонвивы из костей составляет около 1 года.
Клиническая эффективность Бонвивы была подтверждена данными ряда многоцентровых исследований по изучению влияния различных доз ибандроновой кислоты на минеральную плотность кости и качество кости, риск развития новых переломов и переносимость препарата [21–24, 28]. Результаты исследования MOBILE (многоцентровое, рандомизированное, двойное слепое) показали, что при частоте введения ибандроновой кислоты 1 раз в месяц у женщин с постменопаузальным остеопорозом минерализация костной ткани поясничного отдела позвоночника повышается столь же эффективно, как и при ежедневном приеме 2,5 мг. В исследование были включены 1609 женщин (возраст 55–80 лет) с продолжительностью постменопаузы 5 лет и более, имевших диагностированный остеопороз в поясничном отделе позвоночника (Т–критерий МПКТ от –2,5 CO и до –5,0 CO). Пациентам назначались несколько режимов приема Бонвивы или плацебо: 2,5 мг Бонвивы в сутки внутрь и плацебо 1 раз в месяц; 100 мг Бонвивы внутрь 1 раз в месяц и ежедневный прием плацебо; 100 мг Бонвивы внутрь 1 раз в месяц по 50 мг/сут 2 дня подряд (50/50 мг) и ежедневный прием плацебо; 150 мг Бонвивы внутрь 1 раз в месяц и ежедневный прием плацебо. Кроме того, все участники исследования ежедневно принимали препараты кальция (500 мг) и витамина D (400 МЕ). Первичной конечной точкой при оценке эффективности было изменение показателей МПКТ поясничных позвонков через 1 год лечения по сравнению с исходным уровнем. Вторичные конечные точки эффективности включали динамику МПКТ поясничных позвонков через 2 года, МПКТ проксимального отдела бедра через 1 и 2 года терапии, изменение уровня маркеров костного обмена (С–телопептида цепи коллагена I типа (СТх) сыворотки крови) через 1 и 2 года. Через 1 год было отмечено достоверное повышение МПКТ поясничного отдела позвоночника относительно исходных показателей на 4,3 % при приеме 50/50 мг Бонвивы, на 4,1 % — при приеме 100 мг, на 4,9 % — при ежемесячном приеме 150 мг и на 3,9 % — при ежедневном приеме 2,5 мг Бонвивы. Прирост МПКТ поясничных позвонков через 2 года исследования составил 5,3; 5,6 и 6,6 % при приеме соответственно 50/50, 100 и 150 мг Бонвивы и 5,0 % при ежедневном приеме препарата. Достоверное увеличение показателей МПКТ бедра в целом, шейки бедра и области большого вертела отмечалось во всех группах лечения через 1 год после проведения терапии и сохранялось в течение второго года лечения. По сравнению с ежедневным режимом приема препарата прием 150 мг Бонвивы 1 раз в месяц сопровождался самым большим и прогрессивным увеличением показателей МПКТ во всех точках обследования проксимальных отделов бедренной кости (p < 0,05 через 2 года). Изучение уровня маркеров костного обмена показало снижение их уже через 3 мес. лечения. Снижение продолжалось в течение всего периода наблюдения. Через 2 года понижение уровня CTх сыворотки крови составило 56,1–61,5 % в группах лечения с наибольшим снижением в группе, получавшей 150 мг ибандроновой кислоты [28].
В рамках исследования BONE проводились гистологические и гистоморфометрические анализы костных биоптатов в подгруппе пациенток, участвовавших в программе по оценке влияния интермиттирующего и ежедневного приема ибандроновой кислоты на качество и микроархитектонику костной ткани. Полученные результаты показали, что как интермиттирующий, так и ежедневный прием Бонвивы перорально ассоциировался с формированием новой кости без признаков нарушения минерализации костного матрикса, при этом отмечались признаки улучшения ее микроархитектоники [22].
Как было отмечено выше, эффективность терапии любого хронического заболевания тесно связана с приверженностью пациента к лечению. Результаты многоцентрового исследования BALTO, посвященного сравнительной оценке приверженности пациентов к лечению, показали, что 66,1 % женщин с постменопаузальным остеопорозом предпочитают ежемесячный прием 150 мг Бонвивы еженедельному приему 70 мг алендроновой кислоты [23].
Результаты приведенных и ряда других исследований также свидетельствовали о том, что относительно большая доза, которая была необходима для приема препарата в режиме 1 раз в месяц, не оказывала существенного влияния на переносимость Бонвивы. Кроме того, прием Бонвивы не ассоциировался с повышенным риском развития побочных эффектов со стороны верхних отделов желудочно–кишечного тракта [21, 22, 28].
Ежемесячное назначение ибандроната сопоставимо по эффективности с обычным режимом, способствуя более удобным лечению и профилактике постменопаузального остеопороза.
Продолжающаяся клиническая программа исследований для ибандроната оценивает интермиттирующие внутривенные режимы его дозировки. В 2012 году опубликованы данные исследования DIVALTE, которое является открытой фазой 2-летнего рандомизированного двойного слепого исследования III фазы. В него включались пациентки в постменопаузе, завершившие участие в исследовании DIVA, в котором проводилась сравнительная оценка эффективности ежедневного таблетированного и внутривенного ибандроната в дозе 2 и 3 мг (приверженность к лечению ибандронатом в дозе 3 мг 1 раз в 3 месяца, вводимым внутривенно, за первые два года составила 75 % и выше). Объединенный 5-летний анализ включал 497 пациенток. Анализ данных МПКТ позвоночника выявил продолжающееся увеличение показателей при использовании обеих доз ибандроната. К концу исследования было выявлено увеличение МПКТ данной локализации на 8,4 и 8,1 % в группах лечения внутривенным ибандронатом в дозе 2 и 3 мг соответственно. Увеличение общего показателя МПКТ в бедренной кости составило 3,0 и 2,8 % по сравнению с исходным уровнем исследования DIVA [22].
В заключение следует отметить, что препарат Бонвива является эффективным средством терапии остеопороза. Длительное его применение в комплексном лечении различных форм остеопороза приводит не только к прогрессивному увеличению МПКТ в поясничном отделе позвоночника и проксимальном отделе бедренной кости, но и снижает риск переломов позвонков [26].
Проведенное непрямое сравнение показало, что между ибандронатом (Бонвива), алендронатом и стронция ранелатом, применяемыми перорально в комбинации с препаратами кальция и витамина D в соответствии с инструкциями, нет значимых различий по степени снижения риска позвоночных переломов у женщин. Затраты на применение ибандроната (Бонвивы) для профилактики позвоночных переломов при постменопаузальном остеопорозе, рассчитанные на основе предельных отпускных цен производителей, ниже, чем алендроната и стронция ранелата, что в сочетании с равной эффективностью позволяет считать использование ибандроната более целесообразным, чем алендроната и стронция ранелата [25].
Таким образом, при менопаузальном остеопорозе назначение бисфосфонатов, в частности ибандроната, является патогенетически обусловленным, эффективным, экономически выгодным.
1. Остеопороз. Диагностика, профилактика и лечение. Клинические рекомендации Российской ассоциации по остеопорозу / Под ред. Л.И. Беневоленской и О.М. Лесняк. — М.: ГЭОТАР-Медиа, 2005. — 171 с.
2. Аmerican association of endocrinologists (AACE) medicalguidelines for the prevention and treatment of postmenopausalosteoporosis: 2001 edition, with selected updates for 2003 // Endocrine Practice. — 2003. — Vol. 9, № 6. — P. 544–564.
3. Шварц Г.Я. Остеопороз, падения и переломы в пожилом возрасте: роль D-эндокринной системы // РМЖ. — 2008. — Т. 17, № 10. — С. 660–669.
4. Лесняк О.М. Аудит состояния проблемы остеопороза в Российской Федерации // Профилактическая медицина. — 2011. — Т. 14, № 2. — С. 7–10.
5. Клинические рекомендации. Остеопороз. Диагностика, профилактика и лечение / Под ред. Л.И. Беневоленской и О.М. Лесняк. — 2-е изд., перераб. и доп. — М.: ГЭОТАР-Медиа, 2012.
6. Gennazzani A.R. Postmenopausal osteoporosis // Tailor and Fransis Group. — 2006. — Р. 141–270.
7. Михайлов Е.Е., Беневоленская Л.И. Руководство по остеопорозу. — М.: Бином, Лаборатория знаний, 2003. — С. 10–55.
8. Rees M., Mander T. Managing the menopause without oestrogen // Royal Society of medicine. — 2004. — P. 9–15.
9. Остеопороз: эпидемиология, клиника, диагностика, профилактика и лечение / Под ред. Н.А. Коржа, В.В. Поворознюка, Н.В. Дедух, И.А. Зупанца // Харьков: Золотые страницы. — 648 с.
10. Autier P., Gaudini S. Vitamin D supplementation andtotal mortality // Arch. Intern. Med. — 2007. — V. 167 (16). — P. 1730–1737.
11.Cao Y., Mori S., Mashiba T. et al. 1Alpha,25-dihydroxy-2beta(3–hydroxypropoxy) vitamin D3 (ED–71) suppressed callus remodeling but did not interfere with fracture healing in rat femora // Bone. — 2007. — V. 40 (1). — P. 132–139.
12. Nuti R., Bianchi G., Brandi M.L.et al. Superiority of alfacalcidol compared to vitamin D plus calcium in lumbar bone mineral density in postmenopausal osteoporosis // Rheumatol. Int. — 2006. — V. 26 (5). — P. 445–453.
13. Vervloet M.G., Twisk J.W.R. Mortality reduction byvitamin D receptor activation in end-stage renal disease: acommentary on the robustness of current data // Nephrol. Dial Transplant. — 2009. — V. 24. — P. 703–706.
14.Richy F., Schacht E., Bruyere O. et al. Vitamin D analogs versus native vitamin D in preventing bone loss and osteoporosis-related fractures: a comparative meta-analysis // Calcif. Tissue Int. — 2005. — V. 76 (3). — P. 176–186.
15. Поворознюк В.В., Григорьева Н.В. Менопауза та остеопороз. — К., 2002. — 356 с.
16. Лесняк О.М., Хосева Е.Н. Современные подходы к диагностике и назначению лечения при постменопаузальном остеопорозе // Эффективная фармакотерапия. Эндокринология. — 2013. — Спецвыпуск «Остеопороз», № 2. — С. 6–12.
17. Sturdee D.W. The facts of the hormone therapy for menopausal women // Parthenon Publishing. — 2004. — P. 73–96.
18. Метаболические болезни костей: Пер. О. Хабиб // Consilium medicum. — 2000. — Т. 2, № 6.
19. Brown J.P., Josse R.G. Clinical practice guidelines forthe diagnosis and management of osteoporosis in Canada II // CMAJ. — 2002. — V. 167 (10 suppl.). — P. S1–S34.
20. Bonnick S.L., Shulman L. Monitoring osteoporosis therapy: bone mineral density, bone turnover markers, or both? // Am. J. Med. Review. — 2006. — Vol. 4, № 119, Suppl. 1. — S25–31.
21. Delmas P.D., Eastell R., Garnero P. et al. [Scientific Advisors of the International OsteoporosisFoundation]. The use of biochemical markers of bone turnover in osteoporosis. Committeeof Scientific Advisors of the International Osteoporosis Foundation // Osteoporosis Int. — 2000. — Vol. 11, Suppl. 6. — Р. S2–17.
22. Белая Ж.Е., Рожинская Л.Я. Бисфосфонаты: мифы и реальность // Эффективная фармакотерапия в эндокринологии. — 2010. — Спецвыпуск «Остеопороз». — С. 3–9.
23. Reginster J.-Y., Adami S., Lakatos P. et al. Efficacy and tolerability of once-monthly oralibandronate in postmenopausal osteoporosis: 2 year results from the MOBILE study // Ann. Rheum. Dis. — 2006. — V. 65. — P. 654–661.
24.Bianchi G.,Czerwinski E, Kenwrigt A et al. Long-term administration of quarterly IV ibandronate is effective and well tolerate in postmenopausal osteoporosis: 5 year data from the DIVA study long-term extension // Osteoporos Int. — 2012. — V. 23, № 6. — P. 1769–1778.
25. Cramer J., Amonkar M.M., Hebborn A. et al. Compliance and persistence with bisphosphonatedosing regiments among women with postmenopausal osteoporosis // Curr. Med. Res. Opin. — 2005. — Vol. 21. — P. 1453–1460.
26. Hawitt R.E., Lissina A. The bisphosphonate acute phase response: rapid and copiousproduction of proinflammatory cytokines by peripheral blood T–cells in response to aminobisphosphonatesis inhibited by statins // Clin. and Exp. Imm. — 2005. — Vol. 139. — P. 101.
27.Пядушкина Е.А., Герасимова К.В., Горяйнов С.В. и др. Сравнительный фармакоэкономический анализ препарата Бонвива (ибандронат) с целью профилактики переломов при постменопаузальном остеопорозе // Современная ревматология. — 2012. — № 4. — С. 1–8.
28. Новикова В.А., Пенжоян Г.А.,Федорович О.К. и др. Современный взгляд на риски остеопороза и возможности его профилактики и лечения у женщин в постменопаузе // Акушерство и гинекология. — 2013. — № 1. — С. 27–32.
29. Рекомендації з діагностики, профілактики та лікування системного остеопорозу у жінок в постменопаузальному періоді: методичні рекомендації / В.М. Коваленко, В.В.Поворознюк. — 2010. — 50 с.
30. Miller P.D., Recker R.R., Reginster J.A. et al. Efficacy of monthly oral ibandronate is sustained over 5 years: the MOBILE long-term extension study // Osteoporos. Int. — 2012. — V. 23, № 6. — P. 1747–1756.