Термин «спондилоартрит» (СпА) охватывает группу взаимосвязанных заболеваний, которые включают анкилозирующий спондилит (АС), псориатический артрит (ПсА), реактивный артрит, СпА, ассоциированный с воспалительным заболеванием кишечника, недифференцированный СпА и, как официально признано за последние 10 лет, нерентгенографический аксиальный СпА. Все эти перекрывающиеся заболевания в той или иной степени ассоциированы с молекулой MHC класса I HLA-B27 и имеют несколько типичных клинических признаков, таких как воспалительная боль в спине, периферический артрит, энтезит и дактилит, а также внесуставные проявления в виде увеита, псориаза и воспалительных заболеваний кишечника. В 2011 году Международное общество по оценке спондилоартрита (ASAS) представило концепцию СпА, разграничившую его на аксиальный СпА и периферический СпА [1]. Хотя классической разновидностью аксиального СпА остается АС, пациенты с ПсА также могут быть классифицированы как имеющие аксиальное заболевание исходя из их клинической картины.
АС был выделен как отдельное заболевание в XVII веке. Он характеризуется наличием сакроилеита на рентгенограмме, проявляющегося болью в спине, скованностью и/или ограниченным движением поясничного или грудного отдела позвоночника [2]. J.M. Wright и V. Moll [3] отметили поражение позвоночника как один из паттернов ПсА в своей оригинальной работе 1973 года. С тех пор было признано, что аксиальное заболевание может возникать как при АС, так и при ПсА. Однако до сих пор не прекращаются обсуждения того, как определить, чем именно страдает пациент. АС у пациента с псориазом является, по существу, аксиальным ПсА (аксПсА), или эти состояния являются двумя отдельными заболеваниями с перекрывающимися признаками. Примечательно, что, хотя воспалительное аксиальное поражение при ПсА может быть неотличимо от АС, оно отличается в некоторых аспектах. В этом обзоре мы выделили сходства и различия между клинической картиной, генетическими факторами, рентгенологическими характеристиками, вариантами лечения и прогнозом как АС, так и аксПсА.
Что такое аксиальный псориатический артрит?
ПсА представляет собой хроническое воспалительное заболевание опорно-двигательного аппарата с пятью доменами: периферический артрит, аксиальное заболевание, поражение кожи и ногтей, дактилит и энтезит [4]. Только у 2–5 % пациентов с ПсА присутствует изолированное аксиальное поражение, в то время как периферический артрит развивается у большинства пациентов с аксПсА [5]. С другой стороны, псориаз встречается примерно у 10 % пациентов с АС [2].
Распространенность аксиального поражения у пациентов с ПсА варьирует в зависимости от продолжительности заболевания, встречаясь у 25–70 % лиц с давним ПсА и у 5–28 % лиц с ранней стадией заболевания [5]. Эти различия позволяют предположить, что аксиальное заболевание обычно развивается на поздней стадии. Результаты исследования V. Chandran и соавт. (2010) [6] показали, что у 15 % пациентов с ПсА, у которых не имелось вовлечения сакроилеальных сочленений и позвоночника на момент начала заболевания, аксПсА развился в течение 10 лет наблюдения. Факторами риска, ассоциированными с повышенной частотой развития осевого заболевания на ранней стадии ПсА, является позитивность по HLA-B*27, наличие радиографического повреждения периферических суставов и увеличение скорости оседания эритроцитов (СОЭ), в то время как наследственный анамнез, отягощенный по ПсА, снижал вероятность развития аксиального заболевания на ранней стадии [6]. Напротив, факторы риска на момент манифестации заболевания, которые связаны с развитием аксПсА на поздней стадии развития болезни, включали дистрофию ногтей, большое количество рентгенологически поврежденных суставов, наличие периостита и увеличение СОЭ, тогда как большое количество опухших суставов было связано с уменьшением риска развития осевого заболевания с течением времени [6]. Недавнее перекрестное исследование из реестра CORRONA показало, что пациенты с аксПсА были моложе и многочисленнее, чем пациенты без осевого вовлечения, имели энтезит, депрессию в анамнезе и чаще использовали биологические болезньмодифицирующие антиревматические препараты (БМАРП) при регистрации в реестре. Кроме того, у них чаще наблюдались более тяжелый псориаз и заболевание ногтей, более высокая активность заболевания, более выраженный энтезит, более высокий индекс активности анкилозирующего спондилита (BASDAI), функциональный индекс анкилозирующего спондилита (BASFI), они хуже оценивали свое состояние здоровья по шкале HAQ и имели более высокие уровни С-реактивного белка [7].
Определение аксиального заболевания при ПсА имеет решающее значение при попытке сравнить аксПсА с АС. Для постановки диагноза АС необходимо наличие боли в спине воспалительного типа и/или существенного нарушения подвижности позвоночника в дополнение к классическим рентгенографическим критериям [8]. В отличие от этого многие пациенты с аксПсА имеют рентгенологическое, но бессимптомное аксиальное заболевание, и у них диагностируется осевое поражение только потому, что они являются симптоматическими в другом домене [9]. Важным недостатком исследований является отсутствие единого определения осевого заболевания при аксПсА. Хотя в ранних исследованиях для диагностики аксиального поражения учитывалось лишь минимальное рентгенологическое доказательство аксиального поражения, такое как односторонний сакроилеит 2-й стадии [10], в более поздних исследованиях подчеркивается, что для постановки диагноза аксПсА пациенты должны соответствовать модифицированным Нью-Йоркским критериям (мНЙк) АС, которые включают клинический критерий и такие рентгенографические признаки, как двусторонний сакроилеит 2-й стадии или односторонний сакроилеит 3-й или 4-й стадии, для диагностики осевого заболевания [6]. Однако, поскольку только 45 % пациентов с аксПсА имели рентгенографические мНЙк АС [10], D.R Jadon и соавт. (2017) подчеркнули необходимость использования наличия синдесмофитов для диагностики аксПсА [5]. Будущие исследования в больших когортах пациентов с ПсА, которые рассматривают как поражение крестцово-подвздошных суставов, так и вовлечение позвоночника, позволят лучше определить осевое вовлечение при ПсА.
Генетика аксиального заболевания
Анкилозирующий спондилоартрит
АС поражает 0,03–1,4 % населения и в 2–3 раза чаще встречается у мужчин, чем у женщин [11]. Считается, что АС имеет наследственную предрасположенность, риск которой составляет 24,4 % [11]. Около 20 % ассоциировано с HLA-B*27, а 4,3 % — с другими генетическими локусами [11]. Более 80 % пациентов с АС имеют аллель HLA-B*27, но только у меньшинства (1–5 %) лиц, положительных по HLA-B27, в конечном итоге разовьется АС [12].
Было идентифицировано более 140 вариантов аллелей или подтипов HLA-B*27, включая HLA-B*27:02 (встречается в основном в средиземноморских популяциях), HLA-B*27:04 (встречается в восточноазиатских популяциях), HLA-B*27:05 (встречается по всему миру) и HLA-B*27:07 (встречается главным образом в популяциях Южной Азии и Ближнего Востока) [2]. HLA-B27-позитивный статус пациентов с АС с сопутствующим псориазом был зарегистрирован в двух небольших европейских когортах. В группе «Результаты международного исследования по анкилозирующему спондилиту» (OASIS) [13] 44 % пациентов были HLA-B27-положительными, тогда как в исследовании анкилозирующего спондилита для оценки группы рекомбинантной терапии инфликсимабом (ASSERT) такая частота составила 80 % [14].
Другие локусы HLA, такие как HLAB*13:02, HLA-B*40:01, HLA-B*40:02, HLA-B*47:01 и HLA-B*51:01, также ассоциированы с АС [15]. Напротив, HLA-B*07:02 и HLA-B* 57:01 ассоциированы с псориазом и связаны со сниженным риском развития АС [15]. Некоторые из этих генов кодируют белки, которые участвуют в активации сигнальных путей IL-23 — IL-17 [2]. Кроме того, АС генетически связан с тремя аминопептидазами: аминопептидазой 1 и 2 эндоплазматического ретикулума (ERAP1, ERAP2) и чувствительной к пуромицину аминопептидазой PSA, которая кодируется NPEPPS [15]. Эти белки участвуют в обрезании пептидов перед презентацией молекулами МНС класса I. Помимо АС, ERAP1 ассоциирована с псориазом, ювенильным идиопатическим артритом и болезнью Бехчета, а ERAP2 — с псориазом, болезнью Крона и аутоиммунным увеитом [15]. Механизмы влияния этих трех аминопептидаз на риск возникновения АС неясны, однако их связь с АС поддерживает гипотезу о том, что процессинг и презентация пептидов являются кардинальными в патогенезе АС [2].
Псориатический артрит
Распространенность псориаза, ключевого признака ПсА, по оценкам, составляет 0,2–6,5 % среди населения всего мира, и приблизительно у 30 % пациентов с псориазом развивается ПсА [16]. Как псориаз, так и ПсА имеют высокий риск наследуемости с частотой возникновения псориаза 50–90 % и 80–100 % для ПсА у родственников первой степени [17]. Аллель HLA-C*06:02 ассоциирована с самым высоким генетическим риском развития псориаза, тогда как некоторые аллели HLA-B считаются ПсА-специфичными генами [18]. Существуют ассоциации между ПсА и аллелями HLA-B*27 и гаплотипами HLAC*12-HLA-B*38 и HLA-C*06-HLA-B*57 [19]. В исследовании L. Eder и соавт. (2012) [20] сообщалось о генетических различиях между пациентами с псориазом, у которых не было артрита, и пациентами с различными фенотипами ПсА. Было показано увеличение распространенности позитивности HLA-B*39 у пациентов с аксиальным, а не периферическим ПсА. HLA-B*27, HLA-B*08 и HLA-B*38 также были специфически связаны с аксиальным поражением у пациентов с ПсА [18], а HLACw*07:02 был связан с аксПсА в испанской когорте [21]. HLA-B*27, основной генетический вариант, связанный со СпА, также ассоциирован с ПсА, но не с псориазом. Однако распространенность HLA-B*27 у пациентов с ПсА намного ниже (20 %), чем у пациентов с АС (80 %) [18].
В дополнение к указанию на потенциальное осевое поражение HLA-B*27 также ассоциируется с тяжелым фенотипом ПсА, который проявляется в виде раннего артрита с тяжелым периферическим поражением [18]. Известно, что симметричный сакроилеит связан с аллелью HLA-B*27:05:02, тогда как асимметричное поражение крестцово-подвздошных сочленений связано с гаплотипом HLA-B*08:01-HLA-C*07:01 [22].
За прошедшее десятилетие результаты общегеномных ассоциативных исследований [23] выявили многочисленные новые локусы предрасположенности к развитию псориаза, которые не являются частью MHC. Были выявлены гены восприимчивости к ПсА, некоторые из которых (такие как TRAF3IP2, TNIP1, REL, IFNLR1, IFIH1 и NFKBIA) также ассоциированы с псориазом [24]. ERAP1, в дополнение к ассоциации с АС, также связан с псориазом, но не с ПсА [18]. Полиморфизм IL-13 также специфически ассоциирован с ПсА, а не с псориазом [18], но, опять же, связь с аксиальным заболеванием еще не изучена. В целом основной областью генетического перекрытия между АС и аксПсА является HLA-B*27, но до сих пор была обнаружена лишь небольшая часть наследственной предрасположенности к этим заболеваниям.
Проявления осевого заболевания
Основным проявлением СпА является воспалительная боль в спине. Симптомы воспалительной боли в спине, характерные для аксПсА и АС, включают боль в нижней части спины, бедрах или ягодицах, которая уменьшается при физической активности и возрастает во время отдыха, возникает ночью, ослабевает на фоне приема НПВП; также характерна утренняя скованность продолжительностью более 30 минут [2]. Наличие боли в спине имеет важное значение для диагностики АС, тогда как только у 45 % пациентов с рентгенологически определенным аксПсА имеется воспалительная боль в спине [16].
Интересно, что аксПсА, который развивается у пациентов с длительным анамнезом ПсА или началом в более старшем возрасте, с большой вероятностью будет протекать бессимптомно, в отличие от АС [5]. Возникает вопрос: возможно ли, что пациенты с аксПсА, диагностированным исключительно на основании минимальных рентгенологических признаков (таких как односторонний сакроилеит 2-й стадии), на самом деле страдают дегенеративным заболеванием крестцово-подвздошных суставов, а не истинным воспалительным заболеванием? Для полного изучения этого вопроса необходимы длительные исследования когорт пациентов с ПсА.
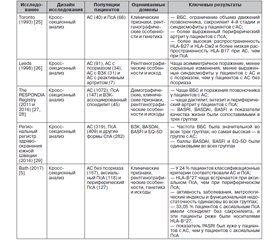
Прямое сравнение клинической картины АС и аксСпА было выполнено в нескольких исследованиях (табл. 1). Пациенты с АС, как правило, были мужчинами более молодого возраста и имели значительно более выраженную боль в спине и ограничения подвижности позвоночника, чем пациенты с аксПсА [5], однако при обоих заболеваниях были обнаружены одинаковые уровни самооценки состояния здоровья, которая отражает боль, активность заболевания и качество жизни.
/69.jpg)
Результаты, касающиеся сравнения функциональных нарушений между пациентами с АС и пациентами с аксПсА, противоречивы. Интересно, что у мужчин больше структурных повреждений, чем у женщин, тогда как у женщин более высокая активность воспалительного процесса, чем у мужчин, как при АС, так и при аксПсА [28]. Результаты исследования D.R. Jadon и соавт. (2017) [5] выявили анамнез воспалительных болей в спине у 60,63 % пациентов с периферическим ПсА, у 74,58 % пациентов с аксПсА и у 99,36 % пациентов с АС, у которых не было псориаза. Примечательно, что результаты этого исследования отражают критерии отбора, используемые для разных групп пациентов; боль в спине была обязательным условием для пациентов с АС, но не для пациентов с аксПсА (которые могут быть бессимптомными при диагностике), что отражает плохую специфичность воспалительной боли в спине как маркера осевого воспаления при аксПсА.
Индексы для оценки аксиального поражения
На сегодняшний день не разработано ПсА-специ-фических показателей, при помощи которых возможно оценивать активность процесса и функциональные нарушения при аксиальном поражении. Поэтому используются индексы и шкалы, разработанные для АС, включая индекс активности АС (BASDAI), показатель активности АС (ASDAS) и индекс функциональных нарушений АС (BASFI). Результаты международного исследования спондилоартритов (INSPIRE) продемонстрировали, что индекс нарушения движений в позвоночнике (BASMI), клинические измерения, используемые для оценки подвижности позвоночника и бедер при АС, могут быть использованы у пациентов с ПсА, за исключением измерения экскурсии грудной клетки [30].
Показателем, при помощи которого лучше всего проводилась дифференциация между пациентами с ПсА с осевым вовлечением и без него, был BASFI с последующим проведением модифицированного теста Шобера, бокового сгибания в поясничной области, расстояния от пальцев до пола и BASDAI [30, 31]. Однако из-за влияния поражения периферических суставов на баллы по BASDAI этот показатель не очень хорошо коррелирует с индексами активности аксПсА для принятия решения о начале лечения, что ухудшает его валидность в качестве меры активности аксиального вовлечения при оценке ПсА [32]. Оценка при помощи короткой версии BASDAI, исключающей третий вопрос, который относится к периферическим проявлениям, улучшает значимость BASDAI для оценки аксПсА [33]. Недавнее продольное исследование показало, что при корректировке по возрасту, полу, наличию HLA-B*27 и лечению не было значимых различий в показателях активности (ASDAS) и в метрическом индексе АС (BASMI) с течением времени у пациентов с АС с псориазом или без него [34]. Влияние псориаза на проявление и исход АС нуждается в дальнейшей оценке.
Рентгенография
В результате медленного темпа рентгенографического прогрессирования, которое происходит при осевом поражении, было опубликовано мало исследований, касающихся рентгенографических характеристик аксПсА. Пожилой возраст большинства пациентов с аксПА также делает сложным дифференцирование признаков воспалительного осевого заболевания от особенностей дегенеративных изменений.
При оценке аксиального вовлечения необходимо учитывать два компонента: позвоночник и крестцово-подвздошные суставы. Сакроилеит, наблюдаемый при аксПсА, менее тяжелый и менее симметричный, чем у пациентов с АС [5]. Напротив, изменения в позвоночнике, ассоциированные с воспалительным заболеванием при аксПсА, кажутся схожими с изменениями, наблюдаемыми при АС на обычных рентгенограммах, однако у пациентов с аксПсА больше грубых немаргинальных синдесмофитов и меньше классических синдесмофитов, чем у лиц с АС [4].
Что касается симметричности рентгенографических поражений, то здесь данные противоречивы. Кроме того, у 70–75 % пациентов с ПсА наблюдаются рентгенологические изменения в шейном отделе позвоночника, характерные для воспалительного аксиального заболевания [35], которые похожи на изменения, типичные для АС, или ревматоидоподобные. Существует несколько возможных объяснений различий в рентгенографическом проявлении аксПсА и АС. Например, различия в цитокиновом профиле [36] и в демографических характеристиках пациентов с двумя заболеваниями. Но тот факт, что пациенты с аксПсА обычно старше, чем пациенты с АС, означает, что некоторые изменения, наблюдаемые у пациентов с аксПсА, могут быть дегенеративными, а дифференциация дегенеративных остеофитов от синдесмофитов, обусловленных спондилитом, может быть чрезвычайно сложной. Другое возможное объяснение состоит в том, что пациенты с ПсА имеют меньшее снижение подвижности позвоночника, чем пациенты с АС, потому что апофизарные суставы, которые важны для подвижности позвоночника, реже поражаются при аксПсА. Следовательно, повышенный механический стресс, возникающий в результате уменьшения подвижности позвоночника у пациентов с аксПсА, может также приводить к усилению активации механизмов воспаления и дополнительного формирования костной ткани. Эта характеристика более типична для аксПсА, чем для АС. Для оценки рентгенографического повреждения при СпА доступны четыре метода радиографической оценки: рентгенографический индекс АС (BASRI), оценка по шкале поражения позвоночника АС (SASSS) и модифицированный SASSS (mSASSS), которые оценивают позвоночник, но не крестцово-подвздошные суставы, и индекс рентгенографического поражения при псориатическом спондилите (PASRI), который был разработан специально для использования при аксПсА.
PASRI объединяет признаки ранее разработанных рентгенологических индексов АС (BASRI, SASSS и mSASSS) с добавлением баллов для фасеточных суставов шейного и поясничного отделов [37]. Индексы BASRI, SASSS и mSASSS высокоинформативны при АС [38], однако, возможно из-за различий в расположении повреждения между АС и аксПсА, было установлено, что PASRI превосходит другие показатели для оценки структурного повреждения при аксПсА [39]. Корреляция с антропометрическими результатами была достаточной как для PASRI, так и для BASRI у пациентов с аксПсА [39]. Надежность индекса PASRI составляла 0,88 по сравнению с 0,65 для mSASSS и 0,52 для BASRI, а достоверность составляла 0,92 для PASRI, 0,91 для mSASSS и 0,77 для BASRI [39]. Таким образом, PASRI представляет собой лучший доступный показатель для оценки рентгенографических повреждений при аксПсА.
Роль МРТ позвоночника
МРТ можно использовать в качестве диагностического инструмента для осевого вовлечения при СпА, включая ПсА. Этот метод исследования был включен в классификационные критерии ASAS 2009 года для аксиального СпА [40]. В настоящее время основным применением МРТ при ПсА является диагностика нерентгенографического активного аксиального воспаления, а также выявление других осевых патологий, которые могут объяснить боль в спине [41]. Тем не менее степень прогрессирования от нерентгенографического осевого заболевания к рентгенографическому еще предстоит оценить в большей когорте пациентов с аксПсА. Примечательно, что у пациентов с недавно возникшими воспалительными болями в спине наличие псориаза не было связано с различными данными МРТ-сканирования [42].
В целом изменения по данным МРТ у пациентов с аксПсА сходны с таковыми у пациентов с АС, хотя это изучалось в немногих исследованиях [43]. У пациентов с ПсА МРТ достаточно чувствительна, чтобы обнаружить наличие сакроилеита и спондилита (хотя у этих пациентов спондилит часто бывает асимметричным); например, в исследовании L. Williamson и соавт. (2004) большой группы пациентов с ПсА, посещающих ревматологов в поликлинике, сакроилеит присутствовал при МРТ-сканировании только в 38 % случаев [44]. Однако клинические признаки при ПсА слабо коррелировали с наличием сакроилеита при МРТ-сканировании [45]. Эта слабая корреляция была подтверждена в исследовании Н. Maldonado-Ficco и соавт. (2017), в котором оценивалось 135 МРТ 125 пациентов с ПсА [45]. Самым сильным клиническим предиктором диагностированного с помощью МРТ сакроилеита было ограничение движений в позвоночнике [45], тем не менее в редких случаях эрозивно-дисковертебральное поражение позвоночника (известное как повреждение Андерссона) может быть симптомом осевого воспаления [46]. Интересно отметить, что у пациентов с симптоматическим аксПсА степень осевого воспаления, наблюдаемая при МРТ-сканировании, ассоциирована с позитивностью по HLA-B*27, как и при АС [47].
Использование МРТ всего тела в настоящее время является областью интенсивных исследований. МРТ всего тела позволяет оценить локализацию и распространенность воспаления и структурных повреждений. Пациенты с ПсА или СпА имели значительно более высокие глобальные показатели отека костного мозга, чем здоровые люди, при оценке с помощью МРТ всего тела [48]. Эти результаты в определенной степени валидизируют данную технику и обнадеживают ее дальнейшее развитие для долгосрочного тестирования. Использование этой новой методики было бы интересным для оценки различия в местах воспаления у пациентов с аксПсА по сравнению с пациентами с АС.
Лечение осевого заболевания
Основной целью лечения осевого заболевания является уменьшение воспаления и предотвращение повреждений, что приводит к ослаблению симптомов, тем самым улучшая гибкость позвоночника, предотвращая функциональные ограничения, поддерживая способность пациентов работать и уменьшая связанные с заболеванием осложнения. Как для АС, так и для аксПсА краеугольными камнями лечения в настоящее время являются лечебная физкультура, нестероидные противовоспалительные препараты (НПВП) и ингибиторы фактора некроза опухоли (иФНО) [49, 50]. Локальные инъекции глюкокортикоидов можно использовать для купирования изолированного локального воспаления крестцово-подвздошных суставов, одного или двух периферических суставов или энтезисов, однако длительное применение системных глюкокортикоидов противопоказано при обоих заболеваниях. Секукинумаб, моноклональное антитело против IL-17A, эффективен для лечения осевого воспаления у пациентов с активным АС [50] и у пациентов с ПсА [49]. В настоящее время в ходе продолжающегося клинического испытания оценивается использование секукинумаба при аксПсА [51]. Моноклональное антитело устекинумаб, которое специфично для IL-12 и IL-23 и эффективно при ПсА и псориазе, не показало эффективности у пациентов с АС [52]. В настоящее время разрабатывается множество других агентов, нацеленных на путь IL-23 — IL-17.
Результаты DISCOVER-1 и DISCOVER-2 — двух испытаний фазы III, оценивающих ингибитор IL-23
гуселкумаб в качестве средства для лечения ПсА, свидетельствуют о том, что гуселкумаб эффективен при лечении ПсА и может быть дополнительным вариантом лечения для пациентов с этим заболеванием [53]. Однако исследования этого агента для пациентов именно с аксПсА не проводилось.
Хотя эффективность этих методов лечения была доказана для АС и периферического ПсА, существует мало доказательств их использования при аксПсА. Рекомендации по лечению аксПсА в основном были экстраполированы из руководств по лечению АС, потому что большинство клинических испытаний, проведенных для ПсА, до настоящего времени оценивали влияние этих методов лечения на все домены заболевания и не включали отдельную оценку аксиального вовлечения заболевания. Исключение составляют два клинических исследования [54, 55], которые показали, что иФНО были эффективны в отношении именно аксПсА. В последние несколько лет таргетные синтетические БМАРП, такие как апремиласт и тофацитиниб, были добавлены в арсенал лечения для ПсА. Также в настоящее время оценивается эффективность у пациентов с АС таргетных синтетических БМАРП, таких как ингибиторы фосфодиэстеразы (апремиласт) и ингибиторы янус-киназы (тофацитиниб). Апремиласт продемонстрировал многообещающие результаты в небольшом пилотном исследовании при АС [56], а для ПсА он показал значительную клиническую пользу и благоприятный профиль безопасности в течение 5 лет наблюдения [57]. Тофацитиниб также был эффективен для АС в небольшом исследовании II фазы, результаты которого были опубликованы в 2017 году [58]. Однако специфическое влияние этих методов лечения на аксПсА еще не изучено.
Прогноз аксиальных проявлений
Анкилозирующий спондилоартрит
Результаты исследования 1983 года среди мужчин — ветеранов армии США показали, что 47 из 51 пациента с АС (92 %) оставались функционально активными (функциональный класс I или II) после средней продолжительности заболевания 38 лет, несмотря на то, что болезнь прогрессировала, вызывая серьезное ограничение позвоночника, у 21 из 51 пациента (41 %) [59]. Выживаемость этих пациентов была аналогична выживаемости в общей популяции, и было ясно, что в течение первых 10 лет АС можно было наблюдать предсказуемую картину заболевания. Во время ранней стадии заболевания на подвижность позвоночника в первую очередь влияет воспаление, тогда как структурное повреждение влияет на подвижность позвоночника в более поздней стадии болезни [60]. Рентгенографический мониторинг прогрессирования структурного повреждения фокусируется на развитии поражений, таких как эрозии и синдесмофиты, в поясничном и шейном отделах позвоночника. Самыми сильными предикторами их развития являются высокий уровень маркеров воспаления на исходном уровне и курение в анамнезе [60]. Длительные исследования показывают значительную пользу иФНО в предотвращении структурного повреждения. Долгосрочная терапия иФНО снижает скорость развития новых очагов поражения, особенно когда лечение начинается рано и пациенты наблюдаются в течение длительного периода времени [61].
Аксиальный псориатический артрит
Вследствие большого разнообразия клинических проявлений ПсА прогноз аксПсА варьирует в зависимости от того, как определяется осевое вовлечение. Проспективное исследование пациентов с аксПсА [62] показало, что, хотя подвижность этих пациентов со временем ухудшалась, а рентгенографическая оценка показала ухудшение течения болезни, их заболевание оставалось клинически бессимптомным и признаки и симптомы значительно улучшались в результате терапевтических вмешательств. Необходимы более длительные исследования для определения прогноза аксиального поражения у пациентов с аксПсА.
Выводы
В настоящее время сравнение аксПсА и АС затруднено ввиду отсутствия достаточного количества высококачественных сравнительных исследований (табл. 1). В целом доступные исследования показали, что клинически, рентгенологически и прогностически аксиальное поражение у пациентов с АС хуже, чем у пациентов с аксПсА, тогда как аксПсА обычно ассоциировался с худшей степенью периферического заболевания. Тем не менее неясно, являются ли эти различия следствием различия в когортах пациентов, включенных в сравнительные анализы (пациенты с аксПсА, как правило, старше и имеют меньше симптомов, чем пациенты с АС), или подчеркивают истинные различия между заболеваниями.
Остается неясным вопрос определения аксПсА: следует ли определять аксПсА аналогично АС (требующему рентгенологического и клинического подтверждения заболевания) или его следует определять исключительно на основании рентгенологических признаков заболевания?
До настоящего времени генетические исследования показали некоторые сходства и различия между аксПсА и АС в основных локусах HLA. Однако эти результаты объясняют только часть генетической предрасположенности к данным заболеваниям. Будущие исследования генетического секвенирования должны прояснить, существуют ли другие генетические компоненты, не относящиеся к МНС, являющиеся общими для этих заболеваний. Разработка специфических индексов и биомаркеров для клинической оценки осевого заболевания при ПсА и отделение этого домена от других поможет точно определить влияние различных методов лечения на осевой компонент заболевания. Между тем экстраполяция рекомендаций по лечению осевого заболевания при ПсА на результаты исследований по АС неизбежна. Доступных данных недостаточно, чтобы определить, являются ли АС и аксПсА частью спектра одного и того же заболевания или представляют собой отдельные заболевания с перекрывающимися признаками.
К сожалению, все опубликованные сравнения аксПсА и АС были кросс-секционными по конструкции, охватывая пациентов на разных стадиях их заболевания, и использовали разные определения аксиального заболевания. Программа исследований должна включать широко согласованное определение аксПсА, а также более длительные исследования обоих заболеваний, чтобы полностью ответить на оставшиеся вопросы об аксПсА.
Конфликт интересов. Авторы заявляют об отсутствии какого-либо конфликта интересов и собственной финансовой заинтересованности при подготовке данной статьи.
Список литературы
1. Rudwaleit M., van der Heijde D., Landewé R. et al. The assessment of SpondyloArthritis International Society classification criteria for peripheral spondyloarthritis and for spondyloarthritis in general. Ann. Rheum. Dis. 2011. 70(1). 25-31. doi: 10.1136/ard.2010.133645.
2. Taurog J.D., Chhabra A., Colbert R.A. Ankylosing spondylitis and axial spondyloarthritis. N. Engl. J. Med. 2016. 374(26). 2563-74. doi: 10.1056/NEJMra1406182.
3. Moll J.M., Wright V. Psoriatic arthritis. Semin. Arthritis. Rheum. 1973. 3(1). 55-78. doi: 10.1016/0049-0172(73)90035-8
4. Ritchlin C.T., Kavanaugh A., Gladman D.D. et al. Treatment recommendations for psoriatic arthritis. Ann. Rheum. Dis. 2009. 68(9). 1387-94. doi: 10.1136/ard.2008.094946.
5. Jadon D.R., Sengupta R., Nightingale A. et al. Axial Disease in Psoriatic Arthritis study: defining the clinical and radiographic phenotype of psoriatic spondyloarthritis. Ann. Rheum. Dis. 2017. 76(4). 701-707. doi: 10.1136/annrheumdis-2016-209853.
6. Chandran V., Tolusso D.C., Cook R.J., Gladman D.D. Risk factors for axial inflammatory arthritis in patients with psoriatic arthritis. J. Rheumatol. 2010. 37(4). 809-15. doi: 10.3899/jrheum.091059.
7. Mease P.J., Palmer J.B., Liu M. et al. Influence of axial involvement on clinical characteristics of psoriatic arthritis: analysis from the Corrona Psoriatic Arthritis/Spondyloarthritis Registry. J. Rheumatol. 2018. 45(10). 1389-1396. doi: 10.3899/jrheum.171094.
8. Van der Linden S., Valkenburg H.A., Cats A. Evaluation of diagnostic criteria for ankylosing spondylitis. A proposal for modification of the New York criteria. Arthritis. Rheum. 1984. 27(4). 361-8. doi: 10.1002/art.1780270401.
9. Lubrano E., Parsons W.J., Marchesoni A. et al. The definition and measurement of axial psoriatic arthritis. J. Rheumatol. 2015. 93. 40-42. doi: https://doi.org/10.3899/jrheum.150634.
10. Hanly J.G., Russell M.L., Gladman D.D. Psoriatic spondyloarthropathy: a long term prospective study. Ann. Rheum. Dis. 1988. 47(5). 386-393. doi: 10.1136/ard.47.5.386.
11. O’Rielly D.D., Uddin M., Rahman P. Ankylosing spondylitis: beyond genome-wide association studies. Curr. Opin. Rheumatol. 2016. 28(4). 337-45. doi: 10.1097/BOR. 0000000000000297.
12. Uddin M., Codner D., Mahmud Hasan S. et al. Integrated Genomics Identifies Convergence of Ankylosing Spondylitis with Global Immune Mediated Disease Pathways. Sci. Rep. 2015. 5. 10314. https://doi.org/10.1038/srep10314
13. Essers I., Ramiro S., Stolwijk C. et al. Characteristics associated with the presence and development of extra-articular manifestations in ankylosing spondylitis: 12-year results from OASIS. Rheumatology. 2015. 54(4). 633-640. https://doi.org/10.1093/rheumatology/keu388
14. Machado P., Landewé R., Braun J. et al. Ankylosing spondylitis patients with and without psoriasis do not differ in disease phenotype. Ann. Rheum. Dis. 2013. 72(6). 1104-7. doi: 10.1136/annrheumdis-2012-202922.
15. Brown M.A., Kenna T., Wordsworth B.P. Genetics of ankylosing spondylitis — insights into pathogenesis. Nat. Rev. Rheumatol. 2016. 12(2). 81-91. doi: 10.1038/nrrheum.2015.133.
16. Ritchlin C.T., Colbert R.A., Gladman D.D. Psoriatic Arthritis. N. Engl. J. Med. 2017. 376(10). 957-970. doi: 10.1056/NEJMra1505557.
17. Karason A., Love T.J., Gudbjornsson B. A strong heritability of psoriatic arthritis over four generations — the Reykjavik Psoriatic Arthritis Study. Rheumatology. 2009. 48(11). 1424-8. doi: 10.1093/rheumatology/kep243.
18. Eder L., Chandran V., Gladman D.D. What have we learned about genetic susceptibility in psoriasis and psoriatic arthritis? Curr. Opin. Rheumatol. 2015. 27(1). 91-8. doi: 10.1097/BOR. 0000000000000136.
19. Chandran V., Bull S.B., Pellett F.J. et al. Human leukocyte antigen alleles and susceptibility to psoriatic arthritis. Hum. Immunol. 2013. 74(10). 1333-8. doi: 10.1016/j.humimm.2013.07.014.
20. Eder L., Chandran V., Pellet F. et al. Human leucocyte antigen risk alleles for psoriatic arthritis among patients with psoriasis. Ann. Rheum. Dis. 2012. 71(1). 50-5. doi: 10.1136/ard.2011.155044.
21. Queiro R., Gonzalez S., López-Larrea C. et al. HLA-C locus alleles may modulate the clinical expression of psoriatic arthritis. Arthritis. Res. Ther. 2006. 8(6). R185. doi: 10.1186/ar2097.
22. FitzGerald O., Haroon M., Giles J.T., Winchester R. Concepts of pathogenesis in psoriatic arthritis: genotype determines clinical phenotype. Arthritis. Res. Ther. 2015. 17. 115. doi: 10.1186/s13075-015-0640-3.
23. Tang H., Jin X., Li Y. et al. A large-scale screen for coding variants predisposing to psoriasis. Nat. Genet. 2014. 46(1). 45-50. doi: 10.1038/ng.2827.
24. Stuart P.E., Nair R.P., Tsoi L.C. et al. Genome-wide association analysis of psoriatic arthritis and cutaneous psoriasis reveals differences in their genetic architecture. Am. J. Hum. Genet. 2015. 97(6). 816-36. doi: 10.1016/j.ajhg.2015.10.019.
25. Gladman D.D., Brubacher B., Buskila D., Langevitz P., Farewell V.T. Differences in the expression of spondyloarthro-pathy: a comparison between ankylosing spondylitis and psoriatic arthritis. Clin. Invest. Med. 1993. 16. 1-7.
26. Helliwell P.S., Hickling P., Wright V. Do the radiological changes of classic ankylosing spondylitis differ from the changes found in the spondylitis associated with inflammatory bowel disease, psoriasis, and reactive arthritis? Ann. Rheum. Dis. 1998. 57. 135-140.
27. Perez Alamino R., Maldonado Cocco J.A., Citera G. et al. Differential features between primary ankylosing spondylitis and spondylitis associated with psoriasis and inflammatory bowel disease. J. Rheumatol. 2011. 38(8). 1656-60. doi: 10.3899/jrheum.101049.
28. Landi M., Maldonado-Ficco H., Perez-Alamino R. et al. Gender differences among patients with primary ankylosing spondylitis and spondylitis associated with psoriasis and inflammatory bowel disease in an iberoamerican spondyloarthritis cohort. Medicine. 2016. 95(51). e5652. doi: 10.1097/MD. 0000000000005652.
29. Lindstrom U., Bremander A., Haglund E. et al. Back pain and health status in patients with clinically diagnosed ankylosing spondylitis, psoriatic arthritis and other spondyloarthritis: a cross-sectional population-based study. BMC Musculoskelet. Disord. 2016 Feb 27. 17. 106. doi: 10.1186/s12891-016-0960-8.
30. Gladman D.D., Inman R.D., Cook R.J. et al. International spondyloarthritis interobserver reliability exercise — the INSPIRE study: I. Assessment of spinal measures. J. Rheumatol. 2007. 34(8). 1733-9.
31. Helliwell P.S. Assessment of disease activity in psoriatic arthritis. Clin. Exp. Rheumatol. 2015. 33. S44-S47.
32. Orbai A.M., de Wit M., Mease P. et al. International patient and physician consensus on a psoriatic arthritis core outcome set for clinical trials. Ann. Rheum. Dis. 2017. 76(4). 673-680. doi: 10.1136/annrheumdis-2016-210242.
33. Eder L., Chandran V., Shen H., Cook R.J., Gladman D.D. Is ASDAS better than BASDAI as a measure of disease activity in axial psoriatic arthritis? Ann. Rheum. Dis. 2010. 69(12). 2160-4. doi: 10.1136/ard.2010.129726.
34. Feld J. Is axial psoriatic arthritis distinct from ankylosing spondylitis with and without psoriasis? MSc thesis. University of Toronto. 2018 Nov. http:// hdl.handle.net/1807/91448.
35. Gladman D.D. Axial disease in psoriatic arthritis. Curr. Rheumatol. Rep. 2007. 9. 455-460. https://doi.org/10.1007/s11926-007-0074-2
36. Turkiewicz A.M., Moreland L.W. Psoriatic arthritis: current concepts on pathogenesis-oriented therapeutic options. Arthritis. Rheum. 2007. 56. 1051-1066. doi: 10.1002/art.22489.
37. Lubrano E., Marchesoni A., Olivieri I. et al. Psoriatic Arthritis Spondylitis Radiology Index: a modified index for radiologic assessment of axial involvement in psoriatic arthritis. J. Rheumatol. 2009. 36(5). 1006-11. doi: 10.3899/jrheum.080491.
38. Baraliakos X., Listing J., Rudwaleit M., Sieper J., Braun J. Development of a radiographic scoring tool for ankylosing spondylitis only based on bone formation: addition of the thoracic spine improves sensitivity to change. Arthritis. Rheum. 2009. 61(6). 764-71. doi: 10.1002/art.24425.
39. Biagioni B.J., Gladman D.D., Cook R.J. et al. Reliability of radiographic scoring methods in axial psoriatic arthritis. Arthritis. Care Res. 2014. 66(9). 1417-22. doi: 10.1002/acr.22308.
40. Rudwaleit M., Landewé R., van der Heijde D. et al. The development of Assessment of SpondyloArthritis International Society classification criteria for axial spondyloarthritis (part I): classification of paper patients by expert opinion including uncertainty appraisal. Ann. Rheum. Dis. 2009. 68(6). 770-6. doi: 10.1136/ard.2009.108217.
41. Golovach I.Y., Yehudina Y.D., Ter-Vartanіan S.K. The role of imaging methods in the diagnosis and management of axial spondyloarthritis. Trauma. 2020. 21(1). 102-115. doi: 10.22141/1608-1706.1.21.2020.197805.
42. Richette P., Tubach F., Breban M. et al. Psoriasis and phenotype of patients with early inflammatory back pain. Ann. Rheum. Dis. 2013. 72(4). 566-71. doi: 10.1136/annrheumdis-2012-201610.
43. Poggenborg R.P., Sorensen I.J., Pedersen S.J., Ostergaard M. Magnetic resonance imaging for diagnosing, monito-ring and prognostication in psoriatic arthritis. Clin. Exp. Rheumatol. 2015. 33. S66-S69.
44. Williamson L., Dockerty J.L., Dalbeth N. et al. Clinical assessment of sacroiliitis and HLA-B27 are poor predictors of sacroiliitis diagnosed by magnetic resonance imaging in psoriatic arthritis. Rheumatology. 2004. 43(1). 85-8. doi: 10.1093/rheumatology/keg475.
45. Maldonado-Ficco H., Sheane B.J., Thavaneswaran A., Chandran V., Gladman D.D. Magnetic resonance imaging in psoriatic arthritis: a descriptive study of indications, features and effect on treatment change. J. Clin. Rheumatol. 2017. 23(5). 243-245. doi: 10.1097/RHU. 0000000000000558.
46. Queiro R., Tejon P., Alonso S., Alperi M., Ballina J. Erosive discovertebral lesion (Andersson lesion) as the first sign of disease in axial psoriatic arthritis. Scand. J. Rheumatol. 2013. 42(3). 220-5. doi: 10.3109/03009742.2012.739637.
47. Castillo-Gallego C., Aydin S.Z., Emery P., McGonagle D.G., Marzo-Ortega H. Magnetic resonance imaging assessment of axial psoriatic arthritis: extent of disease relates to HLA-B27. Arthritis. Rheum. 2013. 65(9). 2274-8. doi: 10.1002/art.38050.
48. Poggenborg R.P., Pedersen S.J., Eshed I. et al. Head-to-toe whole-body MRI in psoriatic arthritis, axial spondyloarthritis and healthy subjects: first steps towards global inflammation and damage scores of peripheral and axial joints. Rheumatology. 2015. 54(6). 1039-49. doi: 10.1093/rheumatology/keu439.
49. Ogdie A., Coates L.C., Gladman D.D. Treatment guidelines in psoriatic arthritis Rheumatology. 2020. 59. 3-46. doi: 10.1093/rheumatology/kez383.
50. Ward M.M., Deodhar A., Gensler L.S. 2019 Update of the American College of Rheumatology/Spondylitis Association of America/Spondyloarthritis Research and Treatment Network Recommendations for the Treatment of Ankylosing Spondylitis and Nonradiographic Axial Spondyloarthritis. Arthritis & Rheumatology. 2019. 71(10). 1599-1613. doi: 10.1002/art.41042.
51. US National Library of Medicine. ClinicalTrials.gov. 2017. https://clinicaltrials.gov/ct2/show/NCT02721966
52. Baeten D., Østergaard M., Wei J.C. et al. Risankizumab, an IL-23 inhibitor, for ankylosing spondylitis: results of a randomised, double-blind, placebo-controlled, proof-of-concept, dose-finding phase 2 study. Ann. Rheum. Dis. 2018. 77. 1295-1302. doi: 10.1136/annrheumdis-2018-213328.
53. McHugh J. IL-23 inhibitor guselkumab shows pro-mise for PsA. Nat. Rev. Rheumatol. 2020. 16. 247. https://doi.org/10.1038/s41584-020-0420-6
54. Lubrano E., Parsons W.J., Perrotta F.M. Assessment of response to treatment, remission, and minimal disease activity in axial psoriatic arthritis treated with tumor necrosis factor inhibitors. J. Rheumatol. 2016. 43(5). 918-923. doi: 10.3899/jrheum.151404.
55. Lubrano E., Spadaro A., Marchesoni A. et al. The effectiveness of a biologic agent on axial manifestations of psoriatic arthritis. A twelve months observational study in a group of patients treated with etanercept. Clin. Exp. Rheumatol. 2011. 29(1). 80-84.
56. Pathan E., Abraham S., Van Rossen E. et al. Efficacy and safety of apremilast, an oral phosphodiesterase 4 inhibitor, in ankylosing spondylitis. Ann. Rheum. Dis. 2013. 72(9). 1475-80. doi: 10.1136/annrheumdis-2012-201915.
57. Kavanaugh A. Long-term experience with apremilast in patients with psoriatic arthritis: 5-year results from a PALACE 1–3 pooled analysis. Arthritis. Res. Ther. 2019. 21(1). 118. doi: 10.1186/s13075-019-1901-3.
58. Van der Heijde D., Deodhar A., Wei J.C. et al. Tofacitinib in patients with ankylosing spondylitis: a phase II, 16-week, randomised, placebo-controlled, dose-ranging study. Ann. Rheum. Dis. 2017. 76(8). 1340-1347. doi: 10.1136/annrheumdis-2016-210322.
59. Carette S., Graham D., Little H., Rubenstein J., Rosen P. The natural disease course of ankylosing spondylitis. Arthritis. Rheum. 1983. 26. 186-190.
60. Poddubnyy D., Sieper J. Radiographic progression in ankylosing spondylitis/axial spondyloarthritis: how fast and how clinically meaningful? Curr. Opin. Rheumatol. 2012. 24(4). 363-9. doi: 10.1097/BOR.0b013e328352b7bd.
61. Molnar C., Scherer A., Baraliakos X. et al. TNF blockers inhibit spinal radiographic progression in ankylosing spondylitis by reducing disease activity: results from the Swiss Clinical Quality Management cohort. Ann. Rheum. Dis. 2018. 77(1). 63-69. doi: 10.1136/annrheumdis-2017-211544.
62. Chandran V., Barrett J., Schentag C.T., Farewell V.T., Gladman D.D. Axial psoriatic arthritis: update on a longterm prospective study. J. Rheumatol. 2009. 36(12). 2744-50. doi: 10.3899/jrheum.090412.

/69.jpg)