Резюме
Актуальність. Гонартроз є одним із найбільш частих захворювань ортопедичного профілю, що завдає відчутного медико-соціального збитку хворим людям і суспільству в цілому. Гонартроз супроводжується мікроелементозом, що перебігає з порушенням в організмі рівнів багатьох есенціальних і токсичних металів. Після ендопротезування колінних суглобів в організмі пацієнтів змінюється вміст таких металів, як кобальт (Co), хром (Cr), титан (Ti) та інші, що здатні визначати «виживаність» трансплантатів протезів і подальший перебіг гонартрозу. Мета і завдання дослідження — визначити у волоссі хворих на гонартроз рівень металів, що входять до складу ендопротезів колінних суглобів (алюміній (Al), Co, Cr, залізо (Fe), молібден (Mo), нікель (Ni), Ti, ванадій (V)), зіставивши показники з концентраціями цих мікроелементів у крові, оцінити клініко-патогенетичну значущість цього мікроелементозу при різних варіантах перебігу захворювання. Матеріали та методи. Обстежено 87 хворих на гонартроз (із них 45 % чоловіків і 55 % жінок, середній вік — 53 роки). Встановлено І, ІІ і ІІІ стадії хвороби в 28, 41 і 31 % спостережень відповідно, поліартроз мав місце в 53 % випадків, остеохондроз хребта — у 92 %, спондилоартроз дуговідросчастих зчленувань — у 71 %, клінічно маніфестний синовіт (гоніт) — у 67 %. Для дослідження показників металів в організмі використовували атомно-абсорбційний спектрометр SolAAr-Mk2-MOZe з електрографітовим атомізатором (Велика Британія). Результати. У волоссі хворих на гонартроз у 23 % випадків спостерігався мікроелементоз металів, що супроводжувався збільшенням вмісту Al, Fe й Ti при зменшенні параметрів Co, Cr та Mo відповідно в 46, 100, 22, 12, 29 і 45 % спостережень. Це залежить від віку хворих, рентгенологічної стадії захворювання, наявності синовіту та тяжкості перебігу суглобового синдрому, бере участь в патогенезі ушкоджень надколінків, менісків й перилігаментиту, взаємопов’язано з остеопорозом (Al, Ni), а значення Cr, Ti і V в різних об’єктах дослідження (кров, волосся) корелюють між собою, мають прогностичну значущість. Висновки. Гонартроз перебігає зі зміною у волоссі рівнів металів (Al, Co, Cr, Fe, Mo, Ti), які можуть міститися в ендопротезах колінних зчленувань, що залежить від клінічного перебігу захворювання, визначає патогенетичні побудови артикулярних дегенеративно-запальних уражень і диктує необхідність дослідження стану мікроелементозу в організмі хворих у процесі динамічного спостереження після ендопротезування суглобів.
Актуальность. Гонартроз является одним из наиболее частых заболеваний ортопедического профиля, которое наносит ощутимый медико-социальный ущерб больным людям и обществу в целом. Гонартроз сопровождается микроэлементозом, протекающим с нарушением в организме уровней многих эссенциальных и токсичных металлов. После эндопротезирования коленных суставов в организме больных изменяется содержание таких металлов, как кобальт (Co), хром (Cr), титан (Ti) и другие, которые способны определять «выживаемость» трансплантатов протезов и дальнейшее течение гонартроза. Цель и задачи исследования — определить в волосах больных гонартрозом уровень металлов, входящих в состав эндопротезов коленных суставов (алюминий (Al), Co, Cr, железо (Fe), молибден (Mo), никель (Ni), Ti, ванадий (V)), сопоставив показатели с концентрациями этих микроэлементов в крови, оценить клинико-патогенетическую значимость данного микроэлементоза при разных вариантах течения заболевания. Материалы и методы. Обследовано 87 больных с гонартрозом (из них 45 % мужчин и 55 % женщин, средний возраст — 53 года). Установлены І, ІІ и ІІІ стадии болезни в 28, 41 и 31 % наблюдений соответственно, полиартроз имел место в 53 % случаев, остеохондроз позвоночника — в 92 %, спондилоартроз дугоотростчатых сочленений — в 71 %, клинически манифестный синовит (гонит) — в 67 %. Для исследования показателей металлов в организме использовали атомно-абсорбционный спектрометр SolAAr-Mk2-MOZe с электрографитовым атомизатором (Великобритания). Результаты. В волосах больных гонартрозом в 23 % случаев наблюдается микроэлементоз металлов, который сопровождается увеличением содержания Al, Fe и Ti при уменьшении параметров Co, Cr и Mo соответственно в 46, 100, 22, 12, 29 и 45 % наблюдений. Это зависит от возраста больных, рентгенологической стадии заболевания, наличия синовита и тяжести течения суставного синдрома, участвует в патогенезе повреждений надколенников, менисков и перилигаментита, взаимосвязано с остеопорозом (Al, Ni), а значения Cr, Ti и V в разных объектах исследования (кровь, волосы) коррелируют между собой, имеют прогностическую значимость. Выводы. Гонартроз протекает с изменением в волосах уровней металлов (Al, Co, Cr, Fe, Mo, Ti), содержащихся в эндопротезах коленных сочленений, что зависит от клинического течения заболевания, определяет патогенетические построения артикулярных дегенеративно-воспалительных поражений и диктует необходимость исследования состояния микроэлементоза в организме больных в процессе динамического наблюдения после эндопротезирования суставов.
Background. Gonarthrosis is one of the most common rheumatologic and orthopedic diseases, which cause a significant health and social damage, either to the ill people or to the society as a whole. Gonarthrosis is accompanied by microelementosis, with a violation in the body levels of many essential and toxic metals. After knee joint replacement, there is a change in the content of such me-tals as Co, Cr, Ti, and others, which are able to determine the survival of prosthesis and the further course of gonarthrosis. The purpose and objectives of the research — to determine the hair level of metals included in the composition of prosthetic knee joints (Al, Co, Cr, Fe, Mo, Ni, Ti, V) of patients with gonarthrosis, as well as to compare the values with concentrations of these trace elements in the blood, to evaluate the clinical and pathogenetic significance of this microelementosis with different variants of disease course. Materials and methods. We have examined 87 patients with gonarthrosis (45 % of them were men and 55 % — women, with an average age of 53 years). I, II and III stages of the disease were identified in 28, 41 and 31 % of observations, respectively, polyarthrosis — in 53 % of, osteochondrosis — is 92 %, spondylarthrosis of facet articulations — in 71 %, clinically overt synovitis (gonitis) — in 67 %. To study the level of metals in the body, we used atomic absorption spectrometer SolAAr-Mk2-MOZe with electrographitic atomizer (UK). Results. Microelementhosis in the blood of patients with gonarthrosis was observed in 41 % of cases, while in the hair — in 23 %, which is accompanied by increased levels of Ti and V in the blood serum on the background of reduced concentration of Fe that is accordingly observed in 40, 44 and 43 % of patients, and hair changes of metals are related to the increasing content of Al, Fe and Ti with decreasing parameters of Co, Cr and Mo in 46, 100, 22, 12, 29 and 45 % of cases. It depends on the radiographic stage of the disease, the presence of synovitis, the prevalence and severity of articular syndrome, is involved in the pathogenesis of lesions of the meniscus, bursitis, trabecular oedema of the patella, forming osteophytes, osteocytes and intraarticular Stieda bodies, which is correlated with osteoporosis (Al, Co, Cr, Ni), values of Cr, Ti and V in different objects of study (blood, hair) are correlated to each other, as well as have prognostic significance. Conclusions. Gonarthrosis occurs with changing blood and hair levels of metals contained in the total knee joints (Al, Co, Cr, Fe, Mo, Ti, V), which depends on the clinical course of the disease, determines the pathogenetic compositions of articular degenerative inflammatory lesions and forces the necessity to study microelementosis in the body of patients during dynamic observation after joint replacement.
Актуальность
Гонартроз является одним из наиболее частых заболеваний ревматологического и ортопедического профиля [7, 8, 14], которое наносит ощутимый медико-социальный ущерб больным людям и обществу в целом [11, 18]. Манифестный гонартроз наблюдается примерно у 10 % от числа взрослых людей [15], а при специальных исследованиях он диагностируется в 5 раз чаще [13].
Гонартроз сопровождается микроэлементозом с нарушением в организме уровней хрома (Cr), меди (Cu), железа (Fe), магния (Mn), молибдена (Mo), цинка (Zn) и других металлов [1]. В артикулярном хряще возрастает содержание Cu, а уровни в субхондральной кости Mo, никеля (Ni), свинца (Pb) и Zn либо не изменяются, либо уменьшаются [6]. Необходимо отметить, что гонартроз протекает с кобальтовым и никелевым микроэлементозом [12, 17].
Для эндопротезирования коленных суставов обычно используются искусственные сочленения, содержащие Co, Cr, Mo, Ti, ванадий (V) и другие металлы [19]. H.A. Kazi et al. [4] установили, что после двух лет существования в организме больных гонартрозом таких эндопротезов только уровень V в крови не изменяется, тогда как концентрации остальных микроэлементов значительно возрастают. J. Lützner et al. [9] в случаях эндопротезирования коленного сустава по поводу гонартроза не обнаружили повышения в крови показателей Co, Cr, Mo и Ni, входящих в состав сплава использованных протезов. Кобальто-хромовые эндопротезы способны вызывать синдром эндогенной интоксикации [2], что сопровождается увеличением в крови уровней и Со, и Cr [16]. По мнению I.A. Malek et al. [10], все-таки диагностическая и прогностическая значимость уровней Со и Cr в крови до эндопротезирования малоинформативна, поскольку имеет место весьма значительная изменчивость показателей этих металлов при гонартрозе, хотя подобные исследования требуют своего продолжения. В свою очередь, J.C. Hill et al. [3], M. Kiran и P.J. Boscainos [5] придерживаются иного мнения, а параметры кобальт- и хромемии предлагаются в качестве критериев мониторинга за больными после Co/Cr-эндопротезирования суставов.
Цель и задачи данного исследования — определить уровень металлов, входящих в состав эндопротезов коленных суставов (алюминий (Al), Co, Cr, Fe, Mo, Ni, Ti, V), в волосах больных гонартрозом, сопоставив показатели с концентрациями этих микроэлементов в крови, оценить клинико-патогенетическую значимость данного микроэлементоза при разных вариантах течения заболевания.
Материалы и методы
Под наблюдением находилось 87 больных гонартрозом в возрасте от 32 до 76 лет (средний возраст — 53,0 ± 1,0 года), среди которых было 44,8 % мужчин и 55,2 % женщин. В 35,6 % наблюдений диагностирован коксартроз, а полиартроз обнаружен в 52,9 % случаев, при этом суставной счет составил 5,0 ± 0,4 а.е. Имели место 1-я, 2-я и 3-я стадии гонартроза соответственно у 27,6, 41,4 и 31 % от числа больных, манифестный синовит при сонографии коленных суставов отмечен у 66,7 %. Остеохондроз позвоночника наблюдался у 92 % пациентов, спондилоартроз дугоотростчатых сочленений — у 71,3 %, системный остеопороз — у 16,1 %.
По данным рентгенографии, сонографии и магнитно-резонансной томографии коленных суставов установлены (в убывающем порядке) сужение артикулярных щелей в 98,9 % наблюдений, субхондральный склероз — в 78,2 %, остеофитоз — в 77 %, бурсит — в 64,4 %, дегенеративные изменения менисков — в 60 %, повреждения задних рогов медиального мениска — в 48,3 %, интраартикулярные хондромные тела — в 44,8 %, лигаментоз — в 41,4 %, остеокистоз — в 31 %, остеоузуры — в 30 %, трабекулярный отек бедренной кости — в 27,6 %, большеберцовой — в 25,3 %, внутрисуставные тела Штайди — в 24,1 %, эпифизарный остеопороз — в 23,0 %, кисты Бейкера, изменения сухожилия подколенной мышцы и переднего рога латерального мениска — в 21,8 %, трабекулярный отек надколенника — в 20,7 %, внутрисуставные тела Гоффа — в 12,7 %, перилигаментит — в 11,5 %, повреждения передней крестообразной связки — в 9,2 %, медиальной коллатеральной — в 5,8 %, изменения надколенника — в 2,3 %.
Пациентам выполняли рентгенологическое (аппарат Multix-Compact-Siеmens, Германия) и ультразвуковое (сонограф Envisor-Philips, Нидерланды) исследование суставов, двухэнергетическую рентгеновскую остеоденситометрию проксимального отдела бедренной кости (аппарат QDR-4500-Delphi-Hologic, США) и магнитно-резонансную томографию коленных суставов (томограф Signa-Excite-HD, Германия). Подсчитывали индекс тяжести гонартроза (GWI) по формуле: GWI = (S2 + Σ) : D, где S — стадия заболевания, Σ — сумма клинико-инструментальных признаков гонартроза, D — длительность его клинической манифестации. В волосах, которые накапливают металлы, изучали концентрации Al, Co, Cr, Fe, Mo, Ni, Ti, V. Применяли атомно-абсорбционный спектрометр SolAAr-Mk2-MOZe с электрографитовым атомизатором (Великобритания). В качестве контроля обследовано 44 практически здоровых человека в возрасте от 19 до 62 лет, среди которых было 17 мужчин и 27 женщин.
Статистическая обработка полученных результатов исследований проведена с помощью компьютерного вариационного непараметрического корреляционного регрессионного одно- (ANOVA) и многофакторного (ANOVA/MANOVA) дисперсионного анализа (программы Microsoft Excel и Statistica StatSoft, США). Оценивали средние значения (M), их стандартные отклонения (SD) и ошибки (SE), коэффициенты параметрической корреляции Пирсона (r) и непараметрической Кендалла (τ), критерии дисперсии Брауна — Форсайта (BF), Уилкоксона — Рао (WR), Стьюдента (t) и достоверность статистических показателей (p).
Определяли степень микроэлементоза (нарушений микроэлементного состава) в волосах (Ψ). При этом концентрацию каждого металла у конкретного больного, равную < М + SD здоровых, определяли как неизмененную (0 баллов), показатель от M + SD до M + 2SD — как минимально измененную (1 балл), от М + 2SD до М + 3SD — как умеренно измененную (2 балла), > M + 3SD — как значительно измененную (3 балла). Микроэлементоз для каждого металла устанавливали при ≥ 1 балла (≥ M + SD), Ψ был суммой баллов изменений того или иного металла (микроэлемента) в волосах.
Результаты
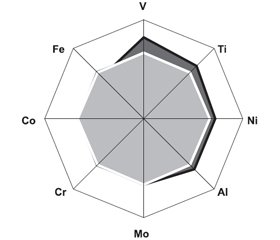
При гонартрозе показатели металлов в волосах (M ± ± SD ± SE) оказались следующими: концентрация Al составила 2,70 ± 0,87 ± 0,09 мкг/г, Co — 14,00 ± 7,91 ± ± 0,85 нг/г, Cr — 33,60 ± 17,97 ± 1,93 нг/г, Fe — 10,30 ± ± 4,19 ± 0,45 мкг/г, Mo — 1,60 ± 0,34 ± 0,04 мкг/г, Ni — 3,70 ± 1,81 ± 0,19 мкг/г, Ti — 2,30 ± 0,48 ± 0,05 мкг/г, V — 128,40 ± 112,93 ± 12,11 нг/г. По сравнению со здоровыми людьми заболевание протекает с повышением (на 23 %) в волосах содержания Al (t = 3,38; p = 0,001), на 10 % — Ti (t = 2,67; p = 0,009) и в 6,1 раза — Fe (t = 13,64; p < 0,001). При этом уровень Со уменьшается на 23 % (t = 2,12; p = 0,036), Cr — на 22 % (t = 2,62; p = 0,010) и Мо — на 16 % (t = 4,40; p < 0,001), что нашло свое отражение на рис. 1. Изменения показателей (< M ± SD > здоровых) Fe, Al, Mo, Cr, Ti и Co соответственно обнаружены в 100, 46, 45, 29, 22 и 12 % от числа больных (рис. 2).
/112-1.jpg)
Микроэлементоз металлов (Ψ ≥ 1 у.е.) в волосах наблюдался у 23 % от числа больных гонартрозом, а средние значения Ψ были равны 0,740 ± 0,034 у.е. При этом гендерные особенности таких показателей отсутствовали, составляя у мужчин и женщин по частоте 23,1 и 22,9 %, а по уровню Ψ 0,730 ± 0,051 и 0,760 ± 0,045 у.е. Установлена прямая корреляционная связь Пирсона между параметрами Ni ↔ Ti (r = +0,220; p = 0,040), а обратная — Co ↔ Mo (r = –0,617; p < 0,001) и Cr ↔ V (r = –0,392; p < 0,001).
Обсуждение
По результатам выполненного многофакторного анализа Уилкоксона — Рао пол больных не оказывает влияния на интегральные показатели металлов в волосах, но, как свидетельствует однофакторный дисперсионный анализ Брауна — Форсайта, от пола обследованных пациентов с высокой достоверностью зависят (p < 0,001) параметры в волосах Al (BF = 107,78), Co (BF = 22,94), Cr (BF = 20,27), Fe (BF = 45,91) и V (BF = 16,40). Вместе с тем только средние значения Ti у женщин были на 14 % достоверно выше (t = 2,57; p = 0,012), что представлено на рис. 3, 4.
/113-1.jpg)
Интегральное состояние микроэлементного состава металлов в волосах больных гонартрозом зависит от GWI (WR = 1,75; p = 0,044), наличия манифестного синовита (WR = 4,36; p < 0,001) и системного остеопороза (WR = 2,19; p = 0,037), что демонстрирует ANOVA/MANOVA. По данным однофакторного анализа Брауна — Форсайта, возраст больных влияет на содержание Al (BF = 19,13; p < 0,001), Co (BF = 3,61; p < 0,001), Cr (BF = 2,74; p = 0,001), Fe (BF = 3,05; p = 0,002) и V (BF = 3,51; p < 0,001), при этом, по результатам корреляционного анализа, с возрастом у пациентов возрастают в волосах уровни Мо (r = +0,210; p = 0,048) и V (r = +0,302; p = 0,004), но уменьшается концентрация Сr (r = –0,254; p = 0,018).
Рентгенологическая стадия гонартроза оказывает воздействие на содержание в волосах Al (BF = 5,70; p < 0,001), Co (BF = 2,44; p = 0,004) и Ti (BF = 3,18; p = 0,047), а с параллельным остеохондрозом позвоночника дисперсионно связан только уровень Al (BF = 2,87; p = 0,028). Показатель последнего обратно коррелирует с параметром минеральной плотности кости (r = –0,322; p = 0,002).
Следующим этапом нашей работы стала оценка роли металлов в волосах в патогенезе гонартроза. На показатель GWI с высокой достоверностью (p < 0,001) влияют значения Al (BF = 8,53), Fe (BF = 18,23), Mo (BF = 27,00) и Ti (BF = 10,96). От накопления в волосах Al, Mo и Ti также зависят параметры суставного счета (соответственно BF = 2,10, p = 0,010; BF = 1,89, p = 0,039; BF = 6,37, p < 0,001), развитие синовита тесно связано с содержанием Со (BF = 6,83; p = 0,011), а остеопороза — Fe (BF = 4,51; p = 0,037). C уровнем Ni прямо коррелирует показатель GWI (r = +0,452; p = 0,011), что отражено на рис. 5.
/113-2.jpg)
Со значениями Ψ при гонартрозе имеют место прямые дисперсионно-корреляционные связи степени повреждения надколенника (BF = 13,43, p < 0,001; τ = +0,200, p = 0,006) и дегенеративных изменений менисков коленных суставов (BF = 3,77, p = 0,043; τ = +0,191, p = 0,045), о чем свидетельствуют выполненные анализы Брауна — Форсайта и Кендалла. Кроме того, существует влияние Ψ на развитие перилигаментита (BF = 5,55; p = 0,021). C учетом представленных данных параметры Ψ > 1,1 у.е. (> M + SD больных с гонартрозом) являются факторами риска тяжелых изменений надколенника и менисков.
Выводы
1. В волосах больных гонартрозом микроэлементоз металлов, которые могут входить в состав эндопротезов коленных сочленений, наблюдается в 23 % случаев и проявляется увеличением содержания Al, Fe и Ti при уменьшении параметров Co, Cr и Mo соответственно в 46, 100, 22, 12, 29 и 45 % наблюдений.
2. Накопление в волосах металлов зависит от возраста больных, рентгенологической стадии заболевания, наличия синовита и тяжести течения суставного синдрома.
3. Микроэлементоз участвует в патогенезе повреждений надколенников, менисков и перилигаментита, взаимосвязан с остеопорозом, что диктует необходимость исследования уровней металлов в волосах больных в процессе динамического наблюдения после эндопротезирования суставов.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов при подготовке данной статьи.
Список литературы
1. Colotti G., Ilari A., Boffi A., Morea V. Metals and metal derivatives in medicine // Mini Rev. Med. Chem. — 2013. — № 13(2). — Р. 211-21.
2. Czekaj J., Ehlinger M., Rahme M., Bonnomet F. Metallosis and cobalt-chrome intoxication after hip resurfacing arthroplasty // J. Orthop. Sci. — 2016. — № 21(3). — Р. 389-94. — doi: 10.1016/j.jos.2015.06.001.
3. Hill J.C., Diamond O.J., O’Brien S., Boldt J.G., Stevenson M., Beverland D.E. Early surveillance of ceramic-on-metal total hip arthroplasty // Bone Joint J. — 2015. — № 97(3). — Р. 300-5. — doi: 10.1302/0301-620X.97B3.33242.
4. Kazi H.A., Perera J.R., Gillott E., Carroll F.A., Briggs T.W. A prospective study of a ceramic-on-metal bearing in total hip arthroplasty. Clinical results, metal ion levels and chromosome analysis at two years // Bone Joint J. — 2013. — № 95(8). — Р. 1040-4. — doi: 10.1302/0301-620X.95B8.31574.
5. Kiran M., Boscainos P.J. Adverse reactions to metal debris in metal-on-polyethylene total hip arthroplasty using a titanium-molybdenum-zirconium-iron alloy stem // J. Arthroplasty. — 2015. — № 30(2). — Р. 277-81. — doi: 10.1016/j.arth.2014.06.030.
6. Kubaszewski L., Zioła-Frankowska A., Frankowski M., Rogala P., Gasik Z., Kaczmarczyk J. et al. Comparison of trace element concentration in bone and intervertebral disc tissue by atomic absorption spectrometry techniques // J. Orthop. Surg. Res. — 2014. — № 25(9). — Р. 99-109. — doi: 10.1186/s13018-014-0099-y.
7. Lamberg E.M., Streb R., Werner M., Kremenic I., Penna J. The 2- and 8-week effects of decompressive brace use in people with medial compartment knee osteoarthritis // Prosthet. Orthot. Int. — 2016. — № 40(4). — Р. 447-53. — doi: 10.1177/0309364615589537.
8. Leung Y.Y., Ma S., Noviani M., Wong S.B., Lee C.M., Soh I.A. et al. Validation of screening questionnaires for evaluation of knee osteoarthritis prevalence in the general population of Singapore // Int. J. Rheum. Dis. — 2017. — № 21(12). — Р. 132-8. — doi: 10.1111/1756-185X.13252.
9. Lützner J., Hartmann A., Dinnebier G., Spornraft-Ragaller P., Hamann C., Kirschner S. Metal hypersensitivity and metal ion levels in patients with coated or uncoated total knee arthroplasty: a randomised controlled study // Int. Orthop. — 2013. — № 37(10). — Р. 1925-31. — doi: 10.1007/s00264-013-2010-6.
10. Malek I.A., Rogers J., King A.C., Clutton J., Winson D., John A. The interchangeability of plasma and whole blood metal ion measurement in the monitoring of metal on metal hips // Arthritis. — 2015. — № 2015. — Р. 216785. — doi: 10.1155/2015/216785.
11. Malzahn J. Conservative and operative treatment of working age patients with gonarthritis. Economic considerations // Orthopade. — 2014. — № 43(6). — Р. 503-6, 508-10. — doi: 10.1007/s00132-014-2295-1.
12. Matharu G.S., Berryman F., Brash L., Pynsent P.B., Treacy R.B., Dunlop D.J. Predicting high blood metal ion concentrations following hip resurfacing // Hip. Int. — 2015. — № 25(6). — Р. 510-9. — doi: 10.5301/hipint.5000258.
13. McQueen P., Gates L., Marshall M., Doherty M., Arden N., Bowen C. The effect of variation in interpretation of the La Trobe radiographic foot atlas on the prevalence of foot osteoarthritis in older women: the Chingford general population cohort // J. Foot Ankle Res. — 2017. — № 8(10). — Р. 54-9. — doi: 10.1186/s13047-017-0239-9.
14. Nelson A.E. Osteoarthritis year in review 2017: clinical // Osteoarthritis Cartilage. — 2017. — № 8(12). — Р. 348-51. — doi: 10.1016/j.joca.2017.11.014.
15. Plotnikoff R., Karunamuni N., Lytvyak E., Penfold C., Schopflocher D., Imayama I. et al. Osteoarthritis prevalence and modifiable factors: a population study // BMC Public Health. — 2015. — № 30(15). — Р. 1195. — doi: 10.1186/s12889-015-2529-0.
16. Steinberg J., Shah K.M., Gartland A., Zeggini E., Wilkinson J.M. Effects of chronic cobalt and chromium exposure after metal-on-metal hip resurfacing: An epigenome-wide association pilot study // J. Orthop. Res. — 2017. — № 18(1). — Р. 133-9. — doi: 10.1002/jor.23525.
17. Stejskal V., Reynolds T., Bjørklund G. Increased frequency of delayed type hypersensitivity to metals in patients with connective tissue disease // J. Trace Elem. Med. Biol. — 2015. — № 31. — Р. 230-6. — doi: 10.1016/j.jtemb.2015.01.001.
18. Vina E.R., Kwoh C.K. Epidemiology of osteoarthritis: lite-rature update // Curr. Opin. Rheumatol. — 2017. — № 8(12). — Р. 142-9. — doi: 10.1097/BOR.0000000000000479.
19. Weber P., Steinbrück A., Paulus A.C., Woiczinski M., Schmidutz F., Fottner A. et al. Partial exchange in total hip arthroplasty: what can we combine? // Orthopade. — 2017. — № 46(2). — Р. 142-7. — doi: 10.1007/s00132-016-3380-4.

/112-1.jpg)
/113-1.jpg)
/113-2.jpg)