Резюме
В організмі людини аргінін піддається інтенсивному метаболізму NO-синтазою до монооксиду азоту (NO), який має протимікробну дію, розширює судини, відіграє важливу роль в усіх фазах загоєння ран (запальній і регенеративній). Крім того, аргінін метаболізується аргіназою з утворенням орнітину. Орнітин перетворюється на поліаміни, що необхідні для росту клітин, а також стає джерелом проліну і гідроксипроліну, необхідних для синтезу колагену.
Таким чином, обидві групи ефектів аргініну сприяють відновленню клітин і міжклітинної речовини при загоєнні ран. Для реалізації цих ефектів важливе значення має здатність даної амінокислоти підвищувати вміст таких факторів росту, як IGF-I, TGF-β, VEGF, KGF. Крім цього, аргінін проявляє імуностимулюючі властивості, що важливо для боротьби з інфекцією рани. В огляді докладно описані нові дані про роль NO в ангіогенезі (формування судин з ендотеліальних клітин судин, що залишилися в рані) і васкулогенезі (формування судин з ендотеліальних клітин-попередників, що вивільняються з кісткового мозку) в ході загоєння ран. Наведені приклади клінічних досліджень, у яких ефективність L-аргініну була продемонстрована у хворих із пролежнями і діабетичною стопою.
В организме человека аргинин интенсивно метаболизируется NO-синтазой до монооксида азота (NO), который оказывает противомикробное действие, расширяет сосуды, играет важную роль во всех фазах заживления ран (воспалительной и регенеративной). Кроме того, аргинин метаболизируется аргиназой с образованием орнитина. Орнитин превращается в полиамины, которые необходимы для роста клеток, а также становится источником пролина и гидроксипролина, необходимых для синтеза коллагена.
Таким образом, обе группы эффектов аргинина способствуют восстановлению клеток и межклеточного вещества при заживлении ран. Для реализации этих эффектов важное значение имеет способность данной аминокислоты повышать содержание таких факторов роста, как IGF-I, TGF-β, VEGF, KGF. Помимо этого, аргинин проявляет иммуностимулирующие свойства, что важно для борьбы с инфекцией раны. В обзоре подробно описаны новые данные о роли NO в ангиогенезе (формирование сосудов из эндотелиальных клеток оставшихся в ране сосудов) и васкулогенезе (формирование сосудов из эндотелиальных клеток-предшественников, высвобождаемых из костного мозга) в ходе заживления ран. Приведены примеры клинических исследований, в которых эффективность L-аргинина была продемонстрирована у больных с пролежнями и диабетической стопой.
In the human body, arginine is extensively metabolized by nitric oxide (NO) synthase to nitrogen monoxide, which has an antimicrobial effect, dilates blood vessels, plays an important role in all phases of wound healing (inflammatory and regenerative). In addition, arginine is metabolized by arginase with the formation of ornithine. Ornithine is converted into polyamines, which are necessary for cell growth, and also becomes a source of proline and hydroxyproline necessary for the synthesis of collagen.
Thus, both groups of arginine effects contribute to the recovery of cells and intercellular substance during wound healing. To realize these effects, the ability of this amino acid to increase the content of such growth factors as insulin-like growth factor-I, transforming growth factor-beta, vascular endothelial growth factor, keratinocyte growth factor is important. In addition, arginine shows immunostimulating properties, which is important for fighting infection of the wound. The review details new data on the role of NO in angiogenesis (the formation of vessels from endothelial cells remaining in the wound of the vessels) and vasculogenesis (formation of vessels from endothelial progenitor cells released from the bone marrow) during wound healing. Examples of clinical trials, in which the efficacy of L-arginine has been demonstrated in patients with bedsores and diabetic foot, are given.
Молекула L-аргинина многогранна и благодаря способности быть донатором оксида азота для клеток эндотелия сосудов проявляет множество терапевтических эффектов. Поскольку в нашей стране молекула так же востребована, как и во всем мире, то по просьбе наших читателей мы приводим литературный обзор механизмов действия и применения этой удивительной аминокислоты при заживлении ран. L-аргинин доступен как для использования в условиях стационара (Тивортин, 4,2% раствор для инфузионного применения), так и для амбулаторно-поликлинического применения в схеме ступенчатой терапии (Тивортин аспартат, 200 мг/мл, раствор для перорального применения).
В ряде экспериментальных исследований было установлено, что уже в ранний период заживления в ранах формируется стойкий относительный дефицит аминокислоты аргинина. В результате заживление ран в последующие дни может замедляться [1]. По этой причине дополнительное назначение аргинина нормализует или ускоряет заживление ран, активизируя процесс реабилитации в целом [2, 3].
В настоящее время установлен ряд ведущих механизмов, с помощью которых аргинин положительно влияет на заживление ран.
Прежде всего аргинин интенсивно метаболизируется NO-синтазой до монооксида азота (NO). Будучи активным радикалом, NO взаимодействует с активными радикалами кислорода и формирует пероксинитрит (OONO–), который осуществляет в ране противомикробное действие за счет прямой атаки и разрушения биомолекул бактерий. Кроме того, NO расширяет сосуды, улучшая приток крови к ране. NO играет важную роль во всех фазах заживления раны (воспалительной, регенеративной), о чем подробнее будет сказано ниже [4–6].
Кроме того, аргинин метаболизируется аргиназой с образованием орнитина. Орнитин превращается в полиамины, которые необходимы для роста клеток, а также становится источником пролина и гидроксипролина, необходимых для синтеза коллагена [4].
Таким образом, обе группы эффектов аргинина способствуют восстановлению клеток и межклеточного вещества при заживлении ран. Для реализации этих эффектов важное значение имеет способность данной аминокислоты повышать содержание инсулиноподобного фактора роста 1 (IGF-I), трансформирующего фактора роста β1 (TGF-β1), сосудистого эндотелиального фактора роста (VEGF) и фактора роста кератиноцитов (KGF) [4, 7].
Помимо этого, аргинин проявляет иммуностимулирующие свойства (тест на лимфоцитарный митогенез in vitro), что важно для борьбы с инфекцией раны [7, 8].
В большом количестве экспериментальных исследований была подтверждена эффективность аргинина в виде монотерапии или в комбинации с другими нутриентами при самой различной раневой патологии: кожных ранах, ожогах, язвах и анастомозах желудочно-кишечного тракта, ранах твердой мозговой оболочки, переломах костей, послеоперационных ранах, ранах при диабете, ишемизированных ранах и т.д. [2–4].
В настоящем обзоре была поставлена цель осветить ряд NO-зависимых механизмов заживления ран со специальным акцентом на ангио- и васкулогенезе, а также представить результаты выборочных клинических исследований.
Некоторые NO-зависимые механизмы заживления ран [9–16]
Раны самого разного происхождения — травматические, послеоперационные, ишемические и т.д. — после своего возникновения часто требуют естественного и/или искусственного гемостаза, после чего в неосложненных (например, диабетом) случаях наблюдается нормальный процесс заживления.
Во время индукции фазы воспаления NO способствует повышению содержания в ране хемоаттрактантных цитокинов, таких как IL-8, TGF-β1 и др. Эти цитокины играют привлекающую роль для нейтрофилов и с некоторой задержкой — моноцитов. Функция нейтрофилов сводится к фагоцитозу и перевариванию бактерий и некротизированных тканей, после чего наступает апоптоз нейтрофилов. Приходящие к тому времени в рану моноциты превращаются в макрофаги и фагоцитируют апоптотические нейтрофилы, что ведет к завершению фазы воспаления. В это время влияние NO направлено на снижение присутствия в ране хемоаттрактантных цитокинов (RANTES, MCP-1 и др.).
Все остальные процессы заживления ран направлены на восстановление нормальной структуры тканей одного или нескольких органов (фаза регенерации).
NO способствует восстановлению сосудистой сети в ране за счет стимуляции ангио- и васкулогенеза. Эти процессы детально описаны ниже; поскольку «ключевыми игроками» в них являются VEGF, NO-синтаза и NO, то именно этим регуляторным молекулам будет уделено основное внимание. В дополнение к восстановлению сосудов NO усиливает также пролиферацию (деление) других клеток, например фибробластов и кератиноцитов. Это, в частности, ускоряет реэпителизацию ран, то есть обеспечивает более быстрое закрытие их кожным покровом. Еще одним из важных вкладов NO является способность усиливать синтез коллагена, что помогает более быстрому восстановлению межклеточного вещества (внеклеточного матрикса).
Таким образом, все вышесказанное позволяет заключить, что NO является важной регуляторной молекулой, сопровождающей все стадии заживления раны. В большинстве случаев в образовании NO принимают участие обе изоформы NO-синтазы — индуцибельная (iNOS) и эндотелиальная (eNOS), хотя их удельный вклад в те или иные процессы ранозаживления может меняться.
Ангиогенез [17–24]
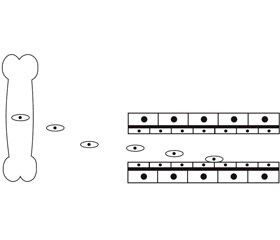
Ангиогенез характеризуется образованием новых сосудов из резидентных (местных) эндотелиальных клеток сохранившихся в ране сосудов. Ниже последовательно описаны этапы ангиогенеза, схематически изображенные также на рис. 1А-В.
Вначале такие факторы, как ишемия, травма, приводят к высвобождению из эндотелиальных и ряда других клеток (например, кератиноцитов) сосудистого эндотелиального фактора роста (VEGF). Эти молекулы активируют eNOS с образованием NO, что приводит к высвобождению из эндотелиальных клеток матриксных металлопротеиназ (MMPs). Последние разрушают базальную мембрану сосудов и окружающий матрикс, освобождая место для всех последующих процессов (рис. 1А).
Далее те же самые процессы — высвобождение VEGF с активацией eNOS и образованием NO — стимулируют миграцию и пролиферацию эндотелиальных клеток. На рис. 1Б видно, что эндотелиальные клетки образуют специальные мембранно-цитоплазматические выпячивания — филоподии, продвигаясь (мигрируя) в «ниши», подготавливаемые для них MMPs. Вскоре после этого происходит деление клеток с образованием отходящих от материнских сосудов отростков (рис. 1В).
Каждая из вновь образованных эндотелиальных клеток, составляющих такие отростки, изгибается по типу «атлета, лежащего на животе и руками достающего свои ноги». В результате формируется эндотелиальная тубула, по мере роста устанавливающая связи с другими сосудами. Описанные здесь процессы на рис. 1 не представлены.
Наконец, те же самые процессы — высвобождение VEGF с активацией eNOS и образованием NO — стимулируют миграцию к эндотелиальным тубулам клеток-предшественников сосудистой стенки и образование из них гладкомышечных клеток и перицитов (рис. 1В). Они окружают эндотелиальные тубулы, что приводит к формированию полноценных сосудов.
В заключение необходимо отметить, что помимо эндотелиальной NO-синтазы (eNOS) в большинстве вышеперечисленных процессов участвует и индуцибельная NO-синтаза (iNOS), также продуцирующая NO. Доказательством служит то, что блокада этого фермента приводила к нарушению ангиогенеза, хотя eNOS продолжала работать. В настоящее время исследователи продолжают выяснять удельный взаимный вклад и место каждого из перечисленных ферментов в процессах ангиогенеза.
Васкулогенез [17, 18, 25–28]
Васкулогенез отличается от ангиогенеза тем, что новые сосуды образуются не из резидентных эндотелиальных клеток, а благодаря эндотелиальным клеткам-предшественникам (EPCs), высвобождаемым из костного мозга.
Уже неоднократно упоминавшиеся выше стимулы — высвобождение VEGF с активацией eNOS и образованием NO — приводят к мобилизации эндотелиальных клеток-предшественников из костного мозга и поступлению их в кровоток. Как следствие, они перемещаются по организму. Интересно, что эти же стимулы способствуют адгезии эндотелиальных клеток-предшественников к эндотелию сосудов в месте реваскуляризации (на периферии, в месте расположения раны) (рис. 2).
Все последующие процессы во многом напоминают таковые при ангиогенезе (см. выше) с той разницей, что помимо миграции и пролиферации эндотелиальные клетки-предшественники должны претерпеть дифференцировку до обычных эндотелиальных клеток. Процесс дифференцировки также направляется VEGF — eNOS — NO-регуляцией.
В заключение важно добавить, что, как и в случае ангиогенеза, для васкулогенеза важна активность не только эндотелиальной (eNOS), но и индуцибельной NO-синтазы (iNOS).
Примеры клинических исследований
Пролежни
В 2017 г. был выполнен систематический обзор, направленный на оценку влияния аргинин-обогащенной диеты на заживление пролежней. В него в общей сложности было включено 7 рандомизированных контролируемых исследований (n = 369).
В 4 из них о степени заживления пролежней судили по уменьшению их площади. Во всех исследованиях было сообщено о том, что аргинин-обогащенная диета приводила к достоверному улучшению заживления пролежней по сравнению со стандартной больничной диетой в течение 2–12 недель наблюдения. Среди этих 4 исследований 1 включало пациентов с пониженным пищевым статусом, 1 — пациентов без пониженного пищевого статуса, в 2 других не было ограничений по пищевому статусу пациентов.
В 4 рандомизированных контролируемых исследованиях заживление пролежней оценивали по шкале заживления пролежней (Pressure Ulcer Scale for Healing (PUSH)). Во всех исследованиях было сообщено, что аргинин-обогащенная диета приводила к достоверному улучшению балла по шкале PUSH по сравнению с контролем.
В 1 рандомизированном контролируемом исследовании заживление пролежней оценивали по шкале оценки состояния пролежней (Pressure Sore Status Tool (PSST)). При этом пациенты, получавшие аргинин, имели наименьший балл по шкале PSST по сравнению с контролем.
На основании проанализированных данных авторы систематического обзора пришли к выводу, что аргинин-обогащенная диета приводила к достоверному улучшению заживления пролежней. Причем она была эффективна не только у пациентов с пониженным пищевым статусом, но и у всех остальных пациентов [29].
Интересно, что в одном из исследований, включенных в упомянутый систематический обзор, было изу-чено влияние различных доз аргининсодержащих добавок на заживление пролежней. В общей сложности 33 стационарных пациента с пролежнями II, III и IV категории были рандомизированы к ежедневному получению в течение 3 недель стандартной больничной диеты плюс 4,5 или 9 г аргинина перорально. Размер и тяжесть пролежней оценивали еженедельно с помощью шкалы PUSH (0 — полное заживление, 17 — наибольшая тяжесть). Пищевой статус определяли с помощью шкалы субъективной глобальной оценки (Subjective Global Assessment (SGA)). В результате исследования было установлено достоверное снижение тяжести пролежней с течением времени (p < 0,001). При этом не было обнаружено достоверной разницы в скорости заживления между двумя дозами аргинина (р = 0,991). Проведение оценки на основе ожидаемого времени заживления показало, что пациенты обеих лечебных групп достигали почти 2-кратного улучшения по сравнению с ретроспективной контрольной группой. У пациентов с пониженным пищевым статусом наблюдалось клинически значимое нарушение скорости заживления по сравнению с пациентами с хорошим пищевым статусом (p = 0,057), хотя на это не влияла доза аргинина (p = 0,727). По результатам исследования авторы заключили, что те же самые клинические преимущества в заживлении пролежней могут быть достигнуты при использовании более низких доз аргинина, что может повысить готовность пациента выполнять назначения врача [30].
Раны диабетической стопы
В цитируемой работе было изучено влияние аргинина на язвы стоп у пациентов с сахарным диабетом. В исследование было включено три группы пациентов: 11 пациентов без язв не получали никакого лечения и служили в качестве контроля; 11 пациентов с диабетическими язвами получали стандартную терапию и служили в качестве диабетического контроля; 11 пациентов с диабетическими язвами получали 10 мМ аргинина подкожно в месте расположения раны. В результате было обнаружено, что 8 пациентов, получавших лечение аргинином, достигли полного заживления ран; у оставшихся 3 пациентов, выбывших из исследования вследствие изменения места жительства, наблюдалось значимое улучшение. Исследователи сообщают, что их работа строго подтверждает эффективность аргинина в успешном заживлении диабетических язв [31].
В следующее ретроспективное исследование было включено 11 диабетических гемодиализных пациентов с целью оценить влияние диеты с β-гидрокси-β-метилбутиратом, аргинином и глутамином на заживление ран диабетической стопы. В итоге было выяснено, что в соответствии со шкалой оценки ран Бейтс-Дженсен (Bates-Jensen Wound Assessment Tool (BWAT)) спустя 4 недели лечения заживление наблюдалось: по баллам глубины раны у 7 (64 %) пациентов, по баллам внешнего вида раны у 8 (73 %) пациентов. Хотя баллы глубины раны у 4 (36 %) пациентов и баллы внешнего вида раны у 3 (27 %) пациентов не менялись, ухудшение не наблюдалось ни у одного из пациентов в течение всего периода наблюдения. Был сделан вывод о том, что назначение β-гидрокси-β-метилбутирата, аргинина и глутамина вносит позитивный вклад в заживление ран у диабетических гемодиализных пациентов [32].
Выводы
1. Современные данные свидетельствуют о важной роли L-аргинина и образуемого из него оксида азота (NO) и орнитина в формировании ранозаживляющего действия. В воспалительной фазе эффекты направлены на борьбу с инфекцией и удаление некротизированных масс. В регенеративной фазе важное значение приобретают ангио- и васкулогенез, восстановление численности других клеток (например, кератиноцитов при реэпителизации) и межклеточного вещества (коллаген).
2. В статье приведены примеры клинических исследований, в которых эффективность L-аргинина была продемонстрирована у больных с пролежнями и диабетической стопой.
3. На фармацевтическом рынке Украины L-аргинин доступен в виде пероральных (Тивортин аспартат) и инфузионных форм препарата Тивортин® (фармацевтическая компания «Юрия Фарм»).
Список литературы
1. Increased nitric oxide formation followed by increased arginase activity induces relative lack of arginine at the wound site and alters whole nutritional status in rats almost within the early healing period / Zunić G., Supić G., Magić Z. et al. // Nitric Oxide. — 2009. — V. 20, № 4. — P. 253-258.
2. Curran J.N., Winter D.C., Bouchier-Hayes D. Biological fate and clinical implications of arginine metabolism in tissue healing // Wound Repair Regen. — 2006. — V. 14, № 4. — P. 376-386.
3. Witte M.B., Barbul A. Arginine physiology and its implication for wound healing // Wound Repair Regen. — 2003. — V. 11, № 6. — P. 419-423.
4. Alexander J.W., Supp D.M. Role of Arginine and Omega-3 Fatty Acids in Wound Healing and Infection // Advances in Wound Care. — 2014. — V. 3, № 11. — P. 682-690.
5. Hamed S., Brenner B., Roguin A. Nitric oxide: a key factor behind the dysfunctionality of endothelial progenitor cells in diabetes mellitus type-2 // Cardiovasc. Res. — 2011. — V. 91, № 1. — P. 9-15.
6. Nitric oxide drives skin repair: novel functions of an established mediator / Frank S., Kämpfer H., Wetzler C., Pfeilschi-fter J. // Kidney Int. — 2002. — V. 61, № 3. — P. 882-888.
7. Arginine stimulates wound healing and immune function in elderly human beings / Kirk S.J., Hurson M., Regan M.C. et al. // Surgery. — 1993. — V. 114, № 2. — P. 155-159.
8. Enteral nutrition with supplemental arginine, RNA, and omega-3 fatty acids in patients after operation: immunologic, metabolic, and clinical outcome / Daly J.M., Lieberman M.D., Goldfine J. et al. // Surgery. — 1992. — V. 112, № 1. — P. 56-67.
9. Luo J.D., Chen A.F. Nitric oxide: a newly discovered function on wound healing // Acta Pharmacol. Sin. — 2005. — V. 26, № 3. — P. 259-264.
10. Nitric oxide and wound repair: role of cytokines? / Schwentker A., Vodovotz Y., Weller R., Billiar T.R. // Nitric Oxide. — 2002. — V. 7, № 1. — P. 1-10.
11. Kobayashi Y. The regulatory role of nitric oxide in proinflammatory cytokine expression during the induction and resolution of inflammation // J. Leukoc. Biol. — 2010. — V. 88, № 6. — P. 1157-1162.
12. Denning T., Nusrat A. Wound repair: role of immune–epithelial interactions / Leoni G., Neumann P.-A., Sumagin R. et al. // Mucosal immunology. — 2015. — V. 8, № 5. — P. 959-968.
13. Segal A.W. How Neutrophils Kill Microbes // Annual review of immunology. — 2005. — V. 23. — P. 197-223.
14. L-arginine stimulates fibroblast proliferation through the GPRC6A-ERK1/2 and PI3K/Akt pathway / Fujiwara T., Kanazawa S., Ichibori R. et al. // PLoS One. — 2014. — V. 9, № 3. — Article ID e92168.
15. The function of nitric oxide in wound repair: inhibition of inducible nitric oxide-synthase severely impairs wound reepithelialization / Stallmeyer B., Kämpfer H., Kolb N. et al. // J. Invest. Dermatol. — 1999. — V. 113, № 6. — P. 1090-1098.
16. Enhancement of fibroblast collagen synthesis by nitric oxide / Witte M.B., Thornton F.J., Efron D.T., Barbul A. // Nitric Oxide. — 2000. — V. 4, № 6. — P. 572-582.
17. Vasculogenesis and angiogenesis (Lecture I) // 2010. — http://biotka.mol.uj.edu.pl/zbm
18. Gertz K., Endres M. eNOS and stroke: Prevention, treatment and recovery // Future Neurology. — 2008. — V. 3, № 5. — P. 537-550.
19. Eilken H.M., Adams R.H. Dynamics of endothelial cell behavior in sprouting angiogenesis // Curr. Opin. Cell Biol. — 2010. — V. 22, № 5. — P. 617-625.
20. NO mediates mural cell recruitment and vessel morphogenesis in murine melanomas and tissue-engineered blood vessels / Kashiwagi S., Izumi Y., Gohongi T. et al. // Journal of Clinical Investigation. — 2005. — V. 115, № 7. — P. 1816-1827.
21. Nitric Oxide in VEGF-induced Focal Angiogenesis and Matrix Metalloproteinase-9 Activity in the Mouse Brain / Lee C.Z., Xue Z., Hao Q. et al. // Stroke. — 2009. — V. 40, № 8. — P. 2879-2881.
22. Nitric oxide regulates matrix metalloprotease-13 expression and activity in endothelium / Zaragoza C., Balbín M., López-Otín C., Lamas S. // Kidney Int. — 2002. — V. 61, № 3. — P. 804-808.
23. Darland D.C., D'Amore P.A. TGF beta is required for the formation of capillary-like structures in three-dimensional cocultures of 10T1/2 and endothelial cells // Angiogenesis. — 2001. — V. 4, № 1. — P. 11-20.
24. Intercellular adhesion molecule-1 (ICAM-1) regulates endothelial cell motility through a nitric oxide-dependent pathway / Kevil C.G., Orr A.W., Langston W. et al. // J. Biol. Chem. — 2004. — V. 279, № 18. — P. 19230-19238.
25. Caiado F., Dias S. Endothelial progenitor cells and integrins: adhesive needs // Fibrogenesis & Tissue Repair. — 2012. — V. 5, Numb. of publ. 4.
26. Endothelial Progenitor Cells in Sprouting Angiogenesis: Proteases Pave the Way / Laurenzana A., Fibbi G., Margheri F. et al. // Curr. Mol. Med. — 2015. — V. 15, № 7. — P. 606-620.
27. Nitric oxide differentially regulates proliferation and mobilization of endothelial progenitor cells but not of hematopoietic stem cells / Ozüyaman B., Ebner P., Niesler U. et al. // Thromb. Haemost. — 2005. — V. 94, № 4. — P. 770-772.
28. VEGF promotes endothelial progenitor cell differentiation and vascular repair through connexin 43 // Li L., Liu H., Xu C. et al. // Stem. Cell. Research & Therapy. — 2017. — V. 8. Article ID 237.
29. Liu P., Shen W.Q., Chen H.L. Efficacy of arginine-enriched enteral formulas for the healing of pressure ulcers: a systematic review // J. Wound Care. — 2017. — V. 26, № 6. — P. 319-323.
30. The effect of different doses of an arginine-containing supplement on the healing of pressure ulcers / Leigh B., Desneves K., Rafferty J. et al. // J. Wound Care. — 2012. — V. 21, № 3. — P. 150-156.
31. Healing of diabetic foot ulcers in L-arginine-treated patients / Arana V., Paz Y., González A. et al. // Biomed. Pharmacother. — 2004. — V. 58, № 10. — P. 588-597.
32. The effect of oral supplementation with a combination of beta-hydroxy-beta-methylbutyrate, arginine and glutamine on wound healing: a retrospective analysis of diabetic haemodialysis patients / Sipahi S., Gungor O., Gunduz M. et al. // BMC Nephrol. — 2013. — V. 14. — Numb. of publ. 8.

/44-1.jpg)
/45-1.jpg)