Журнал «Травма» Том 18, №2, 2017
Вернуться к номеру
Вплив карбацетаму на когнітивні порушення при експериментальній черепно-мозковій травмі, можлива роль вазопресину
Авторы: Зябліцев С.В, Стародубська О.О., Богза С.Л.
Національний медичний університет ім. О.О. Богомольця, м. Київ, Україна
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
Актуальність. Когнітивні порушення при черепно-мозковій травмі (ЧМТ) є актуальною і не до кінця вивченою проблемою, оскільки ступінь пригнічення функціонування центральної нервової системи характеризує тяжкість ЧМТ і визначає її вихід. Новий фармакологічний засіб карбацетам належить до анксіолітиків, ендогенних модуляторів ГАМК-бензодіазепінового рецепторного комплексу, похідних β-карболіну. Використання модуляторів ГАМКергічної системи за умов ЧМТ може бути перспективним напрямком корекції когнітивних порушень. Мета дослідження. Визначити вплив карбацетаму на когнітивні порушення при експериментальній черепно-мозковій травмі. Матеріали та методи. Дослідження проведено на 45 білих безпородних щурах-самцях; ЧМТ відтворювали за методикою В.М. Єльського, С.В. Зябліцева (2005). Дослідні групи з ЧМТ становили по 15 тварин: 1-ша група — з уведенням карбацетаму (5 мг/кг маси), 2-га група — з уведенням актовегіну (16 мг/кг маси), група порівняння — з уведенням 1 мл фізіологічного розчину, внутрішньочеревно протягом 10 діб після травми. Когнітивні розлади досліджені за методиками: відкрите поле, норковий рефлекс, восьмирукавний лабіринт через 1, 3, 7, 14 та 30 діб після травми. Результати. У групі порівняння протягом спостереження відзначено різке зменшення кількості пересічених квадратів і оглянутих отворів, що вказувало на повну відсутність мотивації, цікавості та когнітивних здібностей внаслідок ЧМТ. Різке збільшення латентного часу переходу щура до темної камери вказувало на дезорієнтованість тварин і неспроможність знайти норку (когнітивні порушення). З усіх показників спонтанно відновлювався тільки норковий рефлекс. Більш скоріша динаміка відновлення когнітивних функцій була відмічена у дослідній 1-й групі, де показники орієнтовно-рухової активності починали відновлювалися через тиждень. Через місяць отримано вірогідне (на 41,0 %) збільшення кількості вдалих заходів до рукавів щодо групи порівняння. Відновлення когнітивних процесів у щурів під впливом актовегіну починалося тільки через два тижня після ЧМТ. Через місяць показники орієнтовно-рухової активності у відкритому полі відновлювалися, але не повністю (кількість пересічених квадратів вірогідно збільшилася, але не досягала рівня до травми; p < 0,05). Кількість оглянутих отворів була вірогідно меншою на 23,3 % щодо дослідної 1-ї групи (p < 0,05), що вказувало на вірогідно менший ефект актовегіну щодо карбацетаму. Під впливом карбацетаму відбувалося відновлення секреції вазопресину, що спричиняє антистресорну дію та, і наш погляд, обумовлює позитивний вплив препарату на когнітивні та мнестичні функції тварин із ЧМТ. Висновки. Отримані дані вказували на вірогідне відновлення когнітивних і мнестичних процесів у щурів під впливом карбацетаму протягом 30 діб спостереження, що могло бути опосередковано відновленням нейросекреції вазопресину.
Актуальность. Когнитивные нарушения при черепно-мозговой травме (ЧМТ) являются актуальной и не до конца изученной проблемой, поскольку степень угнетения центральной нервной системы характеризует тяжесть ЧМТ и определяет ее исход. Новое фармакологическое средство карбацетам относится к анксиолитикам, эндогенным модуляторам ГАМК-бензодиазепинового рецепторного комплекса, производным β-карболина. Использование модуляторов ГАМКэргической системы при ЧМТ может быть перспективным направлением коррекции когнитивных нарушений. Цель исследования. Определить влияние карбацетама на когнитивные нарушения при экспериментальной ЧМТ. Материалы и методы. Исследование проведено на 45 белых беспородных крысах-самцах; ЧМТ воспроизводили по методике В.Н. Ельского, С.В. Зяблицева (2005). Опытные группы с ЧМТ составили по 15 животных: 1-я группа — с введением карбацетама (5 мг/кг массы), 2-я группа — с введением актовегина (16 мг/кг массы), группа сравнения (контроль) — с введением 1 мл физиологического раствора, внутрибрюшинно в течение 10 суток после травмы. Когнитивные расстройства исследованы по методикам: открытого поля, норкового рефлекса, восьмирукавного лабиринта через 1, 3, 7, 14 и 30 суток после травмы. Результаты. В группе сравнения в течение всего периода наблюдения отмечено резкое уменьшение количества пересеченных квадратов и осмотренных отверстий, что указывало на полное отсутствие мотивации, любопытства и когнитивных способностей после ЧМТ. Резкое увеличение латентного времени перехода к темной камере указывало на дезориентацию и невозможность самостоятельно найти норку (когнитивные нарушения). Среди всех показателей спонтанно восстанавливался только норковый рефлекс. Более быстрая динамика возобновления когнитивных функций была отмечена в опытной 1-й группе, где показатели ориентировочно-двигательной активности начинали возобновляться через неделю. Через месяц получено достоверное (на 41,0 %) увеличение количества удачных заходов в рукава по отношению к группе сравнения. Возобновление когнитивных процессов у крыс под действием актовегина начиналось только через две недели после ЧМТ. Через месяц показатели ориентировочно-двигательной активности в открытом поле возобновлялись, но не полностью (количество пересеченных квадратов значимо увеличилось, но не достигало уровня до травмы; p < 0,05). Количество осмотренных отверстий было значимо меньшим на 23,3 % по сравнению с опытной 1-й группой (p < 0,05). Это указывало на меньший эффект актовегина по сравнению с карбацетамом. Под воздействием карбацетама происходило возобновление секреции вазопрессина, что имело антистрессорное действие и, на наш взгляд, обусловливало позитивное влияние препарата на когнитивные и мнестические функции животных с ЧМТ. Выводы. Полученные данные указывали на достоверное возобновление когнитивных и мнестических процессов у крыс с ЧМТ под воздействием карбацетама в течение 30 суток наблюдения, что могло быть опосредствовано восстановлением нейросекреции вазопрессина.
Background. Cognitive disturbances in traumatic brain injury (TBI) are urgent and understudied problem, as the extent of central nervous system suppression characterizes the severity of TBI and defines its outcome. The new pharmacological agent carbacetam belongs to the anxiolytics, endogenous gamma-aminobutyric acid (GABA) benzodiazepine receptor complex modulators, derivatives of β-carboline. The use of GABA system modulators in TBI can be a perspective direction of cognitive disturbances correction. The aim of this work was to define carbacetam influence on cognitive disturbances in experimental TBI. Materials and methods. The research includes 45 white outbred rat males; TBI has been reproduced by V.M. Yelskyi and S.V. Ziablitsev method (2005). Study groups with TBI included 15 animals each: group 1 — carbacetam introduction (5 mg/kg body mass), group 2 — actovegin introduction (16 mg/kg body mass), comparison (control) group — introduction of 1 ml of physiological solution intraperitoneally within 10 days after a trauma. Cognitive disorders are investigated by techniques: open field test, hole-board test, radial arm maze on days 1, 3, 7, 14 and 30 after the trauma. Results. In comparison group during the entire period of observation, a sharp decrease in the quantity of the crossed squares and the examined holes is noted that indicated total absence of motivation, curiosity and cognitive abilities after TBI. The sharp augmentation of latent time of transition to the dark hole indicated a disorientation and impossibility to find a hole independently (cognitive disturbances). From all indicators, only the hole-board test was spontaneously restored. Faster renewal dynamics of cognitive functions was noted in the study group 1, where indicators of an approximate motor performance began renewed in a week. In a month, a significant increase in the number of successful enters in sleeves as compared to the control group is received (by 41.0 %). Renewal of cognitive processes in rats under the actovegin influence began only two weeks after TBI. In a month, indicators of an approximate motor performance in the open field renewed, but not completely (the quantity of the crossed squares was significantly increased, but didn’t reach the initial level (p < 0.05). The quantity of the examined holes was significantly smaller (by 23.3 %) in comparison with the study group 1 (p < 0.05). It indicated a smaller effect of actovegin in comparison with carbacetam. Under the carbacetam influence, there was a vasopressin secretion renewal that had antistress action and, in our opinion, caused positive effect of the drug on cognitive and memory functions of animals with TBI. Conclusions. The obtained data indicated a reliable renewal of cognitive and memory processes in rats with TBI under the carbacetam influence within 30 days of observation that could be mediated by the restoration of vasopressin neurosecretion.
черепно-мозкова травма; карбацетам; когнітивні порушення; вазопресин
черепно-мозговая травма; карбацетам; когнитивные нарушения; вазопрессин
traumatic brain injury; carbacetam; cognitive disturbances; vasopressin
Вступ
Когнітивні порушення при черепно-мозковій травмі (ЧМТ) є актуальною й не до кінця вивченою проблемою, оскільки ступінь пригнічення функціонування центральної нервової системи (ЦНС) характеризує тяжкість ЧМТ і визначає її вихід [5, 8]. У ряді випадків після ЧМТ розвивається посттравматична енцефалопатія, тяжкість якої не завжди залежить від ступеня тяжкості перенесеної ЧМТ — навіть струс мозку може призводити до розвитку атрофічних процесів, наростання неврологічної симптоматики, появи пароксизмальних розладів свідомості [5]. Когнітивні порушення існують у 70–100 % хворих, які перенесли ЧМТ, і посідають важливе місце серед віддалених наслідків травматичного ураження головного мозку. Саме ці розлади в більшості випадків визначають ступінь побутової і соціальної дезадаптації пацієнтів і, зрештою, якість їх життя. Крім того, наявність когнітивних порушень істотно утруднює участь пацієнтів у реабілітаційному процесі, що також негативним чином позначається на його результатах.
У зв’язку з цим доцільним і необхідним є вивчення когнітивних порушень при ЧМТ для розуміння патогенезу цього тяжкого патологічного процесу, що має чималу актуальність, теоретичне та прикладне значення. Отже, актуальним є дослідження структури та вираженості когнітивних розладів і визначення чинників, що впливають на них, у хворих, які перенесли ЧМТ [4–6].
Відомо, що вазопресин стимулює секрецію адренокортикотропного гормону аденогіпофізом, здійснює функцію кортикотропін-рилізинг-фактора або потенціює дію вже існуючого гіпоталамічного кортикотропін-рилізинг-фактора, доведена участь вазопресину в процесах консолідації пам’яті та поліпшенні навчання [5].
У наш час певний вплив фармакологічних препаратів на когнітивні функції після ЧМТ поки не доведений, відповідні рекомендації й опції існують далеко не для всіх препаратів, щодо багатьох засобів є лише окремі вказівки про наявність тих або інших особливостей дії, що залишає широке поле для подальших досліджень [3, 7, 10]. Новий фармакологічний засіб карбацетам належить до анксіолітиків, ендогенних модуляторів ГАМК-бензодіазепінового рецепторного комплексу, похідних β-карболіну [10]. Використання модуляторів ГАМКергічної системи за умов ЧМТ досліджується, визначено їхній вплив на кровообіг мозку, гальмування глутаматної ексайтотоксичності, зменшення вільно-радикального ушкодження, покращення метаболізму та енергозабезпечення нейронів [2, 6, 11]. Низкою досліджень отримані дані щодо протизапальних, протипухлинних та імуномодулюючих ефектів гамма-аміномасляної кислоти (ГАМК) [1, 7, 8] та її ролі в механізмах пам’яті, можливості нейромодуляції при терапії хвороби Альцгеймера [3, 12–14].
Тому метою дослідження стало вивчення механізмів розвитку когнітивних і мнестичних порушень у динаміці ЧМТ та ефективності препаратів ноотропної дії (карбацетаму) для їх корекції.
Матеріали та методи
Дослідження проведено на 45 білих безпородних щурах-самцях, віком 6 місяців, вагою 180–220 г, яких утримували на стандартному раціоні при вільному доступі до їжі та води в умовах віварію. Моделювання ЧМТ проводили у ранкові (з восьмої до десятої) години у спеціально відведеному провітреному приміщенні за температури 18–22 ºС, відносній вологості 40–60 % й освітленості 250 люкс із дотриманням Гельсінської декларації, прийнятої Генеральною асамблеєю Всесвітньої медичної асоціації (2008), загальних норм і принципів Європейської конвенції про захист хребетних тварин, що використовуються для дослідницьких і інших наукових цілей, Першого Національного конгресу з біоетики та законодавства України. Моделювання проводили за методикою В.М. Єльського, С.В. Зябліцева (2005) вантажем, що вільно падає на фіксовану голову тварини, з енергією удару 0,425 кДж [4]. Тваринам 1-ї та 2-ї дослідних груп (у кожній групі n = 15) після моделювання ЧМТ внутрішньочеревно вводили відповідно карбацетам (5 мг/кг маси) та актовегін (16 мг/кг маси) протягом 10 діб після травми [8]. Актовегін був обраний для порівняння з ефектом карбацетаму як препарат, що широко використовується для лікування при ураженні ЦНС (ЧМТ, постінсультні стані, нейроінфекції тощо) [11]. Як групу порівняння (контроль) використано 15 щурів, яким виконували всі маніпуляції, аналогічні до таких у дослідних групах, але замість досліджуваних лікарських засобів уводили 1 мл фізіологічного розчину внутрішньочеревно. Імуноферментним методом у плазмі крові визначений вміст вазопресину (Buhlmann lab. AG, Швеція).
До когнітивних або вищих психічних функцій, згідно з працями засновників вітчизняної нейропсихології Л.С. Виготського, А.Р. Лурія та ін., належать сприйняття, активні рухи та дії, увага, пам’ять, мова, мислення. У тварин аналогом для вивчення когнітивних розладів є тести «відкрите поле» (кількість пересічених квадратів і оглянутих отворів) та «норковий рефлекс» (НР), які дозволяють дати чітку оцінку орієнтовній і руховій активності (ОРА), дослідній діяльності, навику навчання, емоціональності та тривожності тварин. Також було використано експеримент із восьмирукавним лабіринтом (ВЛ), в якому вивчали робочу (тимчасову) і референтну («семантичну», «довготривалу») пам’ять. Вимірювали кількість заходів у рукави з годівницями без повторів (тобто чи пам’ятає щур, який заходив у цей рукав, чи ні, а також навик, що виробляється з часом, обстежувати рукави з виробленої методики запам’ятовування, тобто навчання).
Статистичні розрахунки здійснили в середовищі прикладних програм Statistica 10 (StatSoft, Inc, США).
Результати та обговорення
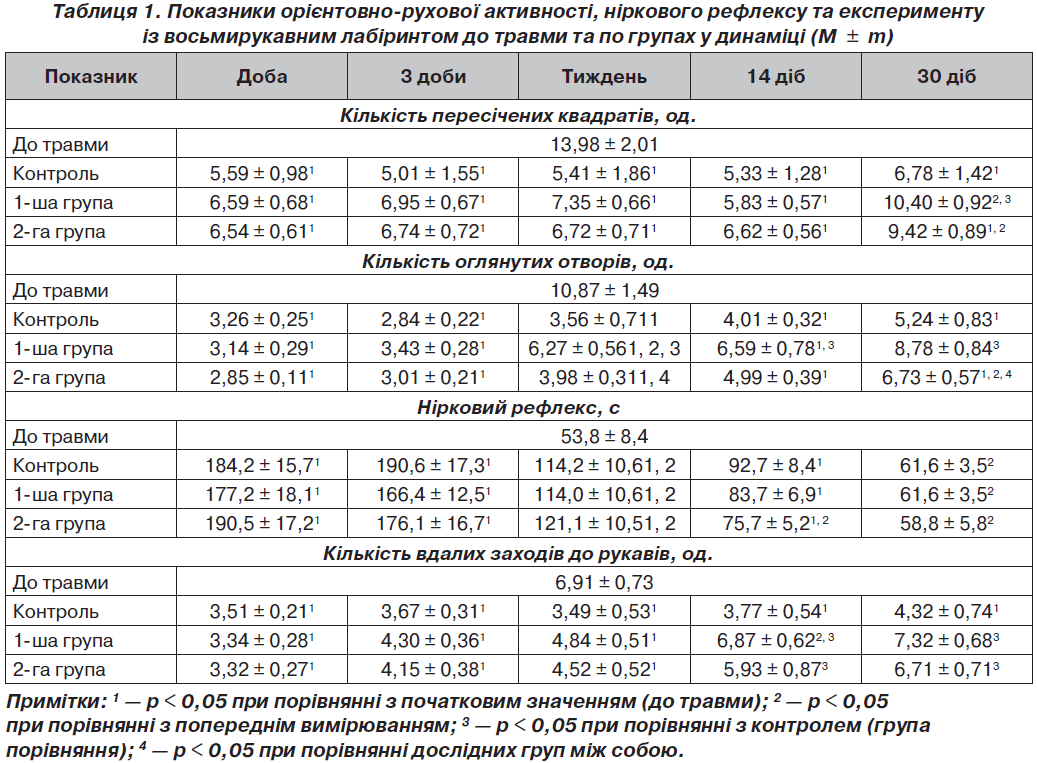
При аналізі ОРА, НР і ВЛ у тварин групи порівняння спостерігалися значні зміни показників після нанесення травми в динаміці та стосовно відповідних показників до травми (табл. 1).
Різке зменшення кількості пересічених квадратів і оглянутих отворів вказувало на повну відсутність мотивації, цікавості та когнітивних здібностей у щурів групи порівняння після нанесення ЧМТ. Також спостерігалося різке збільшення латентного часу переходу щура до темної камери. Це вказувало на дезорієнтованість тварин і неспроможність знайти норку (когнітивні порушення). Кількість вдалих заходів до рукавів із годівницями також різко зменшилася. Такі низькі показники вказували не тільки на виражені мнестичні порушення, але й на випадковість заходу тварин до рукавів.
У групі порівняння на 3-тю добу спостерігалася відсутність відновлення когнітивних навичок. Тварини продовжували перебувати у дезорієнтованому стані та були неспроможні знайти норку (когнітивні порушення); спостерігалися виражені мнестичні порушення.
Початок відновлення орієнтованості тварин і спроможності знайти норку (відновлення когнітивних функцій) у групі порівняння спостерігали лише через тиждень після ЧМТ. Через два тижні було перевищено рівень випадковості заходу до рукавів, проте кількість заходів була меншою на 45,4 % щодо початкового рівня (p < 0,05). Такі дані вказували на тенденцію до відновлення когнітивних процесів у щурів, проте низькі показники вказувати на тривалість виражених мнестичних порушень при ЧМТ.
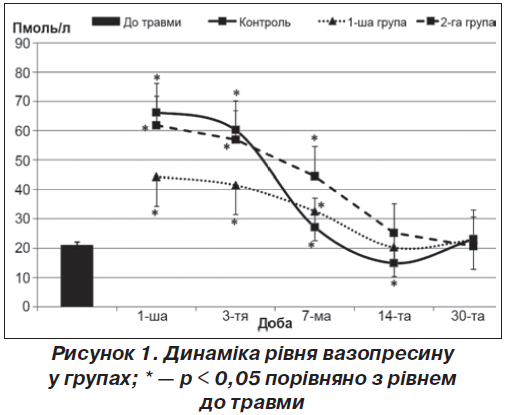
Через місяць у групі порівняння показники ОРА щурів у відкритому полі продовжували відновлюватися. Майже відновився показник норкового рефлексу. Така повільна динаміка відновлювання когнітивних функцій у групі порівняння може бути пояснена виснаженням синтезу та утилізації вазопресину у цей період (рис. 1), що було висвітлено нами у попередніх дослідженнях [5].
На першу добу після нанесення ЧМТ вірогідних різниць у когнітивних порушеннях між групами порівняння та дослідною 1-ю групою не спостерігалося (табл. 1). Це пояснюється тим, що на перший план у початковому періоді ЧМТ виходить неврологічний дефіцит [4, 5]. Проте рівень вазопресину у дослідній 1-й групі через добу був нижчим у 1,5 раза (p < 0,05) до групи порівняння, що вказує на гальмування первинної післятравматичної активації нейросекреції під впливом карбацетаму. На третю добу у дослідній 1-й групі спостерігали відсутність позитивної динаміки щодо відновлення когнітивних і мнестичних навичок.
Через тиждень після ЧМТ у дослідній 1-й групі показники ОРА щурів у відкритому полі продовжували змінюватися та були більшими за показники групи порівняння (за кількістю оглянутих отворів і норковим рефлексом). Це вказувало на вірогідний позитивний ефект карбацетаму, який почав проявлятися відновленням когнітивних функцій на сьому добу експерименту. Спостерігалося вірогідне (p < 0,05) зменшення латентного часу переходу до темної камери щодо попереднього вимірювання, що вказувало на початок відновлення орієнтованості тварин і спроможності знайти норку (відновлення когнітивних функцій). Позитивна динаміка виявлялася й на 14-ту добу. При порівняння отриманих даних із рівнем вазопресину у крові щурів можна говорити про відновлення центральних взаємозв’язків і нейросекреції в гіпоталамусі та гіпофізі під впливом карбацетаму.
Через місяць у дослідній 1-й групі показники ОРА щурів у відкритому полі продовжували відновлюватися, що вказувало на вірогідний позитивний вплив карбацетаму на зацікавленість щурами отворами, відновлення когнітивних процесів. Отримано вірогідне (на 41,0 %) збільшення кількості вдалих заходів до рукавів по відношенню до групи порівняння. Такі дані вказували на вірогідне відновлення когнітивних і мнестичних процесів у щурів під впливом карбацетаму на 30-тудобу експерименту.
Отримані дані збігаються з тим, що карбацетам на перший тиждень спостереження після ЧМТ запобігав гіперактивації центральної ланки нейро-гормональних систем, а через два тижні та пізніше — відновлював секрецію й запобігав їх виснаженню [5], що створювало умови для позитивної дії гормона на когнітивні функції.
На першу добу після нанесення ЧМТ вірогідних різниць у когнітивних порушеннях між групами порівняння та дослідною 2-ю групою не спостерігалося (табл. 1). Рівень вазопресину на цей період спостереження вказував на збереження післятравматичної гіперактивації нейросекреції, що було притаманне групі порівняння (без застосування фармакологічної корекції).
На третю добу експерименту у дослідній 2-й групі спостерігали відсутність відновлення когнітивних навичок і продовження дезорієнтованості тварин і неспроможність знайти норку (когнітивні порушення). Також спостерігалися виражені мнестичні порушення. Через тиждень після ЧМТ у дослідній 2-й групі спостерігали вірогідно менший ефект актовегіну щодо карбацетаму за показником кількості оглянутих отворів (p < 0,05), тобто на сьому добу експерименту у дослідній 2-й групі ще не почали виявлятися відновлення когнітивних функцій на відміну від дослідної 1-ї групи.
Через два тижні у дослідній 2-й групі показники ОРА щурів у відкритому полі мали позитивну динаміку, але вказували на вірогідно менший вплив актовегіну, ніж карбацетаму, щодо відновлення ОРА. Кількість вдалих заходів до рукавів із годівницями мала вірогідну (p < 0,05) тенденцію до збільшення порівняно з попереднім рівнем, проте ще залишалася на рівні випадковості. Такі дані вказували на початок відновлення когнітивних процесів у щурів під впливом актовегіну через два тижня після ЧМТ, однак такі низькі показники вказували на наявність виражених мнестичних порушень.
Через місяць після ЧМТ у дослідній 2-й групі показники ОРА щурів у відкритому полі почали відновлюватися, але не повністю. Так, кількість пересічених квадратів вірогідно збільшилася, але не досягала рівня до травми (p < 0,05). Кількість оглянутих отворів була вірогідно меншою на 23,3 % щодо дослідної 1-ї групи (p < 0,05). Це вказувало на вірогідно менший ефект актовегіну щодо карбацетаму на ОРА щурів. Не було отримано вірогідної розбіжності кількості вдалих заходів до рукавів стосовно дослідної 1-ї групи, що вказувало на позитивну динаміку когнітивних функцій при дії актовегіну.
Висновки
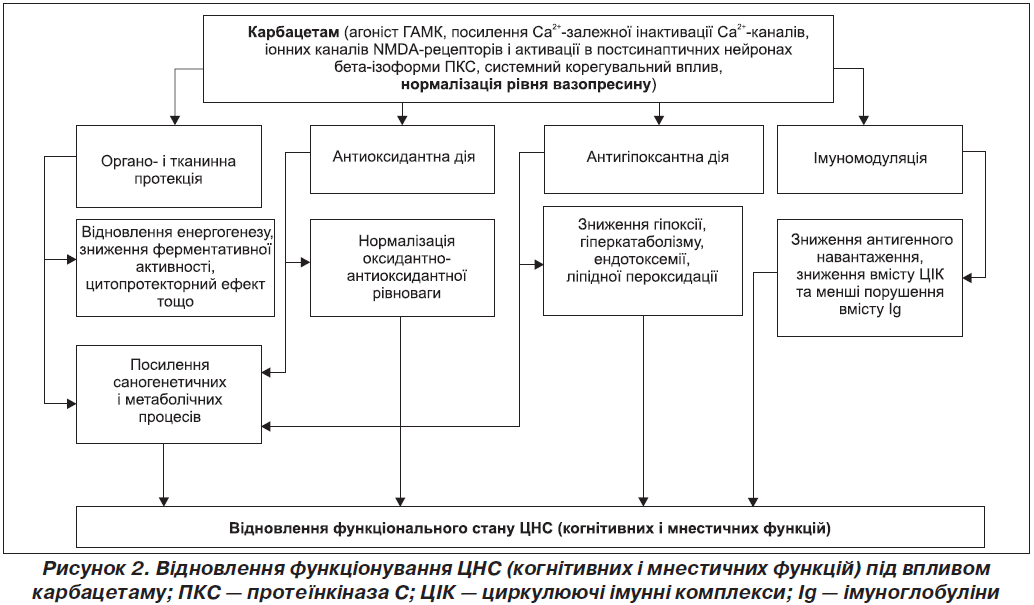
Слід зазначити, що відновлення секреції вазопресину під впливом карбацетаму чинить антистресорну дію та позитивний вплив на когнітивні й мнестичні функції тварин [5]. Патогенетичні схеми розвитку когнітивних і мнестичних порушень та можливі ланки впливу карбацетаму на них ми продемонстрували у вигляді схеми (рис. 2).
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів при підготовці даної статті.
1. Биорегуляция иммунного воспаления у людей пожилого возраста через систему гамма-аминомасляной кислоты на примере остеоартроза / Електронний ресурс / А.П. Патрухин, В.В. Кирьянова, К.И. Прощаев, В.И. Бессарабов // Современные проблемы науки и образования. — 2014. — № 6. — Режим доступу: http://cyberleninka.ru/article/n/bioregulyatsiya-immunnogo-vospaleniya-u-lyudey-pozhilogo-vozrasta-cherez-sistemu-gamma-aminomaslyanoy-kisloty-na-primere-osteoartroza
2. Влияние фенибута и его соли с янтарной кислотой на устойчивость животных к форсированным динамическим и статическим физическим нагрузкам / В.В. Багметова, А.Н. Кривицкая, И.Н. Тюренков та ін. // Фундаментальные исследования. — 2012. — № 4. — С. 243-246.
3. Демченко О.М. Когнітивна активність щурів за умов дисфункції щитоподібної залози / О.М. Демченко // Вісник проблем біології і медицини. — 2014. — Т. 3(109), Вип. 2. — С. 127-132.
4. Ельский В.Н. Моделирование черепно-мозговой травмы / В.Н. Ельский, С.В. Зяблицев. — Донецк: Новый мир, 2008. — 140 с.
5. Ельский В.Н. Нейрогормональные регуляторные механизмы при черепно-мозговой травме / В.Н. Ельский, С.В. Зяблицев. — Донецк: Новый мир, 2008. — 240 с.
6. Зяблицев С.В. Патогенез оксидативных нарушений при сочетанной черепно-мозговой травме и турникетной токсемии в эксперименте / С.В. Зяблицев, А.В. Нечепорчук, Ю.Я. Крюк, С.В. Колесникова // Вестник Казахского национального медицинского университета. — 2013. — № 5(1). — С. 116-119.
7. Карташев А.В. Тормозные нейромедиаторы и их влияние на опухолевый процесс при глиомах головного мозга / A.B. Карташев, В.Б. Войтенков // Сибирский онкологический журнал. — 2013. — № 4(58). — С. 70-74.
8. Козак Д.В. Системні порушення в патогенезі раннього і пізнього періодів травматичної хвороби та їх корекція: автореф. дис... д-ра мед. наук: 14.03.04 — патологічна фізіологія / Д.В. Козак; Тернопільський державний медичний університет ім. І.Я. Горбачевського МОЗ України. — Тернопіль, 2015. — 36 с.
9. Коровка С.Я. Механізми формування синдрому ендогенної інтоксикації при травматичній хворобі головного мозку: дис... канд. мед. наук: 14.03.04 — патологічна фізіологія / С.Я. Коровка; Донецький національний медичний університет ім. М. Горького МОЗ України. — Донецьк, 2013. — 201 c.
10. Психиатрия: национальное руководство / под ред. Т.Б. Дмитриевой, В.Н. Краснова, Н.Г. Незнанова, В.Я. Семке, А.С. Тиганова. — М.: ГЭОТАР-Медиа, 2011. — 1000 с.
11. Эндотелиопротекторы — новый класс фармакологических препаратов [Электронный ресурс] / И.Н. Тюренков, А.В. Воронков, А.А. Слиецанс, Е.В. Волотова // Вестник РАМН. — 2012. — Т. 67, № 7. — Режим доступа: http://cyberleninka.ru/article/n/endotelioprotektory-novyy-klass-farmakologicheskih-preparatov
12. Li Y. Implications of GABAergic Neurotransmission in Alzheimer's Disease / Y. Li, H. Sun, Zh. Chen, H. Xu, G. Bu, & H. Zheng // Front. Aging. Neurosci. — 2016. — Режим доступу: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4763334/
13. Jo S. GABA from reactive astrocytes impairs memory in mouse models of Alzheimer's disease / S. Jo, O. Yarishkin, Y.J. Hwang // Nat. Med. — 2014. — Vol. 20(8). — P. 886-896.
14. McQuail J.A. Molecular aspects of age-related cognitive decline: the role of GABA signaling / J.A. McQuail, C.J. Frazier, J.L. Bizon // Trends Mol. Med. — 2015. — Vol. 21(7). — P. 450-460.