Журнал «Травма» Том 18, №1, 2017
Вернуться к номеру
Сосудисто-реологические свойства крови при анкилозирующем спондилите
Авторы: Егудина Е.Д.(1), Синяченко О.В.(2), Ермолаева М.В.(2),Чернышова О.Е.(2), Полесова Т.Р.(2), Ханюков А.А.(1)
(1) — ГУ «Днепропетровская медицинская академия», г. Днепр, Украина
(2) — Донецкий национальный медицинский университет, г. Лиман, Украина
Версия для печати
Актуальність. Анкілозуючий спондиліт є чинником ризику тяжкої васкулярної патології, для якої характерне порушення ендотеліальної функції судин, але клініко-патогенетична роль цих змін залишається вивченою недостатньо. Мета дослідження: оцінити характер ендотеліальної дисфункції судин та адсорбційно-реологічних властивостей крові у хворих на анкілозуючий спондиліт, визначити її особливості за наявності ангіопатії, встановити зв’язок із клініко-інструментальними показниками судинної патології й станом імунітету. Матеріали та методи. Під спостереженням перебували 79 хворих віком від 15 до 66 років (у середньому 38 років), серед яких було 95 % чоловіків і 5 % жінок. Тривалість хвороби від перших її проявів становила 11 років, І ступінь активності мав місце в 32 % спостережень, ІІ — в 39 % і ІІІ — в 29 %, а співвідношення повільно прогресуючого до швидко прогресуючого перебігу патологічного процесу становило 4 : 1.
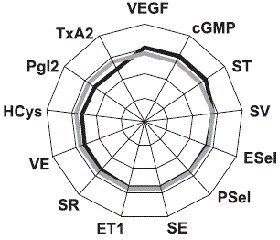
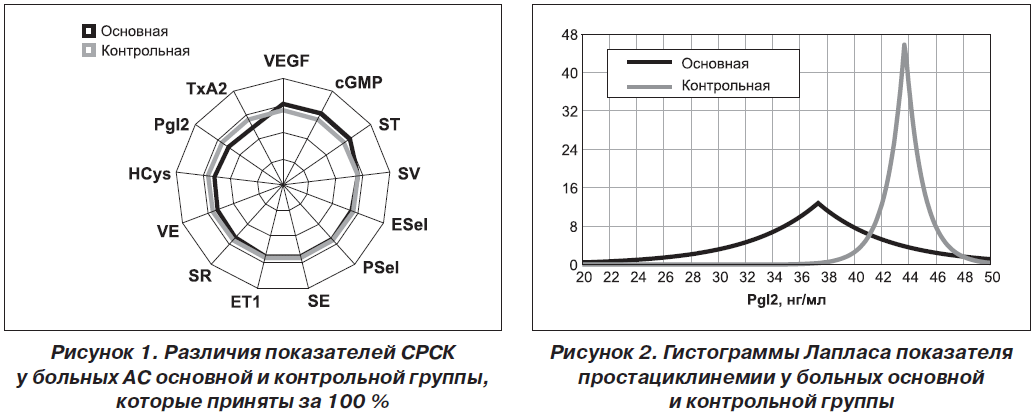
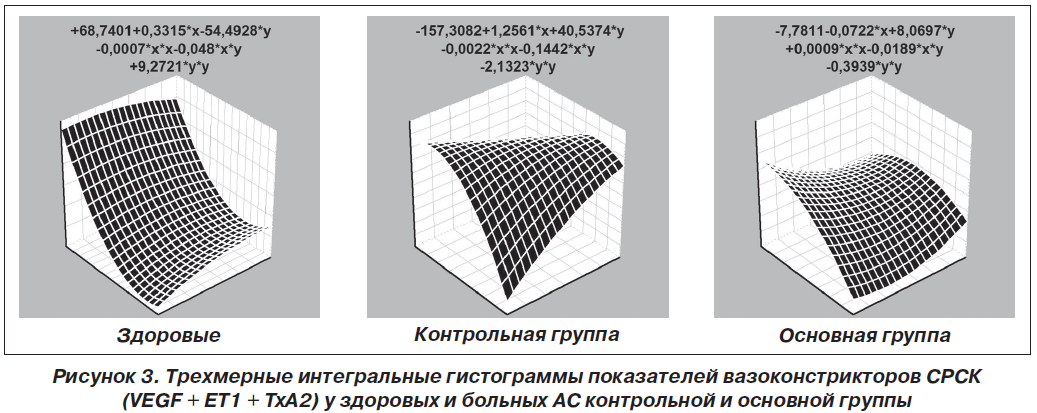
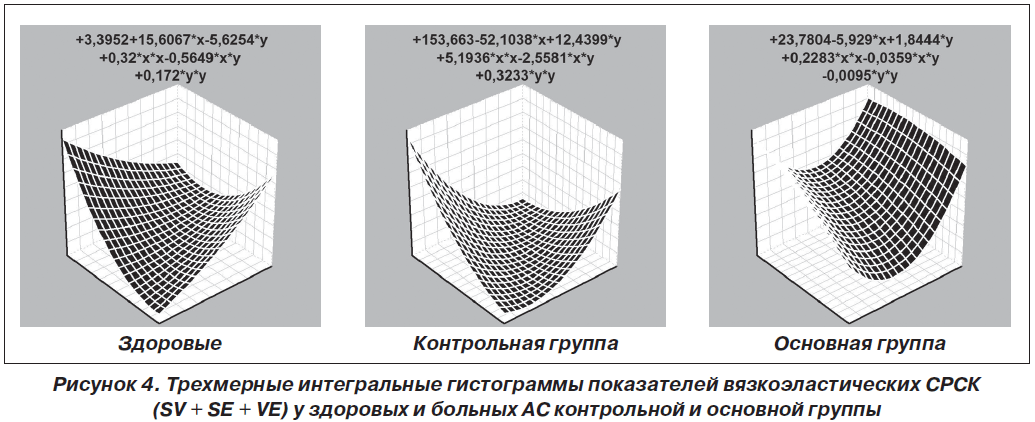
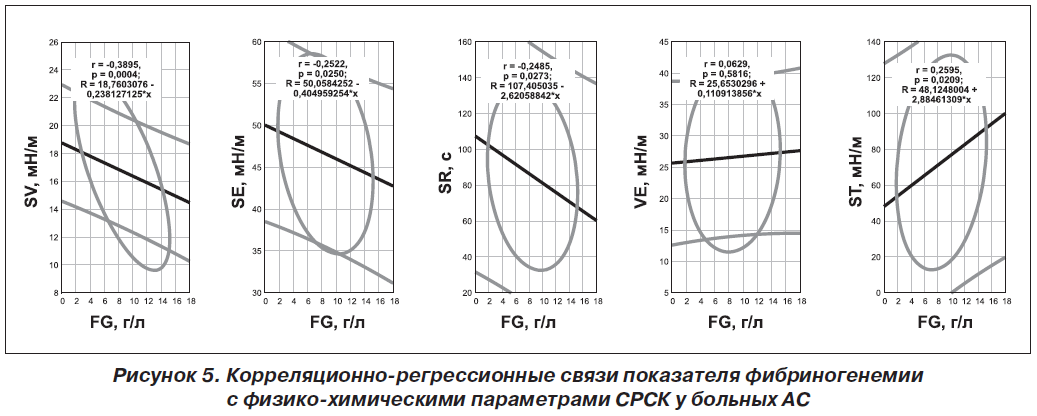
Периферичний моноолігоартрит констатовано у 47 % хворих, поліартрит — у 53 %. Імуноферментним методом вивчали в сироватці крові рівні ендотеліального фактору зростання, ендотеліну-1, тромбоксану-А2, гомоцистеїну, простацикліну, циклічного гуанозинмонофосфату, Е- і P- селектину, а методом міжфазної тензіореометрії визначали поверхневі параметри в’язкості, пружності, натягу, релаксації й модуля в’язкоеластичності. Результати. Ендотеліальна дисфункція судин розвивається у кожного другого хворого на анкілозуючий спондиліт і за наявності клініко-інструментальної судинної патології супроводжується зростанням в крові концентрації циклічного гуанозинмонофосфату і ще більшим зменшенням параметрів простациклінемії. Ступінь вираженості порушень ендотеліальної функції судин у таких хворих пов’язаний із тривалістю захворювання, активністю патологічного процесу, ураженням периферичної нервової системи, вираженістю спондилопатії й сакроілеїту, при цьому існують кореляційні зв’язки між окремими імунними показниками та судинно-реологічними властивостями крові. Останні при анкілозуючому спондиліті беруть участь у патогенетичних побудовах ентезопатій, тендовагінітів, увеїту і склериту, визначають темпи прогресування суглобового синдрому та інтегральну тяжкість ангіопатії, а вміст циклічного гуанозинмонофосфату в крові має прогностичну значущість.
Актуальность. Анкилозирующий спондилит является фактором риска тяжелой васкулярной патологии, для которой характерно нарушение эндотелиальной функции сосудов, но клинико-патогенетическая роль этих изменений остается изученной недостаточно. Цель исследования: оценить характер эндотелиальной дисфункции сосудов и адсорбционно-реологических свойств крови у больных анкилозирующим спондилитом, определить ее особенности при наличии ангиопатии, установить связь с клинико-инструментальными показателями сосудистой патологии и состоянием иммунитета. Материалы и методы. Под наблюдением находились 79 больных в возрасте от 15 до 66 лет (в среднем 38 лет), среди которых было 95 % мужчин и 5 % женщин. Продолжительность болезни от первых ее проявлений составила 11 лет, І степень активности имела место в 32 % наблюдений, ІІ — в 39 % и ІІІ — в 29 %, а соотношение медленно прогрессирующего и быстро прогрессирующего течения патологического процесса составило 4 : 1. Периферический моноолигоартрит констатирован у 47 % от числа больных, полиартрит — у 53 %. Иммуноферментным методом изучали в сыворотке крови уровни эндотелиального фактора роста, эндотелина-1, тромбоксана-А2, гомоцистеина, простациклина, циклического гуанозинмонофосфата, Е- и P-селектина, а методом межфазной тензиореометрии определяли поверхностные параметры вязкости, упругости, натяжения, релаксации и модуля вязкоэластичности. Результаты. Эндотелиальная дисфункция сосудов развивается у каждого второго больного анкилозирующим спондилитом и при наличии клинико-инструментальной сосудистой патологии сопровождается нарастанием в крови концентрации циклического гуанозинмонофосфата и еще большим уменьшением параметров простациклинемии. Степень выраженности нарушений эндотелиальной функции сосудов у таких больных связана с длительностью заболевания, активностью патологического процесса, поражением периферической нервной системы, выраженностью спондилопатии и сакроилеита, при этом существуют корреляционные связи между отдельными иммунными показателями и сосудисто-реологическими свойствами крови. Последние при анкилозирующем спондилите участвуют в патогенетических построениях энтезопатий, тендовагинитов, увеита и склерита, определяют темпы прогрессирования суставного синдрома и интегральную тяжесть ангиопатии, а содержание циклического гуанозинмонофосфата в крови имеет прогностическую значимость.
Background. Ankylosing spondylitis is a risk factor for severe vascular disease, which is characterized by a violation of vascular endothelial function, but clinical and pathogenetic role of these changes is not sufficiently studied. The purpose and objectives of the study: to evaluate the nature of endothelial dysfunction and vascular adsorption-rheological properties of the blood in patients with ankylosing spondylitis, to determine its characteristics in the presence of angiopathy, to establish correlation with the cli-nical and instrumental parameters of vascular disease and the state of immunity. Materials and methods. The study included 79 patients aged 15 to 66 years (mean 38 years), among whom there were 95 % of men and 5 % of women. The duration of the disease from its first manifestations was 11 years, I degree of activity occurred in 32 % of cases, II — in 39 % and III — in 29 %, and the ratio of slow progressive and rapidly progressive course of the pathological process was 4 : 1. Peripheral monooligoarthritis was detected in 47 % of patients, polyarthritis — in 53 %. Levels of vascular endothelial growth factor, endothelin-1, thromboxane A2, homocysteine, prostacyclin, cyclic guanosine monophosphate, E- and P-selectin were examined by immune-enzyme analysis in the blood serum, and surface parameters of viscosity, elasticity, tension, relaxation and modulus of viscoelasticity — by the method of interphase tensiometry. Results. Endothelial vascular dysfunction occurs in every second patient with ankylosing spondylitis, which in the presence of clinical and instrumental vascular pathology is accompanied by an increase in serum concentration of cyclic guanosine monophosphate and even greater reduction in prostacyclinemia parameters. The severity of disorders of vascular endothelial function in these patients is associated with disease duration, activity of the pathological process, the defeat of the peripheral nervous system, the severity of spondylopathies and sacroiliitis, at the same time there are correlations between certain immune parameters and vascular-rheological properties of the blood. The latest in ankylosing spondylitis are involved in the pathogenesis constructions of enthesopathies, tendovaginitis, uveitis and scleritis, determine the rate of progression of articular syndrome and integrated severity of angiopathy, and the content of cyclic guanosine monophosphate in the blood has prognostic significance.
спондиліт анкілозуючий; судини; кров; ендотелій; реологія
спондилит анкилозирующий; сосуды; кровь; эндотелий; реология
ankylosing spondylitis; vessels; blood; endothelium; rheology