Журнал «Травма» Том 14, №2, 2013
Вернуться к номеру
Поширеність мутації промотора гена eNOS Т786С у хворих із хибними суглобами довгих кісток: зв’язок із рівнем гомоцистеїну та медіаторами запалення
Авторы: Безсмертний Ю.О., НДІ реабілітації інвалідів Вінницького національного медичного університету ім. М.І. Пирогова
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
У статті подані порівняльні результати поширеності мутації промотора гена eNOS Т786С у 130 хворих із хибними суглобами довгих кісток та в осіб із консолідованими переломами. Встановлено, що частота зустрічаємості С-алелі серед хворих із хибними суглобами була в 1,35 раза вищою, ніж серед осіб із консолідованими переломами. Мутація промотора гена eNOS Т786С асоціювалась із розвитком гіпопластичних та апластичних типів хибних суглобів, збільшенням частки осіб із гіпергомоцистеїнемією, підвищеним вмістом медіаторів запалення та розвитком нейродистрофічного синдрому і рефрактур.
В статье представлены сравнительные результаты распространенности мутации промотора гена eNOS Т786С у 130 больных с ложными суставами длинных костей и у лиц с консолидированными переломами. Установлено, что частота встречаемости С-аллели среди больных с ложными суставами была в 1,35 раза выше, чем у лиц с консолидированными переломами. Мутация промотора гена eNOS Т786С ассоциировалась с развитием гипопластических и апластических типов ложных суставов, увеличением доли лиц с гипергомоцистеинемией, повышенным содержанием медиаторов воспаления, развитием нейродистрофического синдрома и рефрактур.
The paper presents the comparative results of the prevalence of eNOS gene promoter mutation T786C in 130 patients with false joints of long bones and in those with consolidated fractures. It is found that the frequency of occurrence of the C-allele in patients with false joints was 1.35 times higher than for people with consolidated fractures. ENOS gene promoter mutation T786C was associated with the development of hypoplastic and aplastic types of false joints, increase in the proportion of persons with hyperhomocysteinemia, elevated inflammatory mediators, development of neurodystrophic syndrome and refractures.
мутація eNOS Т786С, хибний суглоб, гіпергомоцистеїнемія, медіатори запалення.
мутация eNOS Т786С, ложный сустав, гипергомоцистеинемия, медиаторы воспаления.
eNOS T786C mutation, false joint, hyperhomocysteinemia, inflammatory mediators.
Порушення репаративної регенерації кісток залишаються однією з невирішених проблем як у медичному, так і в соціальноекономічному аспекті, оскільки посідають чільне місце серед причин тимчасової та стійкої непрацездатності населення [5]. З огляду на факт прогресуючого зростання техногенності травми, збільшення частоти множинних та комбінованих пошкоджень кісток з’ясування інтимних механізмів порушень репаративного остеогенезу та оптимізація методів профілактики та лікування незрощень довгих кісток і хибних суглобів є проблемою, яка потребує термінового вирішення.
Відомо, що перебіг репаративного остеогенезу залежить від локального кровообігу в зоні ушкодження [5], що певною мірою детермінується станом периферійних судин до моменту травми. В останні роки з’явились переконливі докази, що порушення ендотеліальної секреції вазоактивного медіатора оксиду азоту впливає на кісткову тканину [3, 4, 6] і асоціюється з порушенням структурнофункціонального стану кісткової тканини, розвитком остеопорозу та остеопоротичних переломів [9, 10]. В окремих експериментальних роботах висвітлено важливу роль NO в реалізації патогенетичних механізмів негативного впливу гомоцистеїну (ГЦ) на кістку. Так, за умов інгібування синтази оксиду азоту вірогідно потенціювався остеотоксичний ефект гіпергомоцистеїнемії (ГГЦ) [3] і пригнічувалась диференціація кісткоутворюючих клітин [11]. Тому постає питання й щодо ролі порушень судинної продукції оксиду азоту в процесах репаративного остеогенезу та формування хибних суглобів.
Одним із визнаних генетичних чинників, що суттєво порушує ендотеліальний синтез NO, є поліморфізм промотора гена eNOS Т786С [8]. Зниження здатності судинної стінки до продукції оксиду азоту, як відомо, пов’язане з включенням вазоконстрикторних механізмів, ішемією та тромбозами. Гіпотетично поліморфізм гена eNOS Т786С може виявитись фактором, що впливає на перебіг репаративного остеогенезу, однак досліджень у даному напрямку раніше не проводилось.
Мета роботи: вивчити поширеність поліморфізму промотора гена eNOS Т786С в осіб із консолідованими переломами та хибними суглобами довгих кісток та оцінити його зв’язок із клінікорентгенологічними типами хибних суглобів, наявністю ускладнень, гіпергомоцистеїнемією та запальним синдромом.
Матеріал та методи
До групи спостереження увійшли 118 (20,13 %) із 586 обстежених хворих із хибними суглобами довгих кісток на рівні діафізу, які не мали встановлених об’єктивних та ятрогенних чинників порушень репаративного остеогенезу. Середній вік становив 39,34 ± 11,01 року. Осіб чоловічої статі було 91 (77,12 %), жіночої — 27 (22,88 %). Тривалість захворювання від 11 до 126 міс. За клінікорентгенологічною характеристикою хибного суглоба нормопластичний тип діагностовано у 24 (20,34 %), гіперпластичний — у 21 (17,8 %), гіпопластичний — у 36 (30,5 %), атрофічний — у 37 (31,36 %) хворих. Рефрактури та нейродистрофічний синдром відмічались у 24 (20,34 %) та 39 (33,05 %) осіб відповідно. До групи контролю увійшли 48 хворих із консолідованими діафізарними переломами, порівнянні з групою хворих із хибними суглобами за віком, статтю, локалізацією ушкодження, частотою супутньої патології.
Забір крові для молекулярногенетичних досліджень здійснювали в стандартних умовах — з 8:00 до 9:00, натще, після нічного голодування, з ліктьової вени за допомогою вакутейнерів у пробірки Vacuette (Greiner BioOne, Австрія) з 3,8% розчином цитрату натрію (у співвідношенні 9 : 1) та без антикоагулянтів. Уміст загального ГЦ, медіаторів запалення Среактивного білка (СРБ) та інтерлейкіну6 (ІЛ6) визначали імуноферментним методом за наборами Homocysteine EIA (AxisShield, Англія), hsCRP ELISA (DRG, США) та IL6 ELISA (Diaclone, Франція) відповідно до інструкції фірмивиробника на аналізаторі STAT FAX 303/PLUS. При ранжируванні рівнів ГЦ користувались критеріями D.W. Jacobsen (1998) та референтними інтервалами, розробленими [1] для вітчизняної популяції здорових дорослих осіб. Ранжирування рівнів Среактивного білка та інтерлейкіну6 проводили згідно з вітчизняними критеріями та референтними інтервалами, розробленими І.І. Андрушко [2].
Для генетичних досліджень відбирали проби цільної крові, стабілізованої цитратом натрію, які до тестування зберігали при температурі –20 °С. Генотипування проводилось методом полімеразної ланцюгової реакції (ПЛР) із наступним рестрикційним аналізом продуктів ПЛР. Вивчалась мутація гена ендотеліальної синтази нітрогену монооксиду (NOS 3 Т786С).
Статистичний аналіз матеріалу проводився за допомогою стандартних методів із застосуванням пакету прикладних програм MS Excel XP та Statistica SPSS 10.0 for Windows (ліцензійний номер 305147890).
Результати і їх обговорення
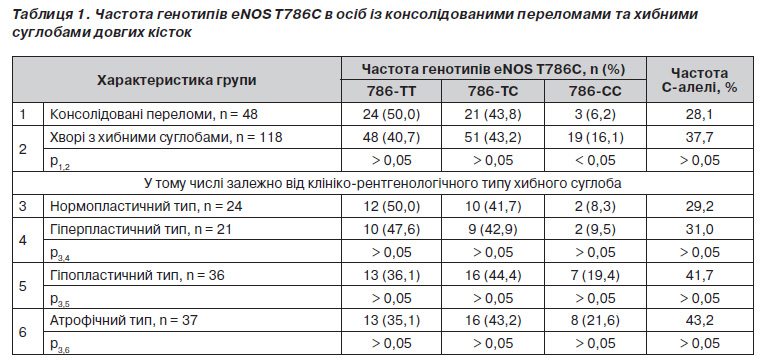
При досліджені поліморфізму промотора гена eNOS Т786С було встановлено, що серед осіб із консолідованими переломами співвідношення нормальних гомозигот (786ТТ), гетерозигот (786ТС) та гомозигот із патологічним генотипом 786СС становило 50,0, 43,8 та 6,2 % відповідно (табл. 1). Розподіл частот генотипів ТТ/ТС/СС у групі осіб із консолідованими переломами відповідав рівновазі Харді — Вайнберга і узгоджувався з даними щодо поширеності поліморфізму гена eNOS Т786С серед практично здорових осіб в українській популяції [7]. Розподіл частот зустрічальності вказаних генотипів у групі хворих із хибними суглобами також підкорявся закону Харді — Вайнберга, однак відрізнявся від такого в групі порівняння. Серед хворих із хибними суглобами спостерігалась тенденція до зменшення частки нормальних гомозигот 786ТТ і вірогідно у 2,6 раза збільшувалась частка гомозигот 786СС. Відповідно частота зустрічальності Салелі серед хворих із хибними суглобами була вищою, ніж серед осіб із консолідованими переломами, і становила 37,7 % проти 28,1 %.
Типологічний аналіз показав, що серед хворих із нормопластичним типом поширеність Салелі промотора eNOS та співвідношення генотипів ТТ/ТС/СС узгоджувались із такими в групі хворих із консолідованими переломами (50,0, 41,7 та 8,3 %). У групі осіб із гіперпластичним типом спостерігалось незначне зменшення частоти генотипу 786ТТ та збільшення частоти генотипу 786СС. У той же час серед хворих із гіпопластичним та атрофічним типом частка нормальних гомозигот 786ТТ була меншою (в 1,4 раза), ніж серед хворих із нормопластичним типом, натомість частіше виявлялись гетерозиготи 786ТС, а частка патологічних гомозигот 786СС зростала в 2,3 та 2,6 раза відповідно. Частота Салелі при авітальних типах хибних суглобів сягала 41,7–43,2 % порівняно з 29–31 % при вітальних типах.
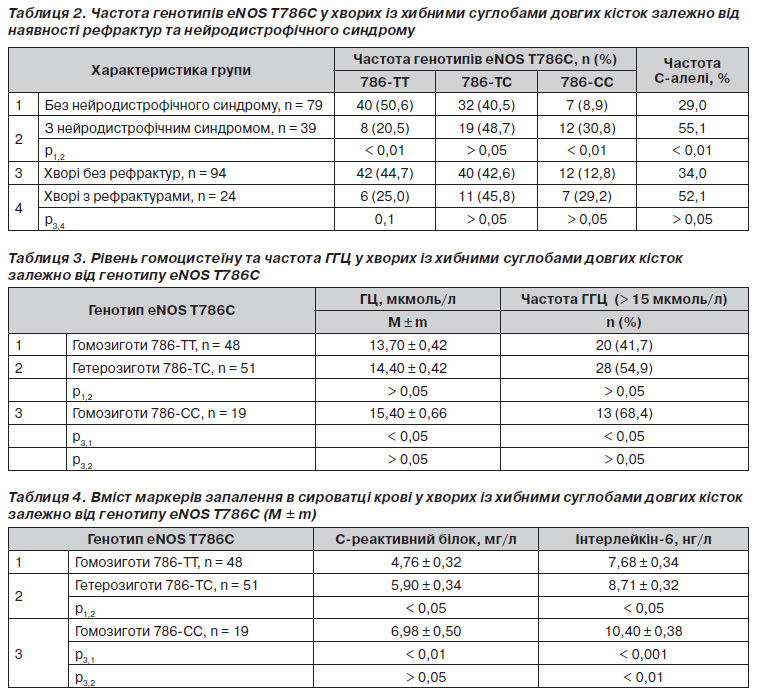
Аналіз частот генотипів eNOS Т786С залежно від наявності нейротрофічного синдрому та рефрактур виявив суттєві відмінності між групами (табл. 2). Так, серед хворих із нейродистрофічним синдромом частота зустрічальності генотипу 786ТТ була вірогідно меншою (у 2,5 раза), а патологічного генотипу 786СС, навпаки, більшою (у 3,5 раза), ніж серед хворих без нейродистрофічного синдрому. Частота патологічної Салелі в групі хворих із нейродистрофічним синдромом становила 55,1 % проти 29,0 % у групі хворих без цього ускладнення. Аналогічні за спрямованістю, хоча і менш виражені, тенденції виявились при аналізі частот генотипів eNOS Т786С у хворих із рефрактурами та без них. Зокрема, серед хворих без рефрактур частка нормальних гомозигот ТТ була вищою (в 1,8 раза), а частка патологічних гомозигот СС, навпаки, нижчою (у 2,3 раза), ніж серед хворих із рефрактурами.
Виявилось, що середній рівень ГЦ у патологічних гомозигот 786СС вірогідно вищий (на 12,4 %), ніж у нормальних гомозигот 786ТТ (табл. 3). Серед носіїв генотипу 786СС також вірогідно частіше виявлялись хворі з ГГЦ, ніж серед носіїв генотипів 786ТТ та 786ТС.
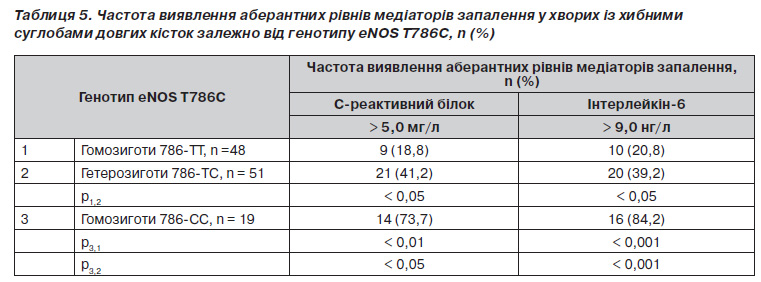
Встановлено, що у хворих із хибними суглобами гетеро і особливо гомозиготне носійство Салелі супроводжувалось вірогідним збільшенням умісту прозапальних медіаторів у сироватці крові (табл. 4). Так, у гетерозигот 786ТС і гомозигот 786СС рівень СРБ вірогідно перевищував такий у нормальних гомозигот ТТ на 23,9 та 46,6 %, а рівень інтерлейкіну6 — на 13,4 та 35,4 % відповідно. Виявлені відмінності пояснюються більш високою частотою зустрічальності аберантних рівнів медіаторів запалення у хворих із хибними суглобами — носіїв патологічної Салелі промотора гена eNOS (табл. 5).
Отже, за поширеністю поліморфізму промотора гена eNOS Т786С хворі з хибними суглобами відрізняються від осіб із консолідованими переломами: спостерігається зростання частоти зустрічальності патологічної Салелі, вірогідно зростає частота генотипу СС і знижується частота нормального генотипу ТТ. Гомозиготи СС концентруються переважно в групах хворих із гіпопластичним та атрофічним типом хибних суглобів, на той час як частотний розподіл генотипів серед хворих із нормопластичним типом наближається до такого в осіб із консолідованими переломами.
Висновки
1. При генотипуванні eNOS Т786С у хворих із хибними суглобами довгих кісток спостерігали тенденцію до зменшення частки нормальних гомозигот 786ТТ, збільшення кількості гетерозигот (786СТ) та патологічних гомозигот (786СС). Частота зустрічальності Салелі серед хворих із хибними суглобами була вищою, ніж серед осіб із консолідованими переломами, і становила 37,7 проти 28,1 %.
2. Частка патологічних гомозигот 786СС серед хворих із гіпопластичним та атрофічним типом хибного суглоба була вищою у 2,3 та 2,6 раза відповідно, ніж серед хворих із нормопластичним типом. Частота Салелі при авітальних типах хибних суглобів сягала 41,7– 43,2 % порівняно з 29–31 % при вітальних типах.
3. Гомозиготні носії Салелі переважали серед хворих із нейродистрофічним синдромом та рефрактурами. Серед хворих із генотипом eNOS 786СС частіше виявлялись особи з аберантними рівнями ГЦ та маркерів запалення.
- Андрушко І.І. Гіпергомоцистеїнемія як фактор патогенезу атеросклерозу та ішемічної хвороби серця; механізми її проатерогенної дії: автореф. дис. на здобуття наук. ступ. докт. мед. наук : спец. 14.01.11 «Кардіологія» / І.І. Андрушко. — К., 2012. — 34 с.
- Андрушко І.І. Рівні Среактивного білка та інтерлейкіну6 у здорових осіб та у хворих на ішемічну хворобу серця / І.І. Андрушко // Буковинський медичний вісник. — 2008. — Т. 12, № 3. — C. 1217.
- Безсмертний Ю.О. Ендотеліальна секреція вазоактивних молекул у різні періоди репаративного остеогенезу при гіпергомоцистеїнемії / Ю.О. Безсмертний // Буковинський медичний вісник, 2012. — Т. 16, № 2(62). — С. 36.
- Заічко Н.В. Рівні гомоцистеїну, цистеїну та гідрогенсульфіду в плазмі крові пацієнтів з тромбозами глибоких вен нижніх кінцівок: зв’язок з поліморфізмом С677Т в гені метилентетрагідрофолатредуктази / Н.В. Заічко // Експериментальна та клінічна фізіологія і біохімія. — 2010. — № 4. — С. 3541.
- Корж Н.А. Репаративная регенерация кости: современный взгляд на проблему. Нарушение регенерации кости (Сообщение 2) / Н.А. Корж, К.К. Романенко, Л.Д. Горидова // Ортопедия, травматология и протезирование. — 2006. — № 1. — С. 8490.
- Метаболізм гомоцистеїну та його роль у патології / Пентюк О.О., Луцюк М. Б., Андрушко І.І., Постовітенко К.П. // Укр. біохім. журн. — 2003. — Т. 75, № 1. — С. 517.
- Полиморфизм T786C промотора гена эндотелиальной NOсинтазы: связь с эффективностью тромболитической терапии у пациентов с острым инфарктом миокарда / Пархоменко А.Н., Кожухов С.Н., Лутай Я.М. и др. // Український медичний часопис. — 2008. — № 4(66). — VII–VIIІ. — C. 2023.
- Распространенность, патогенетическое и прогностическое значение полиморфизма промотора гена зндотелиальной NOсинтетазы у больных с острым коронарным синдромом [Текст] / А.Н. Пархоменко, Я.М. Лутай, В.Е. Досенко и др. // Український кардіологічний журнал. — 2005. — № 4. — С. 2027.
- Hydrogen sulfide protects MC3T3E1 osteoblastic cells against H(2)O(2)induced oxidative damageimplications for the treatment of osteoporosis / Xu Z.S., Wang X.Y., Xiao D.M. [et al.] // Free Radic Biol Med. — 2011. — Vol. 50, № 10. — Р. 13141323.
- Larginine prevents bone loss and bone collagen breakdown in cyclosporin Atreated rats / Fiore C.E., Pennisi P., Cutuli V.M. [et al.] // Eur. J. Pharmacol. — 2000. — Vol. 408, № 3. — Р. 323326.
- Osteogenic differentiation of mesenchymal stem cells from osteopenic rats subjected to physical activity with and without nitric oxide synthase inhibition / Ocarino N.M., Boeloni J.N., Goes A.M. [et al.] // Nitric Oxide. — 2008. — Vol. 19, № 4. — Р. 320325.