Журнал «Травма» Том 13, №1, 2012
Вернуться к номеру
Імунологічні зміни у постраждалих з посттравматичним остеомієлітом довгих кісток кінцівок у процесі комплексного лікування
Авторы: Бодаченко К.А., Рушай А.К., Донченко Л.І., Колосова Т.А., НДІТО ДонНМУ ім. М. Горького
Рубрики: Травматология и ортопедия
Версия для печати
У роботі наведена динаміка імунологічних змін у постраждалих із травматичним остеомієлітом довгих кісток кінцівок у процесі комплексного лікування. Наведені кореляційні зв’язки з основними маркерами запалення.
Summary. In the article there is presented the dynamics of immunological changes in victims with traumatic osteomyelitis of long bones during the integrated treatment. The correlations with main inflammatory markers are given.
Резюме. В работе приведена динамика иммунологических изменений у пострадавших с травматическим остеомиелитом длинных костей конечностей в процессе комплексного лечения. Приведены корреляционные связи с основными маркерами воспаления.
Посттравматичний остеомієліт, комплексне лікування, імунологічні зміни.
Key words: posttraumatic osteomyelitis, integrated treatment, immunological changes.
Ключевые слова: посттравматический остеомиелит, комплексное лечение, иммунологические изменения.
Лікування постраждалих із хронічним посттравматичним остеомієлітом довгих кісток кінцівок залишається дуже важливою проблемою сучасної травматології та ортопедії внаслідок значного зростання кількості гнійних ускладнень травм опорно-рухового апарату. Протягом останніх десятиріч в Україні, особливо у промислових регіонах, у структурі загальної захворюваності визначається збільшення питомої ваги травматизму, а також ускладнень при переломах кісток [3, 4]. Посттравматичний остеомієліт (ПТО) є одним із найбільш поширених ускладнень відкритих (27–51 %) та закритих (0,65–9,6 %) переломів кісток кінцівок [4]. Відкриті переломи гомілки ускладнюються ПТО у 5,2–8,5 % загальної кількості випадків [1, 5]. Вирішення медико-соціальних проблем, пов’язаних із ПТО, вимагає великих матеріальних витрат, оскільки більше третини хворих із ПТО мають тривалу тимчасову, а 68 % — стійку втрату працездатності [2, 5]. Крім того, у загальній структурі інвалідності від травм опорно-рухової системи інвалідність унаслідок остеомієліту сягає близько 13 % [4].
В основі ПТО як інфекційно-запального процесу лежить інтегральна взаємодія мікро- та макроорганізму, що визначається індивідуальними особливостями останнього. Як будь-який регуляторно-пристосувальний процес, запалення розвивається в умовах, що визначаються співвідношенням двох змінних величин — фактора ушкодження та реакції на ушкодження. Відомо, що в разі атипового перебігу запалення (запалення не за правилами) може виникати руйнування тканин, дисемінація й хронізація процесу та інші серйозні ускладнення. Тобто не можна стверджувати, що запалення як природне явище в індивідуальних умовах завжди доцільне або воно забезпечує абсолютний захист та спрямоване на нього.
Метою дослідження був аналіз імунологічних та біохімічних змін в організмі постраждалих із хронічним посттравматичним остеомієлітом довгих кісток кінцівок.
Матеріал та методи дослідження
В основу роботи покладені матеріали обстеження та лікування 343 хворих із ПТО, які перебували в 1999–2010 роках на стаціонарному лікуванні у відділенні кістково-гнійної інфекції Донецького НДІ травматології та ортопедії та Обласної клінічної травматологічної лікарні.
Усі хворі були розділені на дві групи — основну та контрольну. Основну групу становили 187 хворих, яким, крім традиційного лікування (після хірургічного втручання використовували антибіотики, препарати для покращення мікроциркуляції (пентоксифілін), вітаміни групи В та вітамін С), призначали антиоксиданти (вітамін Е, берлітіон), ендотеліопротектори (рефортан, стабізол, хетасорб), імунокорегуючі препарати (лавомакс), препарати для корекції білкового обміну (інфезол, аміносол), пайлер-терапію, яку розпочинали вже під час оперативного втручання. Хворі, які отримували лікування за традиційними методиками (після хірургічного втручання використовували антибіотики, препарати для покращення мікроциркуляції (пентоксифілін), вітаміни групи В та С), становили контрольну групу — 156 чоловік.
Результати та їх обговорення
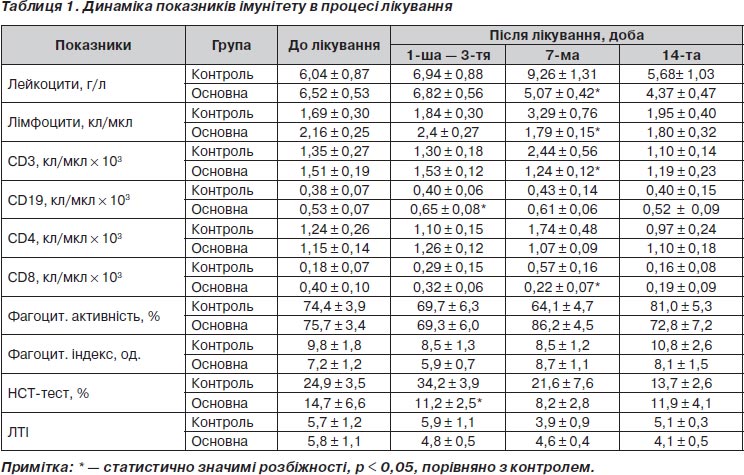
У результаті дослідження встановлено, що вихідний рівень показників імунітету в основній та контрольній групах не мав суттєвих розбіжностей. Але порівняно з нормою у хворих із ПТО відзначався імунодефіціт клітинного типу, про що свідчили статистично вірогідно підвищені показники ЛТІ, не компенсовані гуморальними факторами захисту, що, на наш погляд, є наслідком хронічного запального процесу. Про останнє свідчила підвищена активність системи фагоцитозу, зокрема фагоцитарна активність нейтрофілів та їх метаболічна активність (за даними НСТ-тесту). Звісно, неспецифічні фактори захисту, до яких належить і фагоцитарна система, активуються внаслідок розвитку процесів запалення.
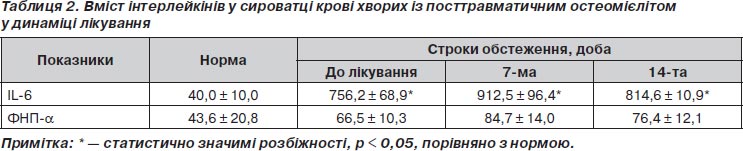
З метою поглиблення характеристики запалення у хворих із ПТО було визначено вміст інтерлейкінів IL у сироватці крові до лікування. Установлено, що рівень IL-6 перед початком лікування вірогідно і значно (у 18,9 раза) відрізнявся від норми, рівень ФНП-a— невірогідно. Рівень IL-6 опосередковано показує високий рівень стимуляції гострофазових білків запалення, тенденцію до загострення хронічного запалення. Незначне перевищення рівня ФНП-a характерне для хронічного процесу. Рівень ФНП-a в досліджуваній групі до лікування може свідчити про зниження імунної відповіді за рахунок недостатньої активності макрофагів та гранулоцитів і вказувати на необхідність корекції імунітету.
Установлено, що до лікування рівень у сироватці крові інтерлейкінів ІL-6 і ФНП-a корелював між собою негативно (r = –0,75; p < 0,05). Слід зазначити, що негативна кореляція між їх показниками характерна для хронічного запального процесу, при гострій системній запальній відповіді кореляційний зв’язок між ІL-6 і ФНП-a має позитивний характер, що підтверджує дані про поліфункціональність інтерлейкінів.
Доведено, що до лікування хворих із хронічним ПТО рівень ІL-6 у сироватці крові позитивно корелював із фагоцитарною активністю нейтрофілів (r = 0,78; p < 0,05) і негативно — із фагоцитарним індексом (r = –0,69; p < 0,05) нейтрофілів. Показники ФНП-a негативно корелювали з фагоцитарною активністю (r = –0,69; p < 0,05) та позитивно — з фагоцитарним індексом (r = 0,72; p < 0,05). З огляду на отримані результати можна вважати, що в цей період дослідження рівні ІL-6 та ФНП-a свідчили про прозапальну їх дію шляхом стимуляції системи фагоцитозу.
Після проведення запропонованого комплексного лікування встановлено, що вже в гострому періоді після оперативного лікування хворих із ПТО кількість CD19 (В-лімфоцитів) в основній групі є значно вищою, ніж у контрольній, що свідчить про більш виражену активацію гуморальної ланки імунітету, а значить кращий прогноз перебігу післяопераційного періоду. На користь останнього свідчили також і показники спонтанного НСТ-тесту, які були вірогідно нижчими, ніж у групі контролю. Звісно, показники НСТ-тесту підвищуються внаслідок активації нейтрофілів бактеріальними збудниками.
На 7-му добу після оперативного лікування у хворих основної групи показники лейкоцитів, лімфоцитів та імунокомпетентних клітин були в межах норми, а фагоцитарна активність нейтрофілів суттєво підвищена щодо норми і групи контролю. Навпаки, у хворих контрольної групи спостерігався лейкоцитоз, поєднаний із лімфоцитозом, що й обумовило вищі, ніж в основній групі, показники CD3 (Т-лімфоцитів) та CD8 (Т-супресорів). Підвищена активність клітинної ланки імунної системи на фоні нормальних показників системи фагоцитозу у хворих контрольної групи свідчила, по-перше, про реакцію переподілу в системі імунітету, по-друге, про більш високу, ніж у хворих основної групи, сенсибілізацію організму внаслідок бактеріального фактора. Останнє в наших дослідження підтверджувалося високими показниками спонтанного НСТ-тесту. Ці дані наведені у табл. 1.
На 14-ту добу розбіжностей між показниками імунної системи у хворих основної та контрольної груп не виявлено. Утім слід відмітити, що у хворих контрольної групи відзначалася тенденція до розвитку імунодефіциту клітинного типу, про що свідчили показники лейко-Т-індексу.
Таким чином, можна констатувати, що застосування комплексного лікування в основній групі хворих із ПТО обумовлює активацію гуморальних факторів захисту в гострому періоді після хірургічного втручання та подальшу активацію системи фагоцитозу на фоні нормальних показників лейкоцитозу на 7-му і 14-ту добу.
У групі контролю розвиток імунодефіциту поєднаного типу в гострому періоді після хірургічного лікування обумовлює на 7-му добу лейкоцитоз та лімфоцитоз, що можна оцінити як реакцію компенсації низької активності системи фагоцитозу, а також як прояв сенсибілізації організму хворих. І хоча на 14-ту добу у хворих контрольної групи спостерігається нормалізація показників імунної системи, чинники ризику рецидиву захворювання зберігаються через низьку активність гуморальних та клітинних факторів захисту.
Результати дослідження вмісту прозапальних інтерлейкінів у сироватці крові свідчили про закономірність їхнього підвищення у хворих із ПТО порівняно з нормою. На 7-му добу після оперативного лікування вміст IL-6 у сироватці крові хворих продовжував підвищуватися й не знизився до вихідного рівня навіть до 14-ї доби після оперативного лікування (табл. 2), що, крім того, свідчить про повільне зниження загрози хронізації процесу. Динаміка вмісту ФНП-a також не демонструвала достатніх темпів нормалізації у зв’язку за недостатністю строків.
Результати кореляційного аналізу дозволили встановити, що на 7-му добу вміст ІL-6 негативно корелював із вмістом ФНП-a (r = –0,76; p < 0,05), фагоцитарним індексом (r = –0,68; p < 0,05) та позитивно — із кількістю СD19+В-лімфоцитів (r = 0,83; p < 0,05). Позитивний зв’язок ІL-6 із кількістю СD19+В-лімфоцитів дає підставу стверджувати, що підвищення концентрації даного інтерлейкіну було спрямоване на активацію гуморального імунітету, а значить він справляв протизапальну дію. У той же час кореляційні зв’язки ФНП-a були представлені позитивними зв’язками з фагоцитарною активністю (r = 0,71; p < 0,05) та фагоцитарним індексом (r = 0,78; p < 0,05), що дає підстави стверджувати, що даний інтерлейкін справляв прозапальний ефект, що реалізовувався через стимуляцію системи фагоцитозу.
Інформативним способом оцінки ефективності лікування є порівняння вихідних даних щодо ступеня втрати працездатності з даними його динамічного спостереження упродовж найближчих років після початку лікування. Для проведення порівняння віддалених результатів лікування хворих основної та контрольної груп нами були виділені дві репрезентативні групи. У хворих цих груп було ураження кісткової тканини, що вимагало проведення сегментарної резекції близько 4–5 см. Таких хворих в основній групі було 27, у контрольній — 25. Серед них і проводилося порівняння.
Таким чином, ми бачимо, що запропонований та впроваджений у нашій клініці комплекс лікувальних заходів у хворих із посттравматичним остеомієлітом довгих кісток кінцівок сприяє покращенню захисних сил організму та веде до покращення результатів лікування цієї категорії постраждалих. Відзначається зменшення питомої ваги непрацюючих до 28,6 % у контрольній і до 16,6 % в основній групах при збільшенні питомої ваги хворих, які займаються трудовою діяльністю, до 71,4 % у контрольній групі та до 83,4 % в основній групі.
Вивчення віддалених результатів лікування свідчить про позитивний довготривалий ефект запропонованого лікувального комплексу.
Висновки
1. Встановлено, що розвиток посттравматичного остеомієліту відбувається на тлі підвищеної активності фагоцитарної системи та імунодефіциту клітинного типу, некомпенсованого гуморальними факторами захисту. Останнє обумовлено недостатньою продукцією ФНО-a імунокомпетентними клітинами, що змінює зв’язок його з IL-6 та сприяє розвитку неадекватної стану хворих запальної реакції.
2. Застосування комплексного лікування в основній групі хворих із ПТО обумовлює активацію гуморальних факторів захисту в гострому періоді після хірургічного втручання та подальшу активацію системи фагоцитозу на фоні нормальних показників лейкоцитозу на 7-му і 14-ту дібу, що розцінюється як адекватна реакція системи імунітету на хронічний запальний процес, у той час як у контрольній групі виявляється розвиток імунодефіциту поєднаного типу в гострому періоді після хірургічного лікування, що обумовлює на 7-му дібу лейкоцитоз та лімфоцитоз, які можна оцінити як реакцію компенсації низької активності системи фагоцитозу.
3. Віддалені дані свідчать про те, що працездатна група хворих зростає на 12 % порівняно з контрольною.
Астахова B.C. Принципи імунокорегуючої терапії хворих на остеомієліт / B.C. Астахова // Посібник з актуальних проблем кістково-гнійної хірургії та методів консервативного лікування. — К., 1999. — С. 358-372.
Белобородова Н.В. Иммунологические аспекты послеоперационного сепсиса / Н.В. Белобородова, Е.Н. Бачинская // Анестезиология и реаниматология. — 2000. — № 1. — С. 59-67.
Принципы сравнительной оценки результатов лечения пострадавших с посттравматическим остеомиелитом костей конечностей / К.А. Бодаченко, А.К. Рушай, В.Г. Климовицкий [и др.] // Актуальные вопросы профилактики, диагностики и терапии хирургической инфекции: Мат-лы VII Всеарм. междунар. конф. (ЦВДО «Подмосковье», 1–2 ноября 2007 г.). — М., 2007. — С. 96.
Посібник з актуальних проблем кістково-гнійної хірургії та методів консервативного лікування / І.П. Вернигора, Г.В. Гайко, М.П. Грицай [та ін.]. — Вид. 2. — К., 1999. — 440 с.
Клименко В.Н. Критерии применения иммунотерапии и контроля ее эффективности при послеоперационных гнойно-воспалительных осложнениях / В.Н. Клименко, А.С. Тугушев // Клініч. хірургія. — 2000. — № 8. — С. 39-40.
Meadows S.E. Posttraumatic tibial osteomyelitis: diagnosis, classification, and treatment / S.E. Meadows, J.D. Zukerman, K.J. Koval // Bull. Hosp. Jt. Dis. — 1993. — Vol. 52, № 2. — P. 11-16.