Журнал «Травма» Том 12, №4, 2011
Вернуться к номеру
Поєднаний вплив глюкозаміну сульфату і гідроксіетилкрохмалю на загальну рухову активність тварин і збудливість m.quadriceps femoris та n.femoralis у процесі репаративного остеогенезу
Авторы: Севериновська О.В., Бакова О.-Д.В., Григоренко Т.В., Дніпропетровський національний університет ім. Олеся Гончара, Литвин Ю.П., Дніпропетровська державна медична академія
Рубрики: Травматология и ортопедия
Версия для печати
Робота пов’язана з дослідженням змін параметрів збудливості нервів (nervus femoralis) та м’язів (musculus quadriceps femoris), загальної рухової активності та поведінкових реакцій щурів лінії Вістар у процесі репаративного остеогенезу в результаті експериментально змодульованого транскортикального дірчастого дефекту стегнової кістки при впливі фармакологічного (глюкозаміну сульфат) та плазмозамісного (гідроксіетилкрохмаль) препаратів та їх поєднаному впливі. Найкращий вплив відмічено при поєднаному застосуванні речовин, відзначені відмінності при дослідженні параметрів залежно від віку тварин. Вплив солей глюкозаміну сульфату відбився більше на параметрі реобази, гідроксіетилкрохмалю — на параметрі хронаксії.
Остеогенез, глюкозаміну сульфат, реобаза, хронаксія, рухова активність.
Вступ
На сьогодні актуальним є пошук можливих сигнальних молекул, що впливають на точність репаративних процесів у кістковій тканині [3, 6]. При дослідженні розвитку остеоартрозу вказано на важливу роль глюкозаміну, що впливає на метаболізм хрящової тканини. У процесі патогенезу було відмічено, що дегенеративні процеси охоплюють також і субхондральний шар кістки [5, 6], запропонована гіпотеза, що порушення обміну речовин у останній відіграє ключову роль у розвитку остеоартрозу [5]. З цієї точки зору глюкозамін почав розглядатися як можлива сигнальна молекула, що впливає на метаболізм кісткової тканини [3]. У процесі репаративного остеогенезу важливими є координація процесів мінералізації та осифікації, біохімічна конструкційна відповідність утворюваних сполук, що беруть участь у хондрогенезі, здатність до біоакумуляції та стимуляції синтезу власних сполук, необхідних у процесі репарації. На сьогодні в травматології використовують речовини — аналоги внутрішньоорганізменних сполук, як-от: хондроїтинсульфат, глюкозаміну сульфат чи фосфат і т.д., тобто речовини, які безпосередньо впливають саме на хондрогенез, а не на ступінь прояву запальних процесів, для лікування яких раніше широко застосовувались нестероїдні протизапальні препарати [4, 6, 7]. Необхідним є пошук препаратів, здатних знижувати психологічний посттравматичний дискомфорт та больові відчуття, не викликаючи при цьому зниження ефективності безпосередньої дії препарату. Глюкозаміну сульфат (ГЛС) може in vitro стимулювати культивовані клітини хряща людини, синтезувати протеоглікани, сприяє фіксації сірки в процесі синтезу хондроїтинсірчаної кислоти, нормальному відкладенню кальцію в кістковій тканині [6]. Гідроксіетилкрохмаль впливає на реологічні властивості крові, збільшуючи об’єм циркулюючої крові майже на 80 %. Ми припустили, що при поєднаному введенні цих речовин буде спостерігатися збільшення ефективності використання ГЛС організмом.
Матеріали і методи
Нами були оцінені параметри реобази та хронаксії m.quadriceps femoris, також проведені дослідження впливу фармакологічних препаратів на емоційний стан та рухову активність тварин методом тестування у відкритому полі. Експеримент тривав 6 тижнів. Дослідження проводилися на лабораторних щурах-самцях лінії Вістар, яким під легкою анестезією (кетамін — 15мг/кг) робили дірчастий транскортикальний дефект у ділянці середньої частини стегнової кістки лівої кінцівки. Тварини були поділені на 2 вікові та 4 експериментальні групи. Тваринам I групи в надколінну ділянку за допомогою інтракісткової голки вводили фізіологічний розчин, II групи — глюкозаміну сульфат (ГЛС) (1,75 мг/кг), III групи — гідроксіетилкрохмаль (ГЕК) — 0,15 г/кг, IV — ГЕК та ГЛС у вищезазначених дозах. Тестування у відкритому полі проводилося згідно з методичними рекомендаціями Я. Бурша та ін. Визначення реобази та хронаксії проводили на електрофізіологічній установці, що складається з електростимулятора лабораторного ЕСЛ-2 [1]. Результати оброблялися статистично непараметричними методами, зокрема методом парних порівнянь. Зміни оцінювалися як вірогідні при р ≤ 0,05.
Результати дослідження
Порівнюючи поведінку тварин, яким після створення транскортикального дірчастого дефекту вводили гідроксіетилкрохмаль, з результатами тестування тварин контрольної групи, відмічали зниження загальної рухової активності у відкритому полі, збільшення актів уринації, дефекації та тривалості грумінгу майже в 5 разів, що свідчить про збільшення емоційної активності тварин та, як наслідок, про емоційне напруження.
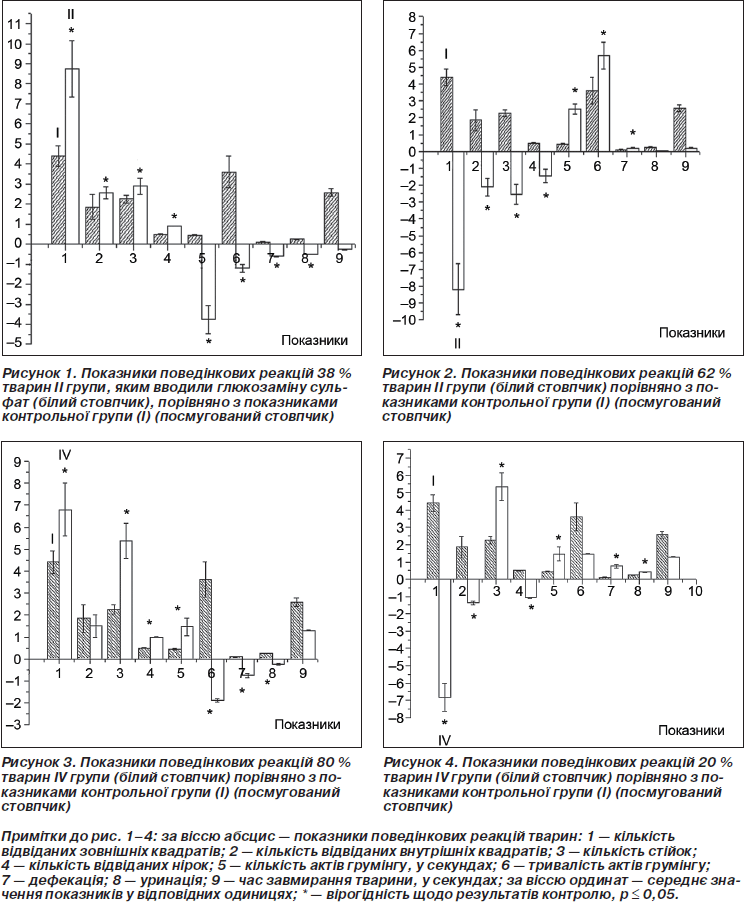
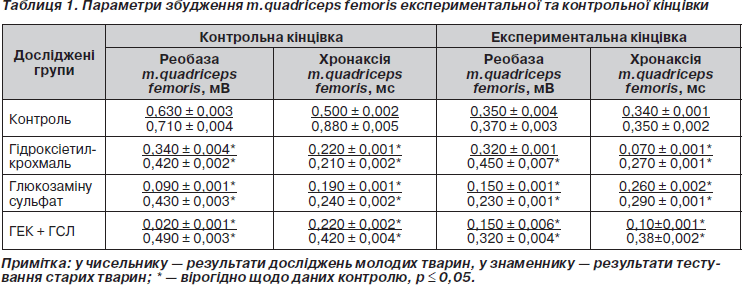
Під час дослідження поведінки тварин II групи, яким водили глюкозаміну сульфат, виявлено, що у 38 % тварин (рис. 1) цієї групи збільшена загальна рухова активність (за кількістю перетнутих твариною зовнішних та внутрішних квадратів й кількістю стійок), а у 62 % (рис. 2) — збільшена емоційність (про яку можна судити за кількістю уринацій, дефекацій та актів грумінгів). Підвищення загальної рухової активності можна пояснити позитивною дією глюкозаміну сульфату на опорно-руховий апарат у 38 % щурів, тому що було відмічене повне зрощення кістки. Зниження емоційності може свідчити про ряд побічних ефектів препарату, які можуть проявлятись на рівні нервової системи. Протилежну реакцію спостерігали у 68 % тварин після курсу ГЛС, яка виражалася в зменшенні частоти відвідувань зовнішніх і внутрішніх квадратів та кількості стійок, але при цьому зменшувався час нерухомості тварин та збільшувалася тривалість грумінгів. Ці факти свідчать про підвищення рівня тривожності тварин, що підтверджується також збільшенням кількості дефекацій.
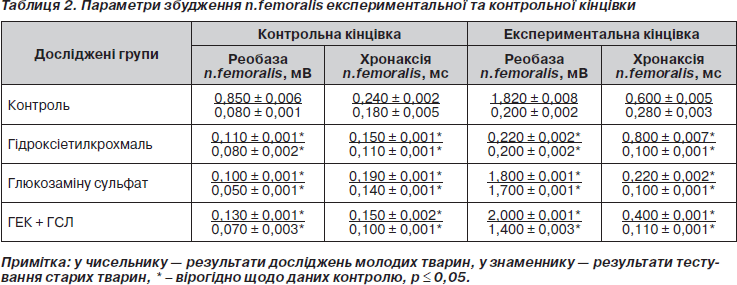
Під час дослідження поведінки тварин IV групи, яким поєднано вводили глюкозаміну сульфат та гідроксіетилкрохмаль, виявлено, що у 80 % тварин цієї групи (рис. 3) збільшена загальна рухова активність і знижена емоційна активність. У 20 % тварин, навпаки, збільшена емоційність і знижена рухова активність (рис. 4).
Отже, хоча у більшості тварин, яким для прискорення заростання кістки вводили дві речовини — гідроксіетилкрохмаль та глюкозаміну сульфат, спостерігали позитивний ефект як на рівні кісткової тканини, так і на рівні центральної нервової системи, у 20 % тварин реакція ЦНС не була позитивною. Особливо сильний негативний ефект з боку центральної нервової системи відмічався при введенні глюкозаміну сульфату, а гідроксіетилкрохмаль дещо пом’якшує дію сульфатного препарату. На цей факт треба звернути увагу лікарям, які, до речі, відмічають у пацієнтів, яким пропонують дану терапію, скарги на головний біль, запаморочення, депресію, зниження рухової активності та млявість. Ми вважаємо за доцільне використовувати індивідуальний підхід у випадках, коли рекомендуються препарати, що мають подібні складові компоненти.
Дослідження параметрів збудження проводилися на m.quadriceps femoris та n.femoralis оперованої (експериментальної) та контрольної кінцівок. У контрольних тварин реобаза m.quadriceps femoris контрольної кінцівки становить 0,63-0,71 мВ, що вищє, ніж показник експериментальної (табл. 1). Використовуючи гідроксіетилкрохмаль та глюкозаміну сульфат як окремо, так і разом, спостерігаємо зниження реобази дослідженого м’яза як у молодих, так і в старих тварин. На експериментальній кінцівці при використанні ГЕК показники реобази у молодих тварин майже не відрізняються від показників контрольної групи, проте у старих тварин збільшується сила струму, що викликає відповідь дослідженого м’яза.
Ми вважаємо, що отримані дані можуть свідчити про обумовленість ефекту дії ГЛС вихідним станом збуджуваної тканини та прояв його дії в певних межах. У той же час може мати місце різниця у впливах при локальній безпосередній дії речовини та при її опосередкованій дії через кровотік. Більш низькі значення реобази експериментальної кінцівки контрольної групи тварин порівняно із значеннями контрольної вважаємо обумовленими больовими відчуттями та самою травмою, що підвищує збудливість тканин. Також більш низькі показники можуть обумовлюватися перерозподілом іонних потоків та метаболітів, що виникає в процесі репаративної регенерації кісткової тканини. У старих тварин при ін’єкціях ГЛС спостерігається значне зниження реобази м’яза експериментальної та підвищення показників контрольної кінцівки, що, на нашу думку, обумовлене властивостями саме солей ГЛС — вони знижують больові відчуття.
Хронаксія m.quadriceps femoris тварин різних вікових груп контрольної кінцівки триваліша, ніж експериментальної. Як окреме введення досліджених препаратів, так і поєднане їх використання зменшує час відповіді м’яза на електричне подразнення, що за силою відповідає двом реобазам. Хронаксія експериментальної кінцівки m.quadriceps femoris у молодих та старих щурів майже однакова (0,34–0,35 мс). Найменше часу, необхідного для відповіді даного м’яза, відзначалося в щурів, яким уводили ГЕК, цей ефект, вважаємо, обумовлений самим плазмозаміщуючим препаратом, що здатен збільшувати об’єм циркулюючої крові. Таким чином виникає зміна трансмурального тиску та полегшення дифузії активних речовин крізь стінки капілярів, прискорюється кровотік, та в результаті розширення судин збільшується кількість еритроцитів, що проходять через судину, збільшуючи надходження кисню до тканин, зростає кількість білків плазми крові на одиницю об’єму судини, з якими зазвичай зв’язується більшість речовин [2]. При використанні ГЛС + ГЕК відмічаємо незначне збільшення значення хронаксії у старих тварин порівняно з контрольною групою, це може бути пов’язане зі зниженням біодоступності фармакологічного препарату при комбінованому використанні, а також з вихідною недостатністю в старому організмі енергії гліколітичних процесів, які є досить активними у молодому, що й обумовлює таку різницю в показниках при їх порівнянні.
Цікавим виявилося й вивчення реобази та хронаксії n.femoralis контрольної та експериментальної кінцівок у лабораторних тварин всіх досліджених груп (табл. 2). Навіть у тварин контрольної групи відмічали суттєві особливості залежно від віку. Якщо в молодих тварин значення реобази склало 0,85 мВ, то у старих — 0,08 мВ. Швидше за все, це явище пов’язано з більшою чутливістю старих особин, але воно потребує більш детального вивчення. Усі використані препарати вірогідно знижують значення реобази n.femoralis як контрольної, так і експериментальної кінцівки молодих щурів порівняно з контролем. У старих тварин найбільше зниження реобази цього нерва експериментальної кінцівки відмічали при введенні ГЛС. Поєднана дія двох препаратів у даному випадку менш виражена, ніж окрема дія кожного.
Більш точний показник збудливості нерва, що частіше використовується у клініці, — хронаксія. Встановлено, що на контрольній кінцівці збільшена хронаксія n.femoralis порівняно з експериментальною як у старих, так і у молодих тварин, але більш виражена вона в останніх. При введенні ГЕК відбувається суттєве збільшення хронаксії нерва, що вивчається, у молодих тварин і не менш суттєве зменшення цього показника у старих тварин. При дії ГЛС та при комбінованому використанні ГЕК + ГЛС відмічали зменшення цього показника збудливості нерву, що більш виражене в старих тварин, ніж у молодих.
У контролі хронаксія n.femoralis експериментальної кінцівки склала 0,18 мс у старих тварин та 0,24 мс у молодих, отже, збуджувані тканини старих тварин є більш чутливими до подразнення. Введення ГЕК пропорційно зменшує хронаксію n.femoralis у тварин обох вікових груп. За ефективністю поєднана дія ГЕК та ГЛС займає середнє становище між окремими речовинами.
Взагалі при розгляді параметрів збудження n.femoralis було відмічено зниження реобази та хронаксії у старих тварин порівняно з молодими, що, ймовірно пов’язане з тим, що тварини кожні 3 дні підлягали ін’єкції відповідними речовинами, що призводило до розвитку стресового стану у тварин, і це викликало збільшення збудливості тканин. У силу того, що молоді тварини легше адаптуються та легше відновлюють баланс, збудливість волокон встигає відновитися, на той час у старих тварин вона увесь час підвищена.
Як відомо, процеси активного транспорту іонів потребують певних енергетичних затрат, з віком же відбувається обмеження цих можливостей, що відбивається на зниженні збудливості скелетно-м’язових клітин. У міокарді і в скелетних м’язах великого значення набувають гліколітичні процеси, тому результативним є введення глюкозамінових препаратів з терапевтичною метою, що й показано в даній роботі. Згідно з отриманими даними, поєднана дія ГЛС та ГЕК найкраще впливає на показники збудливості тканин, іноді досягаючи середніх, але стабільних та стійких значень. Також можна зауважити, що це питання потребує подальшого дослідження й незайвим є пошук нових комбінацій препаратів, що модулюють структуру хрящової тканини. Результати досліджень можуть бути застосовані в терапії, травматології та ортопедії. Результати даної роботи застосовані в дослідницькій практиці та клініці комунального закладу Міської клінічної лікарні № 16 м. Дніпропетровська.
Висновки
1. Максимальне зниження реобази m.quadriceps femoris отримане при використанні солей глюкозаміну сульфату як у старих, так і молодих тварин. Використання солі глюкозаміну сульфату призвело до найбільшого подовження хронаксії, і ці значення близькі до значень контролю.
2. У старих тварин ін’єкція гідроксіетилкрохмалю призвела до збільшення сили подразника, необхідної для виникнення ефекту. У молодих тварин значення реобази практично не відрізнялося від значень контрольної групи. Значення хронаксії знижені.
3. На експериментальній кінцівці значення реобази м’яза при поєднаному застосуванні гідроксіетилкрохмалю та глюкозаміну сульфату вище, ніж при використанні їх окремо. Значення хронаксії при цьому займають проміжне положення.
4. Використання солей глюкозаміну сульфату спричинило максимальне зниження показників і реобази, і хронаксії nervus femoralis як у молодих, так і в старих тварин. Це свідчить про підвищення чутливості периферичного відділу нервової системи до дії фактора.
5. Виходячи з характеру співвідношень отриманих значень у молодих та старих тварин, відмічаємо: вплив солей глюкозаміну сульфату відбився більше на параметрі реобази, гідроксіетилкрохмалю — на параметрі хронаксії.
Гуляев В.Ю. Опыт применения хронаксиметрической электродиагностики и ее математическое моделирование / В.Ю. Гуляев, И.Е. Матвеев и др. // Материалы VII Международного форума. — 2000. — C. 46-47.
Кукес В. Г. Клиническая фармакология. — М.: ГЭОТАР-Медиа, 2006. — 944с.
Нутини А. Интегративная информация в кости в процессе восстановления кости после перелома / А. Нутини, Ф. Мациони // Российский журнал биомеханики. — 2004. — Т. 8, № 3. — С. 85-90.
Lippiello L. Glucosamine and chondroitin sulfate: biological response modifiers of chondrocytes under simulated conditions of joint stress // Osteoarthritis and Cartilage. — 2003. — № 11(5). — P. 335–342.
Osteoarthritis // Digest for ours. — 2009. — № 2. — C. 1-6.
Piperno M. Glucosamine sulfate modulates dysregulated activities of human osteoarthritic chondrocytes in vitro / M. Piperno, P. Reboul, M.P. Hellio Le Graverand et al. // Osteoarthritis Cartilage. — № 8(3). — P. 207.
Rovati L.C. A large randomized, placebo controlled, double-blind study of glucosamine sulfate vs. proxicam and vs. their association, on the kinetics of the symptomatic effects in knee osteoarthritis // Osteoarthritis Сartilage — 2009. — Vol. 2, № 1. — 56 (abs).