Журнал «Травма» Том 12, №4, 2011
Вернуться к номеру
Провоспалительные цитокины у больных остеоартрозом с метаболическим синдромом
Авторы: Гришина Е.И.1, Бабинец О.М.1, Шулика С.А.2, 1ГУ «Институт микробиологии и иммунологии им. И.И. Мечникова НАМН Украины», клиническое иммунологическое отделение, г. Харьков, 2КУОЗ «Харьковская городская многопрофильная больница №18»
Рубрики: Травматология и ортопедия
Версия для печати
Остеоартроз (ОА) является самой распространенной нозологической формой суставной патологии среди ревматологических заболеваний. Его патогенез больше не рассматривается как просто процессы старения и дегенерации хряща. В последние годы все большая роль стала отводиться воспалению, в реализации которого процессы выработки и взаимодействия цитокинов могут быть определяющими. Например, интерлейкин-1b (ИЛ-1b) и фактор некроза опухоли a (ФНО-a) стимулируют хондроциты и способствуют производству металлопротеиназ и активаторов плазминогена, которые, в свою очередь, разрушают матрицу протеогликанов и коллагена [1]. Другие механизмы повреждения суставов и деградации хряща осуществляются через индукцию синтеза таких провоспалительных цитокинов, как ИЛ-1, ИЛ-6, ИЛ-8 и др. [2, 3].
Воспаление усиливает разрушение хряща при ОА. Больные с рентгенологическими признаками быстрого прогрессирования поражения суставов, как правило, имеют более высокие базовые уровни С-реактивного белка (СРБ) в отличие от тех пациентов, у которых болезнь прогрессирует медленно. Такой маркер воспаления, как СРБ, повышен у больных ОА по сравнению со здоровыми лицами. ИЛ-6, который считается главным стимулятором продукции СРБ, производится синовиальными клетками, остеобластами и хондроцитами и определяется в синовиальной жидкости больных ОА [4]. Кроме этого, ИЛ-6 может стимулировать ангиогенез [5]. Помимо ИЛ-6 в реализации ангиогенеза принимает участие большое количество биологически активных веществ, в том числе фактор роста фибробластов b, ИЛ-1, матричные металлопротеиназы, простагландин E2, субстанция P, тканевой ингибитор металлопротеиназ, трансформирующий фактор роста b, ФНО-a, сосудистый эндотелиальный фактор роста [6, 7]. Ангиогенез в остеохондральном соединении приводит к эндохондральной оссификации и формированию остеофитов. Ангиогенез и повреждение сустава поддерживают обострение воспаления [8, 9].
Целью настоящей работы явилось изучение уровней ФНО-a, ИЛ-6, ИЛ-8 в сыворотке крови у больных ОА с метаболическим синдромом (МС).
Материалы и методы исследования
Диагноз ОА устанавливали на основании критериев R.D. Althmann (1995) [10].
При постановке диагноза МС использовали диагностические критерии, разработанные Международной федерацией диабета [11].
При оценке тяжести течения ОА использовали индекс WOMAC (Western Ontario and McMaster University), индекс тяжести гонартроза (индекс Лекена), оценку боли пациентом по визуально-аналоговой шкале (ВАШ). Качество жизни пациентов оценивали с использованием Стенфордской анкеты оценки здоровья HAQ (Health Assessment Questionnaire) [12].
Содержание цитокинов в сыворотке крови определяли посредством иммуноферментного анализа с использованием наборов готовых реактивов «Альфа-ФНО-ИФА-Бест» (ЗАТ «Вектор-Бест», Россия), «Интерлейкин-6-ИФА-Бест» (ЗАТ «Вектор-Бест», Россия), «Интерлейкин-8-ИФА-Бест» (ЗАТ «Вектор-Бест», Россия) соответственно [13].
Статистический анализ проводили с использованием пакета статистических программ SPSS версии 15.0. Порог статистической ошибки различных тестов был установлен на уровне 5 % [14].
Полученные результаты
Обследовано 87 пациентов: 46 больных ОА с МС (группа А), средний возраст которых составил 68,0 ± ± 9,3 года (M ± SD), ранги 64–82: 10 (21,7 %) мужчин и 36 (78,3 %) женщин. Контрольную группу (группа Б) составил 41 пациент с ОА без МС, средний возраст — 63,0 ± 6,9 года, ранги 59–76: 11 (26,8 %) мужчин и 30 (73,2 %) женщин, p > 0,05 при сравнении данных демографических показателей между группами.
Патогенетические варианты ОА в обеих группах были представлены исключительно идиопатическим. Клинические формы распределились следующим образом. В группе Б моноостеоартроз наблюдался у 2 (4,9 %) пациентов, частота олиго- и полиостеоартроза достоверно не различалась и составила 16 (39,0 %) и 23 (56,1 %) пациента соответственно (р = 0,300). В группе А преобладали пациенты с полиостеоартрозом — 36 (78,3 %) против 10 (21,7 %) с олигоостеоартрозом (р < 0,05). Моноостеоартроз среди пациентов этой группы диагностирован не был.
Согласно классификационным критериям I. Kellgren и I. Lawerens [12], признаки, которые соответствуют I рентгенологической стадии поражения суставов, достоверно чаще наблюдались в группе Б — 26 (63,4 %) больных, чем в группе А — 7 (15,2 %) больных (р < 0,0001). Вторая рентгенологическая стадия, наоборот, достоверно чаще встречалась в группе А — 30 (65,2 %) больных, чем в группе Б — 9 (22,0 %) больных (р < 0,0001). Третья же стадия была одинаково часто представлена в обеих группах: в группе Б — у 6 (14,6 %) больных и в группе А — у 9 (19,6 %) больных (р = 0,539).
Функциональная недостаточность (ФН) 0 степени встретилась в группе Б только у 17 пациентов (41,5 %). ФН 1-й степени превалировала в группе Б — 19 (46,3 %) пациентов против 5 (10,9 %) в группе А (р = 0,0004). В то же время ФН 2-й степени чаще встречалась в группе А (32 пациента — 69,6 %) по сравнению с группой Б (4 пациента — 9,8 %) (р = 0,001). Только в группе А пациенты (9 лиц — 19,6 %) нуждались в постороннем уходе (ФН 3-й степени).
Утренняя скованность в группе Б составила 16,0 ± 4,0 мин, а группе А была значительно большей — 31,0 ± 7,5 мин (р < 0,0001). Время прохождения 20 м в группе Б составило 7,0 ± 1,1 с и было существенно выше в группе А — 38,3 ± 15,0 с (р < 0,0001).
Индекс WOMAC был ниже в группе А, где составил 43,8 ± 7,3, в отличие от группы Б — 56,5 ± 8,9 (р < 0,0001). Индекс Лекена достоверно различался между группами — 7,5 ± 3,1 в группе А против 18,0 ± 8,8 в группе Б (р < 0,0001).
Качество жизни пациентов, которое оценивали с помощью HAQ (M ± SD), в группе Б было намного хуже (16,0 ± 3,5 балла), чем в группе А (4,8 ± 1,5 балла) (р < 0,0001).
Оценка боли по ВАШ пациентами составила в группе Б 77,4 ± 15,5 мм по сравнению со значительно более низкими показателями в группе А — 30,0 ± 1,7 мм (р < 0,0001).
Данные клинического обследования показали, что группа А отличалась более тяжелым течением ОА по сравнению с контрольной.
Исследование уровней цитокинов в сыворотке крови (рис. 1) показало, что пациенты группы Б имели более низкие показатели, чем пациенты группы А: ФНО-a — 30,0 ± 9,1 пг/мл против 45,0 ± 17,3 пг/мл (р < 0,001), ИЛ-6 — 47,23 ± 14,96 пг/мл против 59,34 ± 17,41 пг/мл (р < 0,001), ИЛ-8 — 34,22 ± 11,75 пг/мл против 48,74 ± 12,61 пг/мл (р < 0,001).
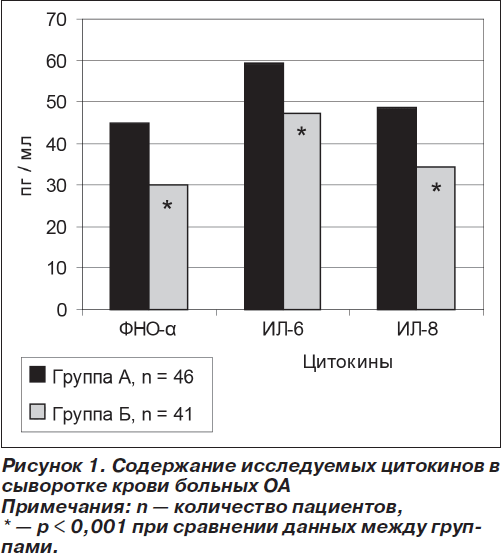
Анализируя данные, приведенные на рис. 1, можно сделать заключение: содержание ФНО-a, ИЛ-6, ИЛ-8 было достоверно выше у пациентов с ОА и МС, чем в группе пациентов только с ОА.
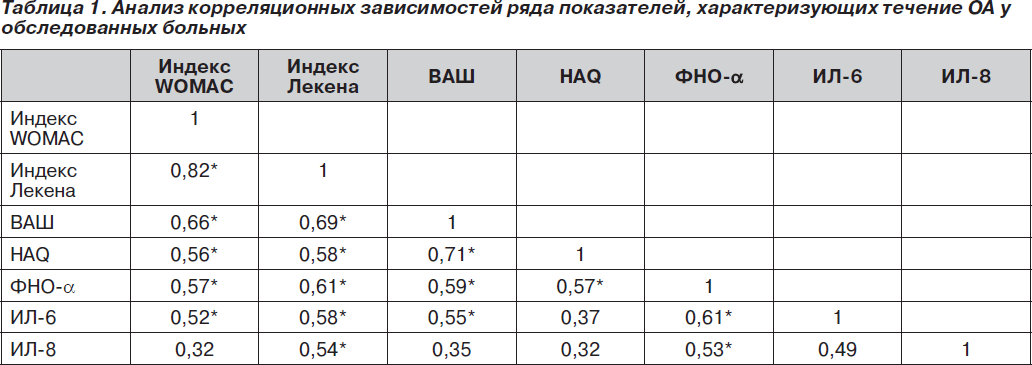
При проведении корреляционного анализа между клиническими оценками тяжести течения ОА и уровнями цитокинов были выявлены определенные взаимосвязи (табл. 1). Так, положительная корреляционная зависимость была получена для индекса Лекена и уровней ФНО-a (r = 0,61, p < 0,01), ИЛ-6 (r = 0,58, p < 0,05) и ИЛ-8 (r = 0,54, p < 0,05), индекса WOMAC и ФНО-a (r = 0,57, p < 0,05), ИЛ-6 (r = 0,52, p < 0,05), но не для ИЛ-8 (r = 0,43, p > 0,05). Качество жизни пациентов коррелировало только с ФНО-a (r = 0,57, p < 0,05) в отличие от ИЛ-6 (r = 0,37, p > 0,05) и ИЛ-8 (r = 0,32, p > 0,05). Интенсивность боли коррелировала с уровнем ФНО-a (r = 0,59, p < 0,05) и с уровнем ИЛ-6 (r = 0,55, p < 0,05), но не с уровнем ИЛ-8 (r = 0,39, p > 0,05).
Таким образом, у больных ОА с МС уровень провоспалительных цитокинов, таких как ФНО-a, ИЛ-6, ИЛ-8, выше, чем у пациентов с ОА без МС. Это связано с более тяжелым течением ОА у пациентов с МС с клинической точки зрения (худшие показатели индексов Лекена, WOMAC, HAQ, ВАШ боли) и подтверждается наличием позитивной корреляционной зависимости для ФНО-a с индексом Лекена, индексом WOMAC, качеством жизни пациентов, интенсивностью болевого синдрома, для ИЛ-6 — с индексом Лекена, индексом WOMAC, интенсивностью болевого синдрома, а для ИЛ-8 — с индексом Лекена. Полученные результаты свидетельствуют об активном участии провоспалительных цитокинов в реализации патологического процесса при ОА с МС.
Moskowitz R.W. Osteoarthritis diagnosis and medical [Text] / R.W. Moskowitz, R.D. Altman, M.C. Hochberg, J.A. Buckwalter, V.M. Goldberg / Fourth Edition by Roland W. Moskowitz. — 2007. — 470 р.
Гришина Е.И. Особенности иммунологического статуса у пациентов с остеоартрозом с метаболическим синдромом [Электронный ресурс] / Е.И. Гришина // Анали Мечниківського Інституту. — 2009. — № 4. — Режим доступу www.imiamn.org/journal.htm
Гришина Е.И. Состояние клеточного иммунитета у пациентов с остеоартрозом с метаболическим синдромом [Текст] / Е.И. Гришина // Збірник ВАК «Актуальні проблеми акушерства і гінекології, клінічної імунології та медичної генетики». — 2010. — Вип. 18 — C. 143-148.
Simon L.S. Osteoarthritis: etiology, pathogenesis, and treatment [Text] / L.S. Simon / Current therapy in pain edited by Howard Smith. — 2009. — 241-245 pp.
Широкова Л.Ю. Роль цитокинов в патогенезе остеоартроза [Текст] / Л.Ю. Широкова, С.М. Носков, О.М. Паруля, О.Г. Козлова, Р.М. Нагибин, Л.Н. Долгова, Е.Б. Абросимова // Цитокины и воспаление. — 2010. — № 4.
Bonnet C.S. Osteoarthritis, angiogenesis and inflammation [Text] / C.S. Bonnet, D.A. Walsh // Rheumatology. — 2005. — № 44. — Р. 7-16.
McLachlan C.S. Vascular inflammation [Text] / C.S. McLachlan // Canadian Medical Association Journal. — 2007. — № 13. — Р. 134-136.
Bonnet C.S. Osteoarthritis, angiogenesis and inflammation [Text] / C.S. Bonnet, D.A. Walsh // Rheumatology. — 2005. — № 44. — Р. 7-16.
McLachlan C.S. Vascular inflammation [Text] / C.S. McLachlan // Canadian Medical Association Journal. — 2007. — № 13. — Р. 134-136.
Altman R.D. Recommendations for the medical management of osteoarthritis of the hip and knee: 2000 update. American College of Rheumatology Subcommittee on Osteoarthritis Guidelines [Text] / R.D. Altman, M.C. Hochberg, R.W. Moskowitcz, T.J. Schnitzer // Arthritis Rheum. — 2000. — Vol. 43, № 9. — P. 1905-1915. — ISSN 0893-7524.
Alberti K.G.M.M. The Metabolic Syndrome — A New Worldwide Definition from the International Diabetes Federation Consensus [Text] / K.G.M.M. Alberti, P.Z. Zimmet, J.E. Shaw // Lancet. — 2005. — Vol. 366, № 949. — P. 1059-62. — ISSN 0140-6736.
Коваленко В.Н. Остеоартроз: Практическое руководство [Текст] / В.Н. Коваленко, О.П. Борткевич. — Киев: Морион, 2004. — 448 с.
Меньшиков В.В. Клинико-лабораторные аналитические технологии и оборудование: Учеб. пособие [Текст] / В.В. Меньшиков, Т.И. Лукичева, Ю.Е. Михайлов, Е.А. Берсенева. — 1-е изд. — М.: Академия, 2007. — 240 с. — ISBN: 5-7695-3394-3.
Riffenburgh R.H. Statistics in Medicine [Text] / R.H. Riffenburgh // Academic Press. — 2005. — 672 р.