Журнал «Травма» Том 12, №4, 2011
Вернуться к номеру
Жировая эмульсия на основе оливковых масел для парентерального питания у пациентов с политравмой: пилотное исследование
Авторы: Gerald Huschak, Karsten Nieden, Thomas Hoell, Dagmar Riemann, Halle, Germany, Henning Mast, NY, USA, Ralph Stuttmann, Halle, Germany
Рубрики: Травматология и ортопедия
Версия для печати
Предмет исследования: отрицательное влияние гипергликемии на клинический исход заболевания у пациентов в отделении интенсивной терапии предполагалось давно. Хотя до сегодняшнего дня безопасность и эффективность жировой диеты, в частности при использовании с этой целью жировой эмульсии (ЖЭ) на основе масел оливок (ЖЭМО), систематически не изучались.
Дизайн исследования: было проведено проспективное открытое рандомизированное пилотное исследование на базе отделения интенсивной терапии с 14 койками.
Отбор пациентов: в исследование было включено 33 пациента с политравмой (по шкале тяжести травмы 31,6 ± 11,5); 18 (Ж-группа) получали парентеральное питание с ЖЭ, 15 (Г-группа) получали стандартное парентеральное питание на основе глюкозы.
Оценка полученных результатов: расход энергии (калорий) (РЭ) существенно не отличался у пациентов разных групп, также не было зафиксировано существенной межгрупповой разницы в соотношении потребности в энергоресурсах (калориях)/РЭ. Ежедневная потребность в калориях была ниже в группе Ж (17,9 ± 6,3 ккал/кг) по сравнению с группой Г (22,3 ± 4,2 ккал/кг). Уровень триглицеридов и азотный баланс также существенно не отличались между 2 группами. У пациентов группы Ж были отмечены значительно более низкие показатели глюкозы крови (Ж — 7,4 ± 1,6 ммоль/л, Г — 8,7 ± 1,6 ммоль/л) и выработки СО2, показатели минутного объема, сроки пребывания на искусственной вентиляции легких (ИВЛ) (Ж — 13,0 ± 8,9 дня, Г — 20,4 ± 7,0 дня) и в блоке интенсивной терапии (ИТ) (Ж — 17,9 ± 11,2 дня, Г — 25,1 ± 7,0 дня).
Выводы: результаты нашего исследования подтверждают хорошую переносимость ЖЭМО, снижение показателей глюкозы крови, сроков пребывания в блоке ИТ, сроков пребывания на ИВЛ у пациентов, которые получали ЖЭМО, по сравнению с теми, которые получали стандартное парентеральное питание на основе глюкозы.
Оливковое масло, глюкоза крови, жировое парентеральное питание, политравма, ИВЛ, HLA-DR.
Введение
Гипергликемия характерна для пациентов с политравмой [1–5]. В результате гормональных и метаболических изменений у пациентов с политравмой развивается стрессовая гипергликемия, а уровень глюкозы крови на сегодняшний день рассматривается как основной фактор, который обусловливает клинический исход у таких пациентов [1]. При политравме и других тяжелых острых состояниях гипергликемия способствует развитию инфекционных осложнений, полинейропатии, преобладанию процессов ката- болизма, развитию синдрома полиорганной недостаточности (ПОН) и в итоге — смерти пациента [2–5]. Результаты предыдущих исследований подтвердили эффективность терапии в контексте снижения смертности и длительности заболевания, направленной на борьбу с гипергликемией путем снижения уровня глюкозы посредством интенсивной инсулинотерапии у пациентов после хирургических вмешательств [1]. Основной целью данного пилотного исследования было определение эффективности и безопасности применения жировой эмульсии (ЖЭ) на основе масел оливок (ЖЭМО) для парентерального/энтерального питания по сравнению со стандартным парентеральным/энтеральным питанием на основе глюкозы, оценка влияния ЖЭМО на показатели глюкозы крови, длительности искусственной вентиляции легких (ИВЛ) и длительности пребывания в ОИТ. Предполагается более высокая предрасположенность к развитию инфекционных осложнений у пациентов, которые получали для парентерального питания ЖЭ на основе масел соевых бобов (СБ) [7, 8]. Для подтверждения или опровержения данной идеи мы регистрировали все инфекционные осложнения и определяли уровни моноцитов крови и степень экспрессии лейкоцитарного человеческого антигена DR (HLA-DR).
Пациенты и методы
Исходные показатели 33 отобранных для исследования пациентов указаны в табл. 1. Исследование проводилось в период с августа 2001 по декабрь 2002 го- да с одобрения комитета по этике университета Witten/ Herdecke в Германии. Исследование было открытым проспективным и рандомизированным. От доверенного лица и/или родственника пациента получали информированное согласие. Критериями включения больных в исследование были: обширная травма по шкале тяжести травмы от 16 и более, необходимость в проведении ИВЛ, возраст пациента от 18 до 80 лет и срок поступления в стационар не позднее 24 часов с момента получения травмы. По следующим критериям мы исключали пациентов из исследования: нестабильные показатели гемодинамики, молочнокислый ацидоз, нарушение обмена липидов в анамнезе, выраженное ожирение (индекс массы тела > 40), алкоголизм, аллергические реакции на ЖЭ.
Все пациенты, которые принимали участие в исследовании, были включены в него в день получения травмы (0-й день). После проведения отбора пациентов (см. критерии включения) мы получали добровольное информированное согласие, и пациентов слепым методом распределяли в ту или иную группу для получения либо ЖЭ (Ж-группа), либо глюкозного раствора (Г-группа). Парентеральное питание начинали проводить на следующий день после травмы (1-й день исследования) с замещением 50 % потребности в калориях с постепенным увеличением калорийности до 75 % — на 2-й день и до 100 % — на 3-й день исследования. Пациенты из группы Ж получали парентерально ЖЭ с соотношением жиры/глюкоза (% ккал/% ккал энергии небелкового происхождения) на уровне 75/25, оставшиеся 15 пациентов (группа Г) получали стандартное парентеральное питание с соотношением жиры/глюкоза на уровне 37/63. Из других источников (например, растворы для внутривенного введения) пациенты глюкозу не получали. Пациенты обеих групп получали 20 % своих энергетических потребностей посредством парентерального введения аминокислот. Во избежание чрезмерного потребления жирных кислот класса w-6 пациенты группы Ж получали ЖЭ на основе масел оливок (ClinOleic 20%, Baxter, Germany), в группе Г пациенты получали стандартную ЖЭ на основе масел соевых бобов (Lipofundin N 20%, B. Braun, Germany). Парентеральное питание проводили пациентам на протяжении 24 часов непрерывно. Энтеральное питание начинали на 1-й день с ежедневным максимумом калорийности на уровне 5 ккал/кг на протяжении 6 дней. Группа пациентов Ж также получала высшие жиры энтерально, которые содержались в ЖЭ на основе масла оливок (жиры/глюкоза 60/40, Glucerna, Fresenius, Germany), пациенты группы Г получали стандартную диету (жиры/глюкоза 44/56, Fresubin HP energy, Fresenius, Germany). К 6-му дню парентеральное питание уменьшали, а энтеральное наращивали в зависимости от индивидуальной переносимости пациента, связанной с состоянием желудочно-кишечного тракта (ЖКТ). Те же энтеральные диетические продукты пациентам давали на протяжении периода исследования (груп- па Ж — Glucerna, группа Г — Fresubin HP energy). Состояние ЖКТ считалось удовлетворительным, т.е. готовым к проведению полного энтерального питания, когда остаточный объем желудка не превышал 200 мл по прошествии 3 часов от момента дачи энтерального питания. До того момента, когда ЖКТ пациента был готов для получения энтерального питания, они получали питание через зонд струйно (trickle feed — 20 мл энтеральной смеси + 20 мл воды). Энтеральное питание пациентов проводилось с интервалом в 1 час с 8 утра до 10 вечера.
Ежедневную потребность в калориях определяли постоянной непрямой калориметрией (DeltaTrak II, Datex, Finland) на протяжении не менее 8 часов в день с помощью дыхательного теста. На 1-й день исследования калориметрию проводили до начала питания пациента. Пациентов экстубировали после появления спонтанного дыхания на протяжении 24 часов, последние калориметрические измерения проводили с прицелом на следующий день.
Показатели триглицеридов крови измеряли каждое утро, не прекращая парентеральное питание. Уровень глюкозы определяли как средний показатель многочисленных проб, полученных на протяжении дня (минимум трех, максимум — шести) с использованием прибора AVL OMNI 9 (Roche Diagnostics). Когда уровень глюкозы превышал 10 ммоль/л, начинали внутривенное введение инсулина. После снижения уровня глюкозы ниже 10 ммоль/л введение инсулина прекращали. Представленные в виде таблицы результаты измерения уровня глюкозы отражают показатели на протяжении тех дней, когда пациентам вводился инсулин. Азотный баланс рассчитывали как разницу показателей азотных соединений, введенных больному, и показателей азотных соединений, выведенных с мочой на протяжении 24 часов. Уровень продукции диоксида углерода и минутный объем рассчитывали методом постоянной непрямой калориметрии, но лишь тогда, когда пациент был подключен к аппарату ИВЛ.
В ходе исследования часть персонала отделения интенсивной терапии (ОИТ) отвечала за проведение парентерального питания, а часть — за проведение реанимационных мероприятий независимым друг от друга образом. Врач ОИТ не принимал участия в проведении питания. И наоборот, все решения относительно отключения больного от аппарата ИВЛ принимал врач ОИТ вне зависимости от проводимого питания.
Пациенты двух групп существенно не отличались по возрастным показателям, половым признакам, ИМТ, потребностям в трансфузиях, количеству перенесенных хирургических вмешательств или показателям оценочных шкал. Травмы головы и грудной клетки являлись причинами длительного пребывания на аппарате ИВЛ. Показатели тяжести травмы в зависимости от локализации по шкале AIS существенно отличались у пациентов 2 групп в начале исследования (голова: Ж — 3,1 ± 1,7, Г — 2,7 ± 2,1, р = 0,57; грудная клетка: Ж — 2,4 ± 1,8, Г — 2,7 ± 1,8, р = 0,73).
Уровень экспрессии HLA-DR на моноцитах CD14+ определяли на 1, 3, 5, 7 и 14-й день после травмы методом флюороскопии. Для этого мы использовали меченые антитела (белок/флюорофор — 1/1, QuantiBRITE reagents, BD Biosciences, Heidelberg, Germany). Измерение многоуровневых откалиброванных флюоресцентных зон свечения антител позволило нам количественно измерять степень насыщения антигеном поверхности моноцитов. Контрольная группа была представлена 15 здоровыми индивидами в возрасте 32,8 ± 2,8 года (от 23 до 67).
Клинический исход при выписке из ОИТ оценивали по шкале Early Rehabilitation Barthel Index (ERI). Модифицированная шкала ERI позволяет определить необходимость в дальнейшей медицинской или гериатрической помощи, а также степень инвалидизации пациента в баллах от –325 до +100. +100 баллов рассматривается как полное выздоровление, независимость от постороннего ухода при выполнении всех ежедневных обязанностей [9]. Смертельные исходы отмечали через 6 месяцев после получения травмы.
Все значения представлены в виде среднего значения ± стандартное отклонение. Все анализы выполняли при условии добровольного согласия пациентов. Статистический анализ проводили с использованием программного обеспечения SPSS 11.0 (SPSS, Munich, Germany). В графиках представлены значения в виде среднего значения ± стандартная погрешность. Различия в исходных и конечных показателях сравнивали при помощи теста Стьюдента (t), теста Манна — Уитни (U) или теста достоверности Фишера.
Результаты
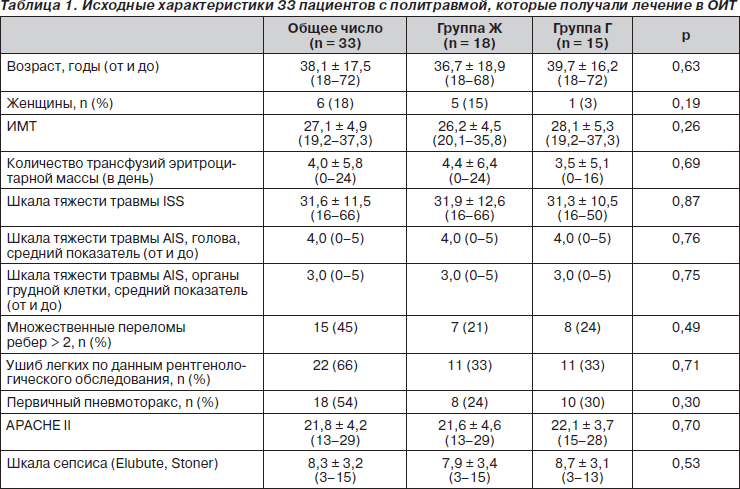
Показатели остаточного и общего расхода энергии (ОРЭ и РЭ на 0-й день), которые определяли в последующие дни, не отличались у пациентов 2 групп (табл. 2). Общее потребление энергии (ОПЭ) (калории) представлено на рис. 1. Существенной разницы в соотно- шении ОПЭ/РЭ не наблюдалось (Ж — 0,75 ± 0,17, Г — 0,86 ± 0,26, р = 0,24). Кумулятивный средний показатель потребления энергии был значительно ниже у пациентов группы Ж (Ж — 17,9 ± 6,3 ккал/кг, Г — 22,3 ± 4,2 ккал/кг, р = –0,03). Также не было зарегистрировано существенной разницы в ежедневном потреблении энергии энтеральным путем у пациентов 2 групп (Ж — 4,5 ± 5,2 ккал/кг, Г — 5,9 ± 4,6 ккал/кг, р = 0,41). 3 пациента не получали энтеральное питание на протяжении первых 3 дней (1 в группе Ж, 2 в группе Г). Уровень ежедневного потребления глюкозы был выше в группе Г и составлял 2,0 ± 0,6 г/кг, а в группе Ж — 0,8 ± 0,3 г/кг, р < 0,001. Потребление амино- кислот также существенно не отличалось у 2 групп (Ж — 0,7 ± 0,2 ккал/кг, Г — 0,8 ± 0,2 ккал/кг, р = 0,17).
8 пациентов были выписаны из ОИТ до 14-го дня (7 в группе Ж, 1 в группе Г). Причинами выписки было улучшение клинического состояния (6 в группе Ж, 1 в группе Г). Один пациент из группы Ж был исключен из исследования в связи с обнаружением у него нарушения обмена жиров (нарушения протокола). Один пациент из группы Ж умер на 3-й день исследования. Количество пациентов, которым ежедневно проводили лечение, представлено на рисунках.
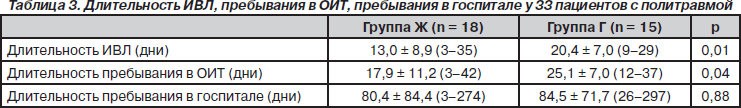
Средний уровень глюкозы крови у пациентов группы Ж был значительно ниже, чем у таковых в группе Г (табл. 2). У пациентов группы Ж эти показатели оставались стабильными на уровне 7 ммоль/л, уровень глюкозы у пациентов группы Г возрос на 4-й день и сохранялся таковым до 11-го дня (рис. 2). В группе Ж 5 из 18 пациентов получали инсулин, а в группе Г — 9 из 15 (р = 0,09). Средняя доза инсулина в группе Ж со- ставила 55,8 ± 46,0 ЕД, а в группе Г — 65,3 ± 42,0 ЕД (р = 0,70). Один из пациентов группы Ж страдал от диабета до получения травмы, и его суточная доза инсулина составляла 90 ЕД (до травмы). Из всех зарегистрированных показателей глюкозы крови на протяжении исследования (n = 380 в группе Ж и n = 412 в группе Г) лишь один был на уровне 3,5 ммоль/л.
Уровни триглицеридов существенно не отличались у пациентов 2 групп (табл. 2). Азотный баланс был отрицательным в обеих группах и не отличался существенно между 2 группами (табл. 2). Уровень продукции диоксида углерода, общий респираторный коэффициент и минутный объем были существенно снижены в группе Ж (табл 2). 4 пациентам группы Ж и 2 из группы Г не проводили непрямую калориметрию. Не было ни одного случая отказа от проведения непрямой калориметрии в связи с высокой концентрацией кислорода во вдыхаемой фракции воздуха при ИВЛ.
Длительность ИВЛ и сроки пребывания в ОИТ были значительно меньше в группе Ж. Инфекционные осложнения также встречались реже в группе Ж (рис. 3). Длительность пребывания в лечебном учреждении существенно не отличалась у пациентов обеих групп (табл. 3). Показатели модифицированной шкалы ERI на момент выписки из учреждения существенно не отличались в обеих группах (Ж — 2,5 ± 120,0, Г — 25,0 ± 64,0, р = 0,99). На протяжении последующих 6 месяцев после получения травмы 4 пациента из группы Ж и 1 из группы Г умерли (р = 0,35). Один из пациентов группы Ж умер на 3-й день в связи с тяжелой травмой головы. Еще один пациент из группы Ж умер от сепсиса после перенесенной бронхо- пневмонии на 19-й день. 2 пациента группы Ж умерли на 41-й и 50-й день, а пациент из группы Г умер на 47-й день в доме престарелых. В оставшихся 3 случаях причина смерти не была установлена.
Уровень экспрессии моноцитарного HLA-DR на момент поступления больных в клинику был значительно ниже по сравнению с контрольной группой (9,890 ± 4,010 АВС против 29,881 ± 8,060 АВС, р < < 0,001). Достоверной разницы в степени экспрессии HLA-DR между группами на момент госпитализации зарегистрировано не было. Временные изменения экспрессии моноцитарного HLA-DR представлены на рис. 4. Экспрессия моноцитарного HLA-DR возросла до предельно высоких значений для здоровых доноров на 14-й день. У пациентов группы Ж уровень экспрессии моноцитарного HLA-DR нарастал значительно быстрее, хотя и статистически незначительно по сравнению с пациентами группы Г.
Обсуждение
Полученные нами данные свидетельствуют о хорошей переносимости ЖЭ на основе оливковых масел у пациентов с политравмой. Наши данные соответствуют ранее полученным данным, которые указывают на снижение показателей глюкозы крови и продукции СО2 [10, 11], а также хорошую переносимость препарата [10–13], уменьшение сроков пребывания на ИВЛ [10] у пациентов в ОИТ, которые получают парентеральное питание с ЖЭ на основе оливковых масел. Также полученные нами данные о сроках пребывания пациентов в ОИТ свидетельствуют о положительном влиянии снижения уровня глюкозы у пациентов с политравмой [1].
Основными причинами перевода пациентов с политравмой на ИВЛ являются: травма органов грудной клетки, краниоцеребральная травма, которые встречаются с одинаковой частотой и могут быть одновременно у таких больных. В нашем исследовании различное влияние нарушений центральной и/или периферической оксигенации не учитывалось. Ранее проведенные исследования подтверждали положительное влияние диеты с высоким содержанием жиров и низким — углеводов на функцию легочной системы, особенно у пациентов с отягощенным анамнезом со стороны легких [14, 15]. В основном же целью проведения ИВЛ у таких больных являлось адекватное обеспечение доставки кислорода и элиминации СО2. Увеличение концентрации СО2 неизменно приводит к увеличению минутного объема [16], повышению риска перерастяжения легких, более высокой смертности и более длительным срокам пребывания на ИВЛ [17]. Таким образом, снижение уровня продукции СО2 является ключевым фактором. В нашем исследовании мы наблюдали снижение показателя образования СО2 на 14 % (95% доверительный интервал (СI) 2–26 %) и снижение минутного объема на 13 % (95% СI 1–25 %). Исходя из расчетного потребления энергии в 2000 ккал в день, у пациентов в нашем исследовании (1500 — парентерально, 500 — энтерально), согласно нашему проколу исследования, дневная продукция СО2 составляла бы 325 и 349 л в группе Ж и Г соответственно (ожидаемая разница в 7 %, 95% CI 6–8 %). Подавая данные в виде соотношения «ожидаемая продукция/фактическая продукция СО2» (хотя и незначительная при 95% CI) и принимая во внимание влияние таких факторов, как тяжесть и область травмы, температура тела, потребление калорий, использование седативных препаратов, мы пришли к выводу, что пациенты группы Ж получали меньше калорий, чем им было необходимо.
Несмотря на более низкие показатели глюкозы в группе Ж (как и ожидалось при более низком ее потреблении), они все равно были выше нормы, оставляя возможность для проведения более агрессивных мероприятий для нормализации данного показателя. Наши исследования по применению ЖЭМО подтвердили незначительное повышение уровня глюкозы у пациентов, которые получали данное парентеральное питание, на уровне 6–8 ммоль/л, что в сравнении с такими показателями у пациентов группы Г — 8–10 ммоль/л — значительно ниже [11, 13]. В исследованиях, в которых для интенсивной терапии использовался инсулин, удалось достичь снижения уровня глюкозы до < 6 ммоль/л [1], что означало нормализацию этого показателя. В исследованиях Tappy и соавт. [11, 18] подтверждено отсутствие зависимости эндогенной продукции глюкозы от экзогенного парентерального [11] или энтерального [18] ее введения у пациентов в ОИТ.
Предполагают, что ЖЭ может влиять на процессы воспаления [19] посредством модуляции процессов метаболической активации, включая продукцию СО2. Механизм этого влияния основан на том, что в зависимости от типа и количества жирных кислот, вводимых в организм, являясь прекурсорами в метаболизме эйкозаноидов, они могут влиять на процессы активации воспалительного каскада. Изменяя соотношение w-6/w-3, мы можем быстро, эффективно и перманентно влиять на воспалительный и иммунный ответ [20]. ЖЭ, которая использовалась в группе пациентов Ж, содержит в своем составе 80 % оливковых масел и 20 % масел соевых бобов. Она целенаправленно была разработана с таким содержанием компонентов, чтобы уменьшить содержание ПНЖК в масле соевых бобов, заменив их на олеиновую кислоту (С18:1n-9). Этот препарат не должен влиять на состав мембран и незначительно влиять на синтез эйкозаноидов и иммунный ответ [21], что обусловлено уменьшенной потребностью в антиоксидантах. У недоношенных новорожденных, которые часто подвержены окислительному стрессу, доказана эффективность ЖЭ на основе МО в процессах улучшения их антиоксидантного статуса [22]. У пациентов группы Ж диета была направлена на уменьшение потребления ПНЖК и увеличение потребления мононенасыщенных жирных кислот.
Частота инфекционных осложнений у пациентов группы Ж была значительно ниже, если сравнивать данные, полученные при использовании ЖЭ на основе масел СБ в ранее проведенных исследованиях [7, 23, 24]. Эти предположения основываются на следующем аргументе: отрицательное влияние на иммунный статус жирных кислот класса w-6 [8, 25] может нивелироваться потреблением жирных кислот класса w-9, которые применяли в нашем исследовании.
Поскольку основной целью данного исследования было определение переносимости назначенной диеты, мы решили определить уровень экспрессии HLA-DR — основного показателя иммунодефицита после тяжелой травмы, вместо того чтобы проводить анализ метаболитов жирных кислот.
В более ранних работах предполагали связь низкой экспрессии HLA-DR и риска развития инфекционных осложнений и клинического исхода [26]. В нашем пилотном исследовании мы не наблюдали существенной разницы в увеличении степени экспрессии HLA-DR в 2 группах, хотя было отмечено определенное положительное влияние ЖЭ на основе МО [19, 27].
В ранее проведенных исследованиях предполагали отрицательное влияние ЖЭ, содержащих длинноцепочечные триглицериды, на функцию ретикулоэндотелиальной системы (РЭС) [28], индукцию гипертриглицеридемии (ГТЭ) и отрицательное влияние на диффузию газов в легких [29]. Нарушения функции РЭС и ГТЭ считают выраженными при критических состояниях, и они часто связаны с постоянным или интервальным введением ЖЭ [30]. Применение непрямой калориметрии с целью определения суточной энергетической потребности и регулирования схемы введения ЖЭ позволяет минимизировать риски передозировки жиров с ЖЭ. Несмотря на достаточно высокую калорийность жиров в применяемой нами ЖЭ, средняя суточная доза жиров 0,03 г/кг в группе Ж была значительно ниже 0,11 г/кг, что некоторые авторы расценивали как токсичную дозу [31]. Отрицательное влияние на диффузию газов в легочной ткани при введении ЖЭ может быть вызвано чрезмерной доставкой прекурсоров простагландинов в виде олеиновой кислоты [30]. Одной из целей нашего исследования было уменьшение потребления линолевой кислоты.
Анализируя данные касательно клинических исходов по модифицированной шкале ERI на момент выписки пациентов из клиники, мы не отметили существенной разницы в балльных оценках среди пациентов 2 групп. Уровень смертности был 12 % (95% CI 1–23 %) и соответствовал аналогичному показателю регистра травм Немецкого общества травматологов (10 %) [32].
Результаты нашего исследования подтверждают хорошую переносимость ЖЭ на основе МО, подтверждают ее влияние на уменьшение уровня глюкозы, сокращение пребывания на ИВЛ, сроков пребывания в ОИТ у пациентов с тяжелой травмой по сравнению со стандартным парентеральным питанием на основе глюкозы. Для подтверждения влияния ЖЭ на клинические исходы заболеваний требуются дальнейшие исследования.
Перевод Константина Кремца
Оригинал статьи опубликован в Intensive Care Medicine, 2005, Volume 31, Number 9, 1202-1208
Berghe G. van den, Wouters P., Weekers F., Verwaest C., Bruyninckx F., Schetz M., Vlasselaers D., Ferdinande P., Lauwers P., Bouillon R. Intensive insulin therapy in the surgical intensive care unit // N. Engl. J. Med. — 2001. — 345. — 1359-1367.
Fietsam R. Jr, Bassett J., Glover J.L. Complications of coronary artery surgery in diabetic patients // Am. Surg. — 1991. — 57. — 551-557.
Gore D.C., Chinkes D.L., Hart D.W., Wolf S.E., Herndon D.N., Sanford A.P. Hyperglycemia exacerbates muscle protein catabolism in burn-injured patients // Crit. Care Med. — 2002. — 30. — 2438-2442.
Ortiz A., Ziyadeh F.N., Neilson E.G. Expression of apoptosis-regulatory genes in renal proximal tubular epithelial cells exposed to high ambient glucose and in diabetic kidneys // J. Investig. Med. — 1997. — 45. — 50-56.
Said G., Goulon-Goeau C., Slama G., Tchobroutsky G. Severe early-onset polyneuropathy in insulin-dependent diabetes mellitus. A clinical and pathological study // N. Engl. J. Med. — 1992. — 326. — 1257-1263.
Huschak G., zur Nieden K., Stuttmann R. Effects of lipid based nutrition on clinical outcome of patients after severe trauma // Clin. Nutr. — 2003. — 22 Suppl. 1. — S1-114.
Heyland D.K., MacDonald S., Keefe L., Drover J.W. Total parenteral nutrition in the critically ill patient: a meta-analysis // JAMA. — 1998. — 280. — 2013-2019.
Yaqoob P. Lipids and the immune response // Curr. Opin. Clin. Nutr. Metab. Care. — 1998. — 1. — 153-161.
Schцnle P.W. The Early Rehabilitation Barthel Index — an early rehabilitation-oriented extension of the Barthel Index // Rehabilitation (Stuttg). — 1995. — 34. — 69-73.
Ol Saady N.M., Blackmore C.M., Bennett E.D. High fat, low carbohydrate, enteral feeding lowers PaCO2 and reduces the period of ventilation in artificially ventilated patients // Intensive Care Med. — 1989. — 15. — 290-295.
Tappy L., Schwarz J.M., Schneiter P., Cayeux C., Revelly J.P., Fagerquist C.K., Jequier E., Chiolero R. Effects of isoenergetic glucose-based or lipid-based parenteral nutrition on glucose metabolism, de novo lipogenesis, and respiratory gas exchanges in critically ill patients // Crit. Care Med. — 1998. — 26. — 860-867.
Kohlhardt S.R., Smith R.C., Kee A.J. Metabolic response to a high-lipid, high-nitrogen peripheral intravenous nutrition solution after major upper-gastrointestinal surgery // Nutrition. — 1994. — 10. — 317-326.
Kohlhardt S.R., Smith R.C., Kee A.J. Metabolic evaluation of a 75% lipid/25% glucose high nitrogen solution for intravenous nutrition // Eur. J. Surg. — 1994. — 160. — 335-344.
Cai B., Zhu Y., Ma Y., Xu Z., Zao Y., Wang J., Lin Y., Comer G.M. Effect of supplementing a high-fat, low-carbohydrate enteral formula in COPD patients // Nutrition. — 2003. — 19. — 229-232.
Sheman M.S. Parenteral nutrition and cardiopulmonary disease // Rombeau J.L., Rolandelli R.H. (eds) Clinical nutrition: parenteral nutrition. — Philadelphia: Saunders, 2001. — Р. 335-352.
Weinberger S.E., Schwartzstein R.M., Weiss J.W. Hypercapnia // N. Engl. J. Med. 1989. — 321. — 1223-1231.
The Acute Respiratory Distress Syndrome Network Ventilation with lower tidal volumes as compared with traditional tidal volumes for acute lung injury and the acute respiratory distress syndrome // N. Engl. J. Med. — 2000. — 342. — 1301-1308.
Tappy L., Berger M., Schwarz J.M., McCamish M., Revelly J.P., Schneiter P., Jequier E., Chiolero R. Hepatic and peripheral glucose metabolism in intensive care patients receiving continuous high- or low-carbohydrate enteral nutrition // J. Parenter. Enteral. Nutr. — 1999. — 23. — 260-267.
Carpentier Y.A., Dupont I.E. Advances in intravenous lipid emulsions // World J. Surg. — 2000. — 24. — 1493-1497.
Endres S., Ghorbani R., Kelley V.E., Georgilis K., Lonnemann G., van der Meer J.W., Cannon J.G., Ro- gers T.S., Klempner M.S., Weber P.C. The effect of dietary supplementation with n-3 polyunsaturated fatty acids on the synthesis of interleukin-1 and tumor necrosis factor by mononuclear cells // N. Engl. J. Med. — 1989. — 320. — 265-271.
Yaqoob P., Knapper J.A., Webb D.H., Williams C.M., Newsholme E.A., Calder P.C. Effect of olive oil on immune function in middle-aged men // Am. J. Clin. Nutr. — 1998. — 67. — 129-135.
Gцbel Y., Koletzko B., Bцhles H.J., Engelsberger I., Forget D., Le Brun A., Peters J., Zimmermann A. Parenteral fat emulsions based on olive and soybean oils: a randomized clinical trial in preterm infants // J. Pediatr. Gastroenterol. Nutr. — 2003. — 37. — 161-167.
Battistella F.D., Widergren J.T., Anderson J.T., Siep- ler J.K., Weber J.C., MacColl K. A prospective, randomized trial of intravenous fat emulsion administration in trauma victims requiring total parenteral nutrition // J. Trauma. — 1997. — 43. — 52-58.
Garrel D.R., Razi M., Lariviere F., Jobin N., Naman N., Emptoz-Bonneton A., Pugeat M.M. Improved clinical status and length of care with low-fat nutrition support in burn patients // J. Parenter. Enteral. Nutr. — 1995. — 19. — 482-491.
Alexander J.W. Immunonutrition: the role of omega-3 fatty acids // Nutrition. — 1998. — 14. — 627-633.
Hershman M.J., Cheadle W.G., Wellhausen S.R., Davidson P.F., Polk H.C. Jr Monocyte HLA-DR antigen expression characterizes clinical outcome in the trauma patient // Br. J. Surg. — 1990. — 77. — 204-207.
Torrinhas R.S., Gidlund M., Goto H., Sales M., Olivie- ra P., Jacintho T.M., Waitzberg D.L. Olive oil based lipid emulsion does not alter the expression of surface molecules with immunological functions on human monocytes/macrophages (MO) // Clin. Nutr. Suppl. — 2002. — 21. — P-040.
Seidner D.L., Mascioli E.A., Istfan N.W., Porter K.A., Selleck K., Blackburn G.L., Bistrian B.R. Effects of long-chain triglyceride emulsions on reticuloendothelial system function in humans // J. Parenter. Enteral. Nutr. — 1989. — 13. — 614-619.
Hwang T.L., Huang S.L., Chen M.F. Effects of intravenous fat emulsion on respiratory failure // Chest. — 1990. — 97. — 934-938.
Driscoll D.F., Adolph M., Bistrian B.R. Lipid emulsions in parenteral nutrition // Rombeau J.L., Rolandelli R.H. (eds) Clinical nutrition: parenteral nutrition. — Philadelphia: Saunders, 2001. — Р. 35-59.
Klein S., Miles J.M. Metabolic effects of long-chain and medium-chain triglyceride emulsions in humans // J. Pa- renter. Enteral. Nutr. — 1994. — 18. — 396-397.
Bardenheuer M., Obertacke U., Waydhas C., Nast- Kolb D. Epidemiologie des Schwerverletzten // Eine prospektive Erfassung der prдklinischen und klinischen Versorgung. Unfallchirurg. — 2000. — 103. — 355-363.