Журнал «Травма» Том 9, №3, 2008
Вернуться к номеру
Использование электростимуляции и хирургической обработки в динамике экспериментального повреждения головного мозга
Авторы: А.П. Энглези - НИИ травматологии и ортопедии Донецкого национального медицинского университета им. М. Горького, Донецк, Украина
Рубрики: Травматология и ортопедия, Хирургия
Разделы: Справочник специалиста
Версия для печати
В эксперименте на белых мышах показано, что в динамике послеоперационной электростимуляции на первую неделю эксперимента имеет место первичная альтерация, направленная на демаркацию и элиминацию некротических масс из очага деструкции, что сопровождается качественным изменением явлений дистрофии в перифокальной зоне. Затем происходит формирование послеоперационной кисты на фоне нормализации перекисных процессов, уровня гидратации мозговой ткани, активации процессов внутриклеточной регенерации.
В експерименті на білих мишах показано, що в динаміці післяопераційної електростимуляції на перший тиждень експерименту має місце первинна альтерація, спрямована на демаркацію й елімінацію некротичних мас із вогнища деструкції, що супроводжується якісною зміною явищ дистрофії в перифокальній зоні. Потім відбувається формування післяопераційної кісти на тлі нормалізації перекісних процесів, рівня гідратації мозкової тканини, активації процесів внутрішньоклітинної регенерації.
Results of experiemnt (at white mouse) are present in this paper. At first week primary alteration, demarcation and elimination of necrotic masses from centre of injury and dystrophy in periphocal zone is observe. Then occurs shaping the postoperative cyst on background of the normalizations peroxide processes, level hydratation of brain issue, activations of the intracellular regenerations.
переменный электрический ток, очаг экспериментальной деструкции головного мозга, хирургическая обработка
змінний електричний струм, вогнище експериментальної деструкції головного мозку, хірургічна обробка
variable electric current, centre experimental brain injury, surgery
В работах [1,2] показано, что при электрическом возбуждении возникает изменение вязко-эластических свойств не только сократимых тканей, но и других возбудимых тканей, в частности нервной. В литературе описано понятие ноотропной физиотерапии, среди которой существует метод трансцеребральной импульсной электротерапии [3,4]. Разновидностью последнего является мезодиэнцефальная модуляция. В ее основе лежит прохождение через срединные структуры головного мозга тока низкой частоты – 70-90 Гц [5]. В модельных экспериментах нами показано, что переменный электрический ток низкой частоты изменяет степень гидратации глобулярного белка [6]. Нейропротекторный эффект тока усиливает энтерально введенный животным сульфат магния [7]. Показано, что переменный электрический ток и трансплантат эмбриональной нервной ткани (ТЭНТ) обладает нейропротекторным эффектом [8]. В эксперименте нами также показано, что низкочастотные переменные электрические токи в зависимости от частоты обладают нейропротекторным действием, снижая степень накопления кальция и повышая степень накопления магния травмированной нервной ткани [9]. Кроме этого, возникает изменение степени дистрофизации нейронов перифокальной зоны очага, происходит уплотнение их цитоплазмы.
Целью нашей работы было исследование применения низкочастотного переменного электрического тока в динамике послеоперационного периода хирургической обработки (ХО) очагов экспериментальной деструкции головного мозга.
Материал и методы
В нашей работе было использовано 120 белых лабораторных мышей. Эксперимент включал в себя: 1) контрольную группу - изолированное применение ХО методикой отмывания мозгового детрита (60 животных); 2) опытную группу - совместное применение ХО и низкочастотной электростимуляции в динамике ЧМТ(60 животных).
Методика нанесения открытой, дозированной травмы и хирургической обработки путем отмывания мозгового детрита и сгустков крови описаны в работе [10].
Источником транскраниальной электростимуляции служил генератор низкой частоты Г 6-28. Генератор давал возможность регулировать силу тока (10 мА) и его частоту (45 Гц). При этом электрический ток пропускали через очаг и поврежденное полушарие транскраниально. Игольчатые электроды вводили поднадкостнично в теменно-височных областях с двух сторон. Время электростимуляции 10 минут. На 7, 14, 30-е сутки животные выводились из эксперимента летальной дозой эфира по 20 животных. Для оценки нейропротекторной эффективности использовали следующие методики: 1) эмиссионного спектрального анализа (ЭСА), 2) исследование полутонких и ультратонких срезов с морфометрическим анализом, 3) биохимический метод оценки активности перекисной и антиперекисной систем – малоновый диальдегид (МДА) и активность каталазы (АК), 4) раздельная мозговая импедансометрия с применением униполярного отведения, 5) ЭМГ от контрлатеральной очагу поражения конечности, 6) ЯМР-спектроскопия гомогенатов мозговой ткани [10]. Эксперименты на животных проводились согласно правилам европейской конвенции защиты позвоночных животных, используемых в научных целях. Все полученные в работе материалы обработаны методами вариационной статистики в пакете Microsoft Excel.
Результаты и обсуждение
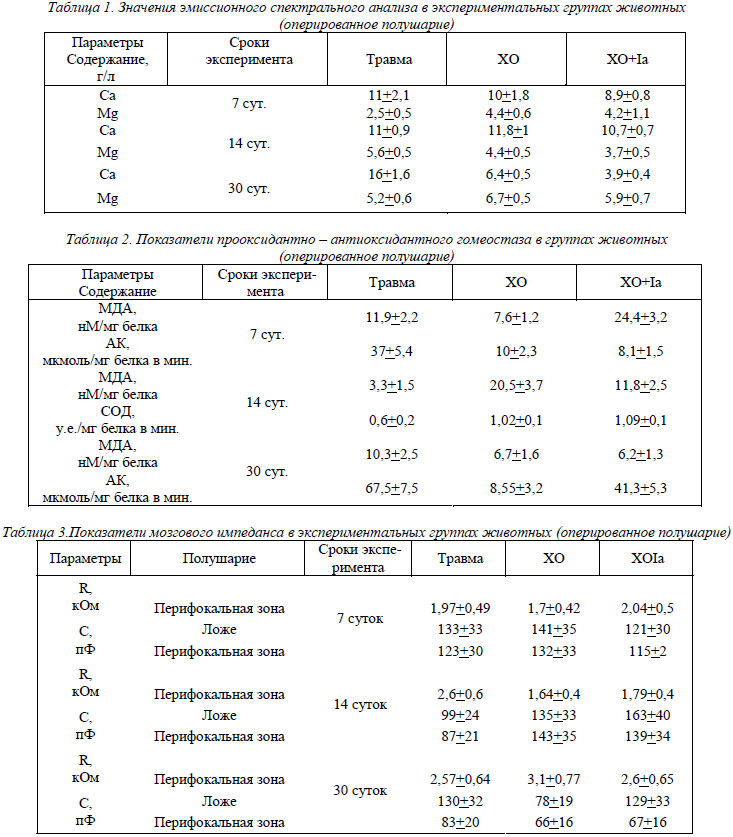
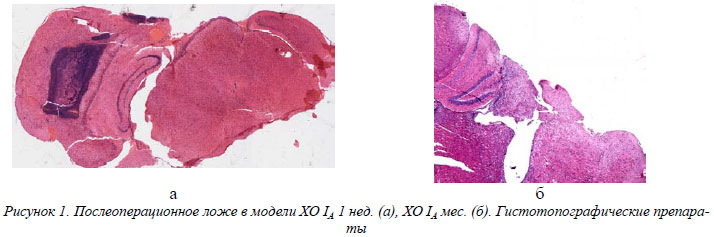
В таблицах 1-3 представлены степени гидратации перифокальных зон, значений прооксидантно – антиоксидантного и ионного гомеостаза в группах животных.
При действии переменного электрического тока через неделю после травмы и операции отмечается обширная пограничная некротическая зона, представленная кагуляционным некрозом (рис. 1а). Отмечается четкая демаркация некротических участков от перифокальной зоны. Появление последней по отношению к контролю объясняет нарастание накопления вторичных продуктов ПОЛ и угнетение активности каталазы (отмечается рост МДА в 3,1 раза и падение АК на 20 %). Имеет место гидратация некротических масс в перифокальной зоне (снижение С на 20 %).
В перифокальной зоне сохраняется периваскулярный отек и вторичные последовательные кровоизлияния. Соотношение нейрон-глия возрастает в 1,2 раза. В старой и новой коре имеют место признаки регенерации корковых нейронов, что находит свое отражение на ЭМГ- амплитуда корково – обусловленной активности (КОА) достигает 120 мкВ. Количество неизмененных нейронов при действии тока не отличается от контроля. Переменный электрический ток приводит к незначительному снижению накопления Са на 20%. Снижение уровня кальция приводит к нормализации водного баланса в перифокальной зоне. В перифокальной зоне послеоперационного ложа имели место процессы дегидратации межклеточных пространств, а клетка гидратировалась до уровня клеточной гидратации нормального мозга (115 пФ). Гидратированные некротические массы в послеоперационном ложе приводят к появлению широкого ЯМР сигнала 179 Гц. На вторую неделю эксперимента отмечается полная элиминация некротических масс из послеоперационного ложа, являвшаяся причиной снижения накопления продуктов ПОЛ (снижение степени накопления МДА на 20%), чем обусловлена дегидратация межклеточных пространств в перифокальной зоне.
Растет соотношение нейрон-глия в 1,5 раза. В перифокальной зоне на 20% снижается количество интактных нейронов. Послеоперационное ложе дегидратируется (рост С в 1,2 раза). Клетка перифокальной зоны передегидратирована - С составляет 139 пФ. Отмечается снижение АК на 70 %, что связано с ее истощением в силу длительного существования некротических масс в очаге. Широкий ЯМР сигнал - 220 Гц - вероятно обусловлен денатурационными процессами в мембранных структурах клеток перифокальной зоны. Данное обстоятельство подтверждается электронно-микроскопическими исследованиями (рис. 2).
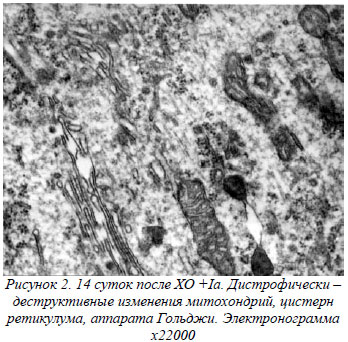
Через месяц после операции и применения переменного электрического тока мы отмечаем значительное снижение степени накопления Са нервной тканью (на 40 %), значительную активацию каталазы (рост в 4,8 раза), что приводит к полной нормализации водного баланса в перифокальной зоне за счет дегидратации передегидратированных клеток (значения С составили 106 пФ) и межклеточных пространств. Усиливается дегидратация послеоперационного ложа (рост С в 1,6 раза). Последнее имеет вид полости, значительно уменьшенной в размерах (рис.1б). Эти данные совпадают с сужением ЯМР сигнала (68 Гц). В перифокальной зоне снижается количество интактных и измененных нейронов, имеют место явления глиоза – рост клеток глии в 1,4 раза. Явления регенерации корковых нейронов (восстановление количества ядерного хроматина на 8-10%, а в цитоплазме нейронов увеличивалось количество свободных и фиксированных рибосом) приводят к появлению КОА с амплитудой до 100 мкВ.
В динамике эксперимента имеет место два максимума накопления МДА – на вторую и четвертую недели эксперимента и рост АК в динамике эксперимента (рис. 3).
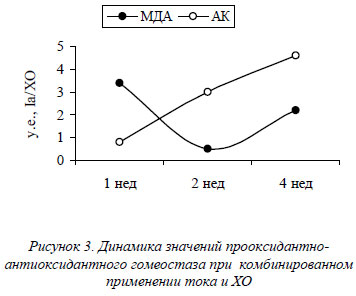
В динамике послеоперационного применения электростимуляции мы выделяем следующие фазы:
- Формирование послеоперационной полости. Первичное увеличение накопления МДА, компенсаторный рост каталазной активности, гидратация клетки оперированного полушария. Таким образом, имеет место первичная альтерация тока, направленная на демаркацию и элиминацию некротических масс из очага деструкции, что сопровождается качественным изменением явлений дистрофии в перифокальной зоне.
- Послеоперационная полость, снижение накопления вторичных продуктов ПОЛ, рост каталазной активности, активация магний накапливающих механизмов, дегидратация МКП и клеток перифокальной зоны. Таким образом, отмечается снижение процессов эксайтотоксичности за счет активации магнийнакапливающей функции, что приводит к антиперекисным процессам. На этом фоне происходит формирование кистозной полости в послеоперационном ложе.
- Послеоперационная киста: снижение кальций-магниевого коэффициента, активация каталазной активности, гидратация межклеточных пространств. Активация белково – синтетических процессов в виде роста процентного содержания хроматина в ядрах, а также роста количества фиксированных и нефиксированных рибосом. Отмечается сочетание процессов альтерации и регенерации, обусловленное длительным применением переменного электрического тока. Кистозная полость сформирована, степень гидратации оперированного полушария нормализуется, однако отмечается нерезко выраженное накопление ионов кальция и вторичных продуктов ПОЛ.
- Аладжалова Н.А.Медленные электрические процессы в головном мозге.- М.: Изд. АН СССР.- 1962.- 240 с.
- Франк Г.М. Биофизика живой клетки. Избранные труды.-М.: Наука, 1982.-336 с.
- Ларионов К.С., Лапшин В.П., Гольдфарб Ю.С. и др. О возможностях применения транскраниальной электростимуляции при неотложных состояниях // Медицина критических состояний.- 2005.- №5.-С.48-53.
- Корпан М.И., Шуфрид О., Чекман И.С., и др Действие электрического тока на на структуру сывороточного альбумина человека // Доп. НАН України.-2001.- №6.-С.65- 109.
- Тайлицин В.И., Коршняк А.В. Применение транскраниальной электростимуляции в лечении больных с психоорганическим и неврологическим синдромами травматического генеза// Украинский вестник неврологии.-1995.-№1.-С.211-213.
- Энглези А.П. Влияние переменного электрического тока и механических колебаний низкой частоты на состояние травмированной нервной ткани и белковых растворов (экспериментально – модельное исследование)// Експеріментальна та клінічна фізіологія і біохімія.- 2005.- № 1.- С. 30-34.
- Энглези А.П. Комбинированное влияние переменного электрического тока и сульфата магния на ионный гомеостаз и патоморфологию очага травматической деструкции головного мозга // Травма.- 2006.- Т. 7, № 1.- С. 153-156.
- Энглези А.П. Комбинированное использование эмбриональной нервной ткани и физических факторов в остром периоде экспериментального ушиба головного мозга // Запорожский медицинский журнал.- 2006.- № 1.- С. 55-58.
- Энглези А.П. Хиженков П.К. Нецветов М.В. Влияние низкочастотных физических факторов на морфологию и ионный обмен в очагах травматической деструкции головного мозга в эксперименте. 1. Переменные электрические токи // Вісник пробл. Біол. і медицини.- 2003.- № 3.- С. 60- 63.
- Энглези А.П., Колесникова Л.И. Нецветов М.В.Хирургическая обработка очагов травматической деструкции головного мозга как способ нейропротекции в остром периоде черепно-мозговой травмы// Вестник неотложной и восстановительной медицины. – 2005. – Т.6,№1.-С.17-20.
- Климовицкий В.Г., Энглези А.П., Бублик Л.А. Изменение динамики течения экспериментального ушиба головного мозга под действием нейротрофического фактора // Нейронауки: теоретические и клинические аспекты.-2007.-Т. 3,№1-2.-С. 22-25.