Журнал «Травма» Том 9, №1, 2008
Вернуться к номеру
Стовбурові клітини строми кісткового мозку: культивування, хондрогенне диференціювання та використання в артрології
Авторы: О.О. Коструб, В.І. Грищенко, О.Ю. Петренко, І.А. Засаднюк, А.І. Правдюк, Н.Г. Скоробогатова, Ю.О. Петренко - Інститут травматології та ортопедії АМН України, Інститут проблем кріобіології та кріомедицини НАН України, Київ, Харків, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
Розглянуто культивування, хондрогенне диференціювання стовбурових клітин строми кісткового мозгу та перспективи використання у артрології.
Рассмотрено культивирование, хондрогенное дифференцирование стволовых клеток стромы костного мозга и перспективы использования в артрологии.
This paper is describe cultivation, chondrogenic differentiation and possible usage in arthrology of marrow’s stem cells.
стовбурові клітини строми кісткового мозку, культивування, хондрогенне диференціювання, дефект суглобового хряща
стволовые клетки стромы костного мозга, культивирование, хондрогенное дифференцирование, дефект суставного хряща
stem cells, marrow, cultivation, chondrogenic differentiation, cartilage defect
Проблема відновлення ушкодженого суглобового хряща, незважаючи на новітні досягненя у розробці консервативних та оперативних методів сучасної ортопедії, залишається далекою від вирішення. Механічні пошкодження суглобового хряща є одними з найчастіших та складають 20-25% від усіх пошкоджень колінного суглоба. Вони стають причиною розвитку деформуючого артрозу внаслідок знижених регенераторних можливостей суглобового хряща [1].
Хрящ синовіального суглоба в основному складається із позаклітинного матриксу та розміщених у ньому хондроцитів, які, власне, і синтезують цей матрикс. У період, коли суглобовий хрящ формується, хондроцити активно діляться, збільшуючи свою кількість та утворюючи позаклітинний матрикс. У цей період дефект хряща може бути компенсована за рахунок проліферації хондроцитів. У дорослої людини мітотична активність хондроцитів значно знижена, а їх функції зазвичай зводяться до синтезу та оновлення власного мікрооточення (матриксу). Тому травматичні пошкодження суглобового хряща у дорослої людини компенсуються, як правило, лише через відновлення хондроцитами міжклітинної речовини та її зміщення в сторону дефекту. Інтерстиціальні репаративні процеси – це лише спроби хондроцитів відновити своє оточення (матрикс). Але ці спроби недостатні для загоєння хірургічного дефекту чи повного відновлення ушкодженої ділянки хряща при патологічному процесі. Утворена тканина має характер фіброзного хряща та не відповідає пружним та механічним властивостям гіалінового хряща [5].
Можливість регенерації суглобового хряща припускається у випадках, коли разом з хрящем пошкоджується субхондральна кісткова пластинка. У такому разі заповнення дефекту суглобового хряща можливе лише за рахунок проліферації стовбурових клітин (СК) субхондральних відділів кісткового мозку.
У випадках пошкодження всіх зон суглобового хряща разом із субхондріальною кісткою в реакцію втягуються судини, формується гематома, яка з часом організується, а грануляційна тканина вростає в зону дефекту суглобового хряща. Доведено, що відновлення дефекту суглобового хряща відбувається за рахунок проліферативних потенцій власне СК, а не хондроцитів хряща [4].
Регенерація таких дефектів відбувається за рахунок мігруючих із субхондріального простору СК строми кісткового мозку, які можуть ділитися та диференціюватися у хондроцити. Але через велику кількість гемопоетичних клітин, складних міжклітинних взаємодій, а також невеликої кількості стовбурових клітин у зоні дефекту регенерат набуває характеру сплолучної тканини чи волокнистого хряща та значно відрізняється від нормального гіалінового хряща за біомеханічними та біохімічними властивостями [2].
Для відновлення ушкодженого суглобового хряща окрім традиційних у світі почали широко використовувати біотехнологічні методики, серед яких найбільшого розповсюдження набув протокол, розроблений Brittberg. Як реципієнт для культивування хондроцитів використовується фрагмент здорової хрящової тканини, яка забирається у хворого за допомогою артроскопічної техніки. Для того щоб звільнити хондроцити від позаклітинного матриксу, фрагмент обробляють колагеназою та трипсином, після чого хондроцити культивуються для досягнення необхідної клітинності. Після хірургічної обробки дефект прикривається клаптем надкісниці, краї якої герметизуються фібриновим клеєм. Суспензія хондроцитів вводиться під сформований клапоть.
Однак, незважаючи на свою розповсюдженість, ця методика має ряд проблемних моментів. Віддалені результати свідчать, що новоутворена тканина не відповідає повністю пружно-біомеханічним властивостям гіалінового хряща. Методика може застосовуватися при обмежених за площею дефектах та лише за умови відсутності у суглобі загальних дегенеративних змін. Хондроцити мають обмежений потенціал щодо культивування, тому для досягнення необхідної кількості інколи необхідно проводити забір більшої кількості здорової хрящової тканини, чим спричинюються додаткові травматичні реакції у суглобі. Для імплантації культури необхідно виконувати артротомію, що є додатковим чинником виникнення у суглобі дегенеративних змін [3, 5]. В останні роки вчені розпочали вивчення можливості застосування для лікування патології суглобового хряща стовбурових клітин строми кісткового мозку, які мають значний потенціал у хондрогенному диференціюванні. СК можуть бути виділені із кісткового мозку, надкісниці, жирової тканини, синовіальної оболонки, скелетних м’язів. Цей тип клітин має здатність диференціюватися в клітини сполучної тканини, зокрема – кістку, хрящ, жир та м’язи, залежно від факторів мікрооточення [5].
Перспективи застосування СК в артрології очевидні у зв’язку з їх практично необмеженим резервом. Забір проводиться без додаткової травми для суглоба, що дає можливість проводити реконструкцію будь-яких за площею дефектів. Висока пластичність цього типу клітин дає можливість відновлювати не тільки ушкоджені ділянки хряща, але й проводити реконструкцію остеохондральних дефектів: так, при використанні двокомпозитних (кальцію фосфат/гіалуронат) носіїв СК відбувається остео- та хондрогенне диференціювання з формуванням остеохондрального комплексу [6].
Вивчається питання щодо використання СК при дегенеративному ураженні суглобового хряща. Окрім того, використання аутологічних СК у клінічній практиці позбавлено ряду етичних та моральних проблем.
Вивчення властивостей та потенційної здатності диференціювання цього типу стовбурових клітин стало можливим завдяки методу культивування, розробленому для стромальних клітин-попередників кісткового мозку
Мета роботи – виділення, експансія в умовах моношарового культивування стромальних клітин-попередників з наступною індукцією хондрогенного диференціювання та аутологічної трансплантації цієї культури хворим із пошкодженням суглобового хряща колінного суглоба та вивченням її впливу на перебіг репаративного хондрогенезу.
Матеріал і методи
Джерелом СК була кісткова спонгіозна тканина хворого, яка забиралася через невеликі розрізи з гребня крила клубової кістки у вигляді циліндрів діаметром 6–8 мм за допомогою інструментарію для мозаїчної хондропластики, чим забезпечувалася малоінвазивність втручання. Клітини кісткового мозку виділяли із кісткової спонгіозної тканини шляхом їх вимивання за допомогою фосфатно-сольового буферу. Суспензію клітин відділяли центрифугуванням при 150 g протягом 10 хв. Ядерні клітини підраховували в камері Горяєва з використанням 3% оцтової кислоти. Клітини культивували в середовищі альфа-МЕМ, доповненої 15% ембріональною сироваткою великої рогатої худоби, 2 мМ L-глутаміна, 50 од/мл пеніциліну та 50 мг/мл стрептоміцину. Першу заміну середовища виконували через 48 год. культивування і далі – через кожні 3 доби.
При досягненні первинними культурами субконфлуентного моношару клітини знімали з культурального пластику за допомогою трипсин-версену (1:4) за стандартною методикою та розсіювали з коефіцієнтом 1:3. Культивували стромальні клітини протягом 3-х пасажів, після чого клітини знімали з культурального пластика, як описано вище. Отриману суспензію переводили в безсироваткове середовище та індукували хондрогенне диференціювання в альгінатних мікроносіях. Для цього клітини осаджували та ресуспендували у 2% розчині альгіната натрію. Потім суспензію покраплинно вносили в 100 мМ розчин CaCl2 та інкубували протягом 10 хв. для полімеризації альгінату. Отримані мікроносії відмивали від надлишку кальцію та додавали до спеціального середовища для індукції хондрогенезу (Cambrex, США), яке вміщає трансформуючий фактор росту β3 (TGF-β3), та культивували при 37ºС та 5% СО2 в чашках Петрі.
Через 3 дні культивування в середовищі індукції хондрогенезу мікроносії з клітинами переводили у безсироваткове середовище. Мікроносії, клітинність яких досягала близько 10 млн. СК строми кісткового мозку вводили пацієнту. Залишок клітин культивували в тому ж середовищі ще протягом 25 діб для підтвердження хондрогенного диференціювання. Середовище змінювали кожні 3 доби.
Для виявлення маркера хондрогенного диференціювання колагену ІІ типу використовували непряму імунофлюорисценцію, для чого використовували первинні антитіла (Chemicon MAB 6b3) у розведенні 1:200 та вторинні антитіла, кон’юговані з флюорисцентною міткою FITC (Dako, rabbit anti-mouse FITC-conjugated). Імунофлюорисценцію вивчали на люмінісцентному мікроскопі Carl Zeiss.
Виконано трансплантацію культури СК строми кісткового мозку 3 хворим із хондромаляцією суглобового хряща ІV стадії. Перед введенням культури СК строми кісткового мозку виконували артроскопічну ревізію, лаваж та дебридмент суглоба. За допомогою шейверної установки видаляли нежиттєздатні фрагменти хряща, ушкоджені частини менісків, виконували abrasio-артропластику склерозованих ділянок кістки. В оголених ділянках субхондріальної кістки виконували остеоперфорацію з інтервалом 4–6 мм.
У післяопераційному періоді іммобілізацію колінного суглоба не застосовували. Хворі з другого дня виконували активні та пасивні рухи в колінному суглобі, також призначали електроміостимуляцію чотириголового м’яза стегна та його ізометричні скорочення.
Альгінатні носії із розміщеними у них СК вводили під артроскопічним контролем через 21 день після дебридменту суглоба.
Іммобілізацію після введення СК застосовували протягом 3 діб, з наступним поступовим збільшенням обсягу рухів протягом 3 тижнів. Дозоване навантаження на хвору кінцівку розпочинали через 2 міс. після введення культури СК, повне – через 3 міс.
Результати та обговорення
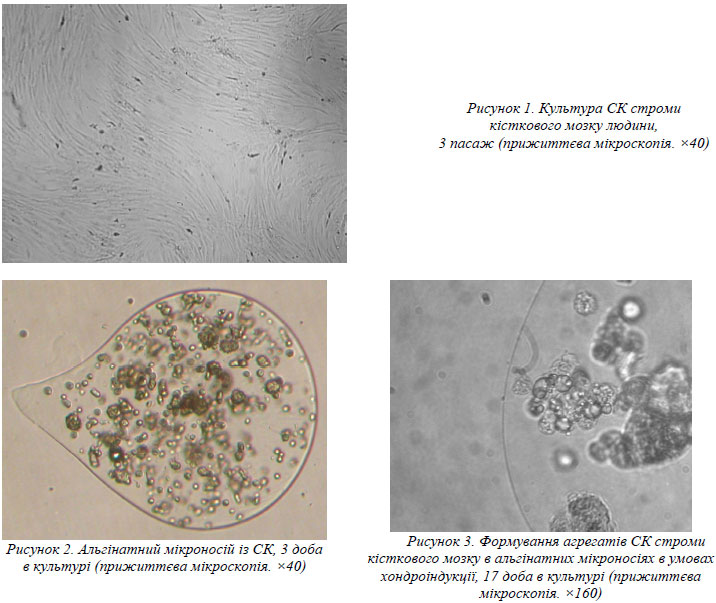
Культивування СК строми кісткового мозку у вищенаведених умовах протягом декількох пасажів призвело до формування практично однорідного моношару, виповненого веретеноподібними клітинами (рис. 1).
Імплантація стромальних клітин кісткового мозку в альгінатні мікроносії не впливала суттєво на їх життєздатність. Розмір мікроносіїв був у межах 500–1000 мкм. Вигляд клітин у мікроносіях через 3 доби культивування наведений на рис. 2. При мікроскопії альгінатних носіїв було виявлено, що починаючи з 3 доби культивування частина клітин формували агрегати, які характерні для процесу хондрогенного диференціювання. На рис. 3 наведений характерний вигляд мікроносія із стромальними клітинами кісткового мозку після 17 діб культивування в хондрогенному середовищі. У деяких мікроносіях спостерігався клоногенний ріст клітин.
При імуннохімічному вивченні стромальних клітин кісткового мозку, культивованих в альгінатних мікроносіях в середовищі для індукції хондрогенезу протягом 28 діб, було виявлено утворення позаклітинного колагену ІІ типу.
Отримані дані свідчать про те, що умови виділення, експансія та наступне культивування СК кісткового мозку в альгінатних мікроносіях в селективному середовищі, яке вміщає TGF-β3, забезпечують хондрогенне диференціювання клітин.
В усіх хворих після введення СК строми кісткового мозку спостерігалися подальша позитивна динаміка, яка проявлялася у поступовому зникненні больового синдрому та проявів синовіїту, розширенні обсягу рухів у суглобі.
Клінічний приклад
Хворий Т., спортивний інструктор, 1979 р.н., госпіталізований у клініку спортивної та балетної травми ІТО АМНУ зі скаргами на біль та обмеження рухів у лівому колінному суглобі, біль посилювався при тривалій ходьбі. Із анамнезу відомо, що хворий отримав травму у 1998 р. під час гри у футбол, діагностовано пошкодження медіальної колатеральної зв’язки лівого колінного суглоба. Лікували гіпсовою пов’язкою протягом 4 тижнів. Через 12 міс. з приводу бокової нестабільності виконано пластику медіальної бокової зв’язки, в післяопераційному періоді застосовували гіпсову іммобілізацію протягом 6 тижнів. Через 8 міс після іммобілізації хворому виконано видалення гвинтів та з приводу згинально-розгинальної контрактури – закриту одномоментну редресацію лівого колінного суглоба. У 2004 та 2005 рр. хворому двічі виконано артроскопічний дебридмент та остеоперфорацію суглобових поверхонь лівого колінного суглоба, які, за словами хворого, суттєвого клінічного ефекту не дали.
При госпіталізації у клініку в хворого за даними рентгенографії виявлено остеоартроз лівого колінного суглоба ІІІ стадії. За даними МРТ – різке стоншення, а місцями повна відсутність суглобового хряща, особливо в опорних зонах суглоба, дегенеративні зміни з боку менісків та передньої хрестоподібної зв’язки, прояви синовіїту. При клінічному обстеженні деформації осі кінцівки та ознак нестабільності суглоба не виявлено. При пальпації виявлено помірний біль по ходу суглобової щілини, більше в медіальних відділах. Обсяг рухів у лівому колінному суглобі – 0/0/105º.
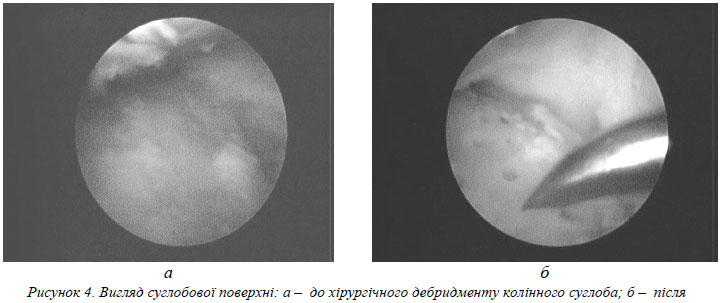
Хворому виконано артроскопічну ревізію лівого колінного суглоба, при якій було виявлено хондромаляцію суглобового хряща ІІІ–IV стадії за Outerbridge, в опорних зонах медіальних відділів суглоба субхондріальна кістка була повністю оголена та склерозована (рис. 4а). Медіальний та частково латеральний меніски були дегенеративно змінені та розволокнені. Також спостерігалася дегенерація передньої хрестоподібної зв’язки. Синовіальна оболонка та капсула суглоба були гіпертрофічно змінені та склерозовані. Після ревізії хворому виконано shaving дегенеративно змінених ділянок менісків та суглобової капсули, а також abrasio оголених ділянок субхондріальної кістки до появи “кров’яної роси”, додатково було виконано остеоперфорацію цих відділів (рис. 4б).
Для культивування ауто-МСК у хворого було виконано забір спонгіозної кісткової тканини з крила лівої клубової кістки. Культивування здійснювалося за методикою, описаною вище.
Через 21 день хворому під артроскопічним контролем було введено 15 млн. ауто-МСК у альгінатних носіях. Післяопераційний період перебігав без ускладнень. Іммобілізацію застосовували протягом 3 діб, з наступним поступовим збільшенням обсягу рухів протягом 3 тижнів. Дозоване навантаження на хвору кінцівку розпочинали через 2 міс. після введення ауто-МСК, повне – через 3 міс. Через 6 міс. після введення ауто-МСК при контрольному огляді хворий скарг не висуває, ексудат у суглобі відсутній, обсяг рухів у лівому колінному суглобі – 0/0/125º. Пряцює за спеціальністю.
Висновки
Попередні результати щодо культивування, хондрогенного диференціювання стовбурових клітин строми кісткового мозку та їх застосування у пацієнтів із травматичними та дегенеративними ушкодженнями суглобового хряща свідчать про їх позитивний вплив на перебіг репаративного хондрогенезу, однак потребують подальшого всебічного вивчення механізмів впливу та потенційних можливостей.
- Белогородцев С. Н., Колосов Н. Г., Самарин Д. М. Использование мезенхимальных стволовых клеток при полнослойных дефектах суставной поверхности // Травматол. и ортопед. России.–2005.–№35.–С. 27–28.
- Corr M., Zvaifler N. J. Mesenchimal precursor cells // Ann. Rheum. Dis. – 2002. – № 61. – P. 3–5.
- Derubeis A., Muraglia A., Mastrogiacomo M., Cancedda R. Human mesenchymal stem/progenitor cells: isolation, characterization and chondrogenic differentiation // Basic science, clinical repair and reconstruction of articular cartilage defects: current status and prospects / Еd. S. Zanasi, M. Brittberg, M. Marcacci. – 2006. – Vol. 2 – P. 773–780.
- Furukawa T., Eyre R., Koide S. et al. Biochemical studies on repair cartilage resurfacing experimental defects in the rabbit knee // J. Bone J. Surg. – 1980. – Vol. 62-A. – P. 79–89.
- Lee J. HpHui E. H. Stem cells in the treatment of partial and full thickness cartilage defects // Basic science, clinical repair and reconstruction of articular cartilage defects: current status and prospects / Еd. S. Zanasi, M. Brittberg, M. Marcacci. – 2006. – Vol. 2 – P. 791–798.
- Zavan B., Cortivo R., Brun P. et al. Hyaluronan-based biopolymers as delivery vehicles for bone marrow-derived mesenchymal progenitors // Basic science, clinical repair and reconstruction of articular cartilage defects: current status and prospects / Еd. S. Zanasi, M. Brittberg, M. Marcacci. – 2006. – Vol. 2 – P. 781–789.