Журнал «Травма» Том 10, №4, 2009
Вернуться к номеру
Изолированное и комплексное влияние транскраниальной низкочастотной электростимуляции совместно с фармакологическими и биологическими методами нейропротекции на состояние перифокальных зон очагов экспериментальной деструкции головного мозга после их хирургической обработки (морфологические аспекты)
Авторы: В.И. Цимбалюк, А.Т. Носов, А.П. Энглези - Институт нейрохирургии АМН Украины им. акад. А.П.Ромоданова, Киев, НИИ травматологии и ортопедии Донецкого национального медицинского университета им. М.Горького, Донецк, Украина
Рубрики: Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
В эксперименте на 80 лабораторных белых крысах показано, что изолированное применение электростимуляции вызывает преимущественно деструктивные и реактивно деструктивные изменения в перифокальной зоне очага деструкции головного мозга после его хирургической обработки. Сочетанное применение электростимуляции и фармакологических факторов приводит к незначительной активации белковосинтетической функции, энергообразующей и синаптической функции нейронов перифокальной зоны. Применение транскраниальной электростимуляции с биологическими факторами приводят к ранней активации метаболической функции нейронов перифокальной зоны с восстановлением ее гисто- и ангоархитектоники к четвертой неделе.
В експерименті на 80 лабораторних білих щурах показано, що ізольоване застосування електростимуляції викликає переважно деструктивні і реактивно деструктивні зміни в перифокальній зоні вогнища деструкції головного мозку після його хірургічної обробки. Спільне застосування електростимуляції і фармакологічних чинників приводить до незначної активації білковосинтетичної функції, енергостворюючої і синаптичної функції нейронів перифокальної зони. Застосування транскраніальної електростимуляції з біологічними чинниками приводять до ранньої активації метаболічної функції нейронів перифокальної зони з відновленням її гісто- й ангіоархітектоніки до четвертого тижня.
In the experiment it is shown on 80 laboratory white rats, that the isolated application of electro-stimulation causes mainly destructive and reactively destructive changes in the periphocal area of destruction of cerebrum after its surgical treatment. Complex application of electro-stimulation and pharmacological factors results in the insignificant activating aluminous to the synthetic function, energy formative also synaptic functions of neurons of periphocal area. Lead application of transcranial electro-stimulation with the biological factors to the early activating of metabolic function of neurons of periphocal area with renewal of it citological and angio-structure the fourth week.
транскраниальная низкочастотная электростимуляция, трансплантация эмбриональной нервной ткани, нейротрофины
транскраніальна низькочастотна електростимуляція, трансплантація ембріональної нервової тканини, нейротрофіни
transcranial electrical stimulation, transplantation of embryonic nervous tissue, neurotrophic factors
В ряде работ показано, что при электрическом возбуждении возникает изменение вязко-эластических свойств не только сократимых тканей, но и других возбудимых тканей, в частности нервной [1-3]. В современной медицинской практике электротерапия занимает одно из основных мест в физической медицине [4, 5]. В модельных экспериментах нами показано, что переменный электрический ток низкой частоты изменяет степень гидратации глобулярного белка [6]. В эксперименте нами также показано, что низкочастотные переменные электрические токи в зависимости от частоты обладают нейропротекторным действием, снижая степень накопления кальция и повышая степень накопления магния травмированной нервной ткани [7]. Кроме этого возникает изменение степени дистрофизации нейронов перифокальной зоны очага, происходит уплотнение их цитоплазмы. Нейропроткекоторный эффект тока усиливает энтерально введенный животным сульфат магния [8]. Показано, что переменный электрический ток и трансплантация эмбриональной нервной ткани (ТЭНТ) обладает нейропротекторным эффектом [9].
Целью нашей работы было исследование изолированного и комбинированного с фармакологическими и биологическими факторами нейропротекции влияния низкочастотного переменного электрического тока на состояние перифокальной зоны после хирургической отработки очагов экспериментальной деструкции головного мозга.
Материал и методы
В нашей работе было использовано 80 белых лабораторных крыс. Контрольные группы – интактные животные – по 5 животных, животные с открытой дозированной ЧМТ – по 15 животных. Опытные группы: 1) совместное применение хирургической обработки и низкочастотной электростимуляции в динамике ЧМТ- 15 животных; 2) совместное применение ХО, СМ и низкочастотной электростимуляции в динамике ЧМТ- 15 животных; 3) совместное применение ХО, ТЭНТ и низкочастотной электростимуляции – 15 животных; 4) совместное применение ХО, трофина и низкочастотной электростимуляции - 15 животных. Вышеприведенные группы разделяли на три подгруппы (по 5 животных) в зависимости от экспериментальных сроков – 7, 14 и 30 суток.
Методика нанесения открытой дозированной травмы и хирургической обработки путем отмывания мозгового детрита и сгустков крови описаны в работе [10]. В качестве экспериментальной нейропротекторной терапии использовался кальциевый блокатор – сульфат магния (10 % р-р энтерально), пирацетам (2% р-р 0,1 мл парентерально), альфа-липоевая кислота (парентерально в дозе 60 мг). После нанесения травмы по вышеописанной методике производили ХО с последующей трансплантацией ЭНТ. Беременным самкам на последней неделе беременности под эфирным наркозом производили кесарево сечение, выделяли эмбрионы. Последним производили краниотомию, а затем извлекли головной мозг. Выделяли участки сенсомоторной коры размером 1х1 мм, которые помещались в стерильный физиологический раствор. Выделенный эмбриональный материал помещался в мозговую рану после удаления первичного травматического субстрата.
После создания открытой дозированной проникающей ЧМТ и ХО методом отмывания мозгового детрита и сгустков крови опытным животным вводили в послеоперационном периоде внутрибрюшинно один раз в трое суток препарат «Трофин» в дозе 0,16 мл. Животных на седьмые, четырнадцатые и тридцатые сутки после операции выводили из эксперимента, вскрывали полость черепа и извлекали головной мозг.
Источником транскраниальной электростимуляции служил генератор низкой частоты Г 6-28. Генератор давал возможность регулировать силу тока (10 мА) и его частоту (45 Гц), при этом электрический ток пропускали через очаг и поврежденное полушарие транскраниально. Игольчатые электроды вводили поднадкостнично в теменно-височных областях с двух сторон. Время электростимуляции 10 минут.
Для электронно-микроскопического исследования брались участки мозгового вещества из корково-подкорковой области на стороне поражения. Материал фиксировался в 1%-ном растворе осмиевой кислоты и 2,5%-ном растворе глютаральдегида на фосфатном буфере с последующей дофиксацией в 1%-ном растворе осмиевой кислоты. Дегидратация в спиртах по нарастающей концентрации с дальнейшим заключением в эпон-аралдит. Контрастирование проводили раствором уранил-ацетатом. Из эпоксидных бликов изготавливали ультратонкие срезы при помощи микротома Райхерд (Германия) и ЛКБ (Швеция). Анализировали полутонкие и ультратонкие срезы. Срезы просматривали в электронном микроскопе ЕМ – 400 Т Фирмы Philips (Голландия). Полутонкие срезы из эпоксидных блоков толщиной до 1 мкм окрашивали метиленовым синим и просматривали в микроскопе «Оптон» Германия. Производили изготовление микрофотографий и морфометрические исследования. Идентификацию процессов в ткани головного мозга проводили путем морфометрической обработки полутонких срезов (гистологическое исследование) и электронограмм с использованием системы анализатора изображений ИБАС-2000 фирмы «Оптон». Проводился морфометрический анализ. Подсчитывали абсолютное количество или процентное соотношение в 100 клетках, наблюдаемое в 10 полях зрения микроскопа интактных, патологически измененных нейронов и глиальных клеток. Индекс нейрон – глия подсчитывали как отношение общего количества нейронов к количеству глиальных клеток. Диаметр микрососудов определяли на тех же участках, где подсчитывали клетки. Электронограммы обрабатывали по следующей схеме:
- процентное содержание хроматина в ядрах нейронов определялись из расчета на 10 ядер на 1 наблюдение в каждой исследуемой группе животных;
- соотношение площади митохондрий к площади участка цитоплазмы определяли из расчета 10 произвольно выбранных участков цитоплазмы в 10 нервных клетках в каждой исследуемой группе животных;
- в синапсах определяли соотношение длины активной зоны синапса к общей длине контакта. Для расчета брали 10 синаптических контактов у животных каждой группы. Аналогичным способом исследовали количество синаптических везикул в пресинапсе.
Для оценки морфофункционального состояния ткани головного мозга мы проводили морфологические и морфометрические исследования.
Все полученные в работе материалы обработаны методами вариационной статистики в пакете Microsoft Excel.
Результаты и обсуждение
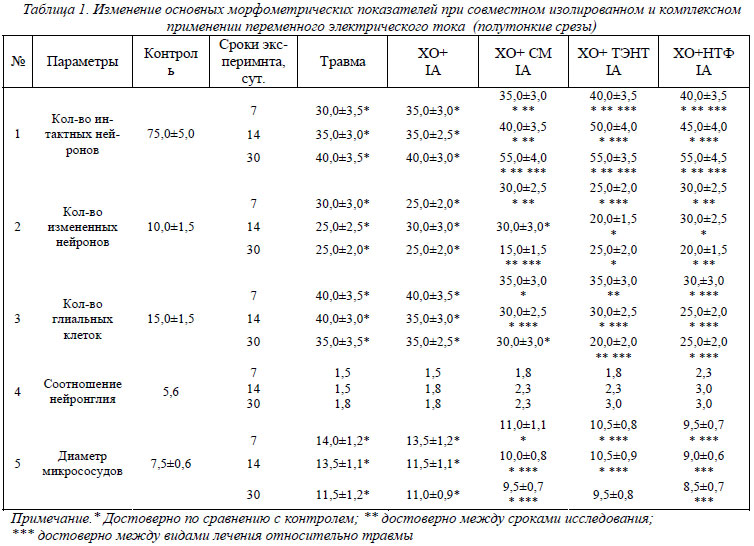
Как видно из таблиц 1 и 2, при изолированном применении тока количество интактных нейронов практически не отличается по сравнению с контролем ЧМТ. При добавлении в экспериментальную схему лекарственных веществ только на четвертую неделю послеоперационного периода имеет место их рост по сравнению с контролем ЧМТ в 1,37 раза. При совместном использовании тока и НТФ или ТЭНТ отмечено увеличение количества интактных нейронов с первой недели послеоперационного периода и в дальнейшем в ходе эксперимента по сравнению с контролем ЧМТ в 1,37 раза. Количество измененных нейронов при изолированном применении тока снижается по сравнению с контролем ЧМТ на 30%. Однако на вторую неделю отмечено повышение их количества по сравнению с обоими контролями в 1,2 раза. Имеет место снижение количества дистрофически измененных нейронов на четвертую неделю эксперимента (на 20%). При введении в экспериментальную схему лекарственных веществ отмечен рост измененных нейронов с первой по четвертую неделю эксперимента в 1,2 раза в остром послеоперационном периоде. Затем их количество возросло в 1,5-1,8 раза. На тридцатые сутки ТЭНТ + IА приводит к снижению количества измененных нейронов на 20% по сравнению с контролем ХО. Нейротрофины + IА приводят к росту количества измененных нейронов в 1,2 раза в течение первой-второй недели эксперимента, затем происходит их снижение на 30 - 40%.
Что касается глиальной реакции, то при изолированном применении IА отмечается ее снижение на 20% по сравнению с обоими контролями на вторую и четвертую недели экспериментов. При введении в экспериментальную схему лекарственных веществ имеет место снижение количества глиальных клеток во все экспериментальные сроки на 20-30%, максимальное их снижение отмечено в группе животных, где ток применялся совместно с нейротрофическим фактором (НТФ). В данном случае происходило снижение глиальной реакции по сравнению с обоими контролями на 30-40% на протяжении всего послеоперационного периода. Соответственно этому индексы нейрон – глия были минимальными при изолированном применении тока – 1,5–1,8, максимальное его значение имело место при совместном применении тока и биологических факторов нейропротекции – 1,8–3.
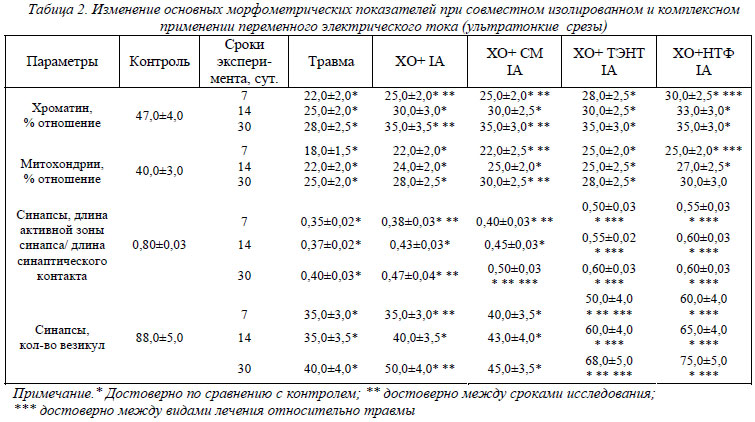
При изолированном применении IА отмечено, что диаметр внутримозговых капилляров не отличался от контрольных значений – сохранялась посттравматическая вазодилятация. При введении в экспериментальную схему лекарственных веществ и ТЭНТ отмечалось уменьшение диаметра микрососудов по сравнению с контролем «Травма» на 22-28%. Нейротрофины и ток снижал диаметр капилляров в поврежденной нервной ткани на 27-44% по сравнению с контролем «Травма». Электростимуляция и совместное применение IА и СМ приводит к росту соотношения ядерного хроматина к площади нуклеоплазмы со второй недели эксперимента в 1,2 раза по сравнению с контролем «Травма». При введении в схему ТЭНТ отмечается рост данного показателя в 1,25-1,27 раза, а при введении в схему НТФ – в 1,36 раза по сравнению с контролем «Травма».
Изолированное применение IА и совместное применение с СМ практически не приводит к увеличению площади, занимаемой митохондриями в цитоплазме нейронов. При применении тока и ТЭНТ отмечено увеличение этого показателя в ранний послеоперационный период в 1,38 раза на первую неделю эксперимента по сравнению с контролем «Травма». Нейротрофины и ток приводят к активации энергообразующей функции нейронов на протяжении всего послеоперационного периода (в 1,38-1,2 раза по сравнению с контролем «Травма»). Что касается синаптического аппарата, то в коре головного мозга при IА воздействии не отмечается снижение степени выраженности его дистрофических изменений в раннем послеоперационном периоде, только через месяц эксперимента имеет место увеличение синаптических везикул в пресинапсе в 1,25 раза по сравнению с контролем «Травма». При совместном применении IА и СМ по сравнению с контролем «Травма» отмечен рост длины активной зоны синапса к площади синаптического контакта в 1,25 раза на первую и вторую неделю эксперимента. При совместном применении тока и ТЭНТ по сравнению с контролем «Травма» имеет место рост этого показателя в 1,48-1,5 раза на протяжении всего экспериментального срока. При совместном применении нейротрофинов и тока отмечена значительная активация синаптической функции - рост длины активной зоны синапса к площади синаптического контакта на протяжении всего экспериментального срока в 1,5-1,6 раза.
Таким образом, при изолированном применении транскраниальной электростимуляции в течение первой недели послеоперационного периода в перифокальной зоне имеют место преимущественно деструктивные процессы, так как действие его направлено на изменение физико- химического состояния некротических масс и степени их демаркации. При введении в экспериментальную схему медикаментов отмечены деструктивно-реактивные изменения нейронов и глии перифокальной зоны, явления незначительной активации их энергообразующей функции. Отмечены явления глиоза и вазопареза в перифокальной зоне. Основные морфофункциональные показатели нейронов перифокальной зоны снижены и составляют 47-55% от значений интактного мозга. При применении тока и биологических факторов имеют место реактивные изменения нейронов и глии с признаками активации энергообразующей и белковосинтетической функции нейронов, а также синаптической функции нейронов. Причем при применении ТЭНТ и тока отмечен рост количества интактных нейронов в 1,33 раза, площадь, занимаемая хроматином в нуклеоплазме, возрастает в 1,27 раза, а площадь, занимаемая митохондриями, в 1,38 раза. Повышается соотношение длины активной зоны синапса к общей длине контакта в 1,42 раза. Достоверно растет синаптическая функция. Основные морфофункциональные показатели нейронов перифокальной зоны составляют 53-60% от значений интактного мозга. На вторую неделю эксперимента при изолированном токовом влиянии деструктивные изменения в перифокальной зоне сохраняются. Значения энергообразующей, белковосинтетической и синаптической функции не отличаются от контроля «Травма» или находится ниже последнего, однако имеет место рост количества интактных нейронов и снижение диаметра микрососудов по сравнению с контролем «Травма». При введении в эксперимент фармакологических факторов отмечена незначительная активация белковосинтетической, энергообразующей и синаптической функции. Основные морфофункциональные показатели нейронов перифокальной зоны снижены и составляют 63-74% от значений интактного мозга. При применении тока и биологических факторов на вторую неделю отмечены реактивные изменения нейронов и глии, дистонические явления в микроциркуляторном русле, преимущественное восстановление синаптической функции.
На четвертую неделю эксперимента при изолированном применении электростимуляции сохраняются преимущественно деструктивно – реактивные изменения в перифокальной зоне. При введении в эксперимент медикаментозной схемы отмечены явления незначительной активации белковосинтетической функции, энергообразующей и синаптической функции. Основные морфофункциональные показатели нейронов перифокальной зоны снижены и составляют 63-74% от значений интактного мозга. Использование биологических факторов и тока приводит к восстановлению гисто- и ангоархитектоники перифокальной зоны.
Основные морфо функциональные показатели нейронов перифокальной зоны составляют 73-85% от значений интактного мозга.
Выводы
1. Изолированное применение электростимуляции вызывает преимущественно деструктивные и реактивно-деструктивные изменения в перифокальной зоне очага деструкции головного мозга после его хирургической обработки.
2. Сочетанное применение электростимуляции и фармакологических факторов приводит к незначительной активации белковосинтетической функции, энергообразующей и синаптической функции нейронов перифокальной зоны.
3. Применение транскраниальной электростимуляции с биологическими факторами приводят к ранней активации метаболической функции нейронов перифокальной зоны с восстановлением ее гисто- и ангоархитектоники к четвертой неделе.
- Франк Г.М. Биофизика живой клетки. Избранные труды//М.: Наука, 1982.- 336с.
- Аладжалова Н.А.Медленные электрические процессы в головном мозге.- М.: Изд. АН СССР.- 1962.- 240 с.
- Насонов Д.Н. Местная реакция протоплазмы на распостраняющееся возбуждение – М - Л.: Изд. АН СССР.- 1959.- 200 с.
- Орехова Э.М. Современные аспекты восстановительной медицины и медицинской реабилитации в косметологии// Тезисы первого международного конгресса «Восстановительная медицина и реабилитация 2004». -М., 2004.- С. 241.
- Кочетков А.В., Орехова Э.М., Арьков В.В. Электро- и электромагнитотерапия в реабилитации больных с закрытой черепно-мозговой травмой// Вопросы курортологии, физиотерапии и лечебной физической культуры.–2000.–№1.–С.46– 51.
- Энглези А.П Влияние переменного электрического тока и механических колебаний низкой частоты на состояние травмированной нервной ткани и белковых растворов (экспериментально–модельное исследование)// Експеріментальна та клінічна фізіологія і біохімія.- 2005.- № 1.- С. 34-35.
- Энглези А.П. Хиженков П.К. Нецветов М.В. Влияние низкочастотных физических факторов на морфологию и ионный обмен в очагах травматической деструкции головного мозга в эксперименте. 1. Переменные электрические токи// Вісник пробл. Біол. і медицини.- 2003.- № 3.- С. 60- 63.
- Энглези А.П. Комбинированное влияние переменного электрического тока и сульфата магния на ионный гомеостаз и патоморфологию очага травматической деструкции головного мозга// Травма.- 2006.- Т. 7, № 1.- С. 153-156.
- Энглези А.П. Комбинированное использование эмбриональной нервной ткани и физических факторов в остром периоде экспериментального ушиба головного мозга // Запорожский медицинский журнал.- 2006.- № 1.- С. 55-58.
- Энглези А.П.,Колесникова Л.И. Нецветов М.В. Хирургическая обработка очагов травматической деструкции головного мозга как способ нейропротекции в остром периоде черепно – мозговой травмы// Вестник неотложной и восстановительной медицины.– 2005.– Том 6, № 1.-С. 17–20.