Журнал «Травма» Том 10, №3, 2009
Вернуться к номеру
Лучевая терапия в практике металлополимерного эндопротезирования длинных костей
Авторы: Ю.А. Гребенюк, С.А. Ткаченко, Е.А. Солоницын - Донецкий национальный медицинский университет им. М. Горького, Донецк, Украина
Рубрики: Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
Экспериментальным путем доказана возможность и перспективность применения послеоперационного лучевого воздействия на сохраненные ткани, окружавшие опухолевый очаг после его удаления и замещения костного дефекта металлополимерным имплантатом. Результаты экспериментального исследования внедрены в клиническую практику.
Експериментальним шляхом доведена можливість і перспективність застосування післяопераційного променевого впливу на збережені тканини, що оточували пухлинне вогнище після його видалення й заміщення кісткового дефекту металополімерним імплантатом. Результати експериментального дослідження впроваджені в клінічну практику.
Experimentally proved the possibility and prospects of the use of postoperative radiation effects on the conservation of tissue surrounding the tumor center after its removal and replacement of the bone defect metal implant. The results of experimental research are inculcated in clinical practice.
лучевая терапия, длинная кость, металлополимерное эндопротезирование
променева терапія, довга кістка, металополімерне ендопротезування
radiotherapy, long bone, metal-polymer arthroplasty
С появлением искусственных заменителей костной ткани немалую значимость приобретает проблема патоморфологических изменений в тканях пациента на границе с имплантатом, в том числе, в условиях лучевого воздействия. Теоретически сохранение жизнеспособности клеток костной ткани вполне вероятно, что обусловлено особенностью их трофики. Однако, имеющиеся в литературе сведения о реакции тканей реципиента на комбинированное воздействие весьма противоречивы [1]. Так, например, в опытах на животных Ewald с соавт., Manley с соавт. показали неблагоприятное влияние метилметакрилата на суставной хрящ. Резонно предположение об усугублении патоморфологических изменений при добавлении лучевого компонента воздействия. В то же время по данным других авторов отрицательного эффекта не отмечено ни в опытах in vivo, ни в клинике. Следует подчеркнуть, что при проведении этих экспериментальных и клинических исследований не ставилась задача определения корреляции резорбтивного воздействия металлополимерного импланта и местных проявлений лучевого воздействия.
Большинство онкологических больных, которым выполнены органосохраняющие операции, нуждаются в послеоперационной лучевой терапии. Очевидно, что металлические имплантаты, находясь в поле облучения, могут «возмущать» его, изменяя пространственное распределение плотности потока и дозы [2]. Влияние естественных неоднородностей на распределение суммарной очаговой дозы должно учитываться при планировании лучевой терапии. Однако для искусственных материалов такой учет в настоящее время затруднен из-за малой изученности проблемы.
Цель исследования: показать возможности и перспективы применения лучевой терапии в комбинированном лечении опухолей длинных костей после металлополимерного эндопротезирования.
Материал и методы
Первый этап исследований предполагал оценку электрохимической совместимости традиционных металлополимерных имплантатов при их контакте в биологической среде [2], исследование методом конечных элементов напряженно деформированного состояния имплантатов, соединяющих костные отломки, исследования механических свойств имплантатов [3].
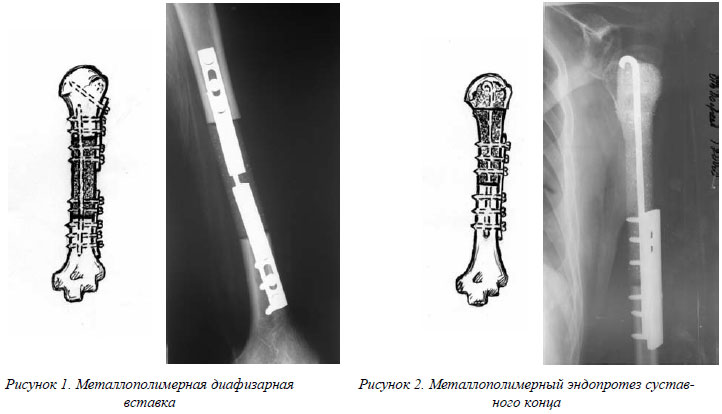
На основании полученных данных метилметакрилат был сертифицирован (токсикологическое заключение ВНИИМТ МЗ СССР № 51). Были разработаны оригинальные конструкции имплантатов для соединения костных отломков и замещения костных дефектов после удаления опухолей, разработаны методики замещения суставных, околосуставных и диафизарных костных дефектов и методики соединения костных отломков и металлополимерных имплантатов (рис. 1,2).
С целью устранения существующих противоречий между радиологами и ортопедами относительно возможности применения послеоперационного лучевого воздействия на опухолевый очаг нами были проведены экспериментальные исследования.
Предметом для изучения стали диафизарные части бедер крыс после внедрения металлополимерных инплантов, не имевшие макроскопических признаков дегенеративно-дистрофических изменений во время аутопсии. Время экспозиции после имплантации и курса послеоперационной телегамматерапии в суммарной очаговой дозе 24 Гр составляло 3 месяца. Был проведен анализ изменений в нормальных тканях (кожа, фасции, мышцы, сосуды, нервы, кость) на границе с металлополимерными имплантатами. Методами исследований являлись гистологический, электронной микроскопии, математический.
Препараты окрашивались гематоксилин-эозином, по Ван-Гизону - на наличие коллагена, посредством PAS (ШИК) реакции для определения содержания несульфатированных (ph – 2.6) и сульфатированных (ph – 1.0) гликозаминогликанов. Исследования проводились в сотрудничестве с радиологическим отделением Донецкого городского противоопухолевого центра и кафедрой патологической анатомии ДонНМУ.
Результаты и обсуждение
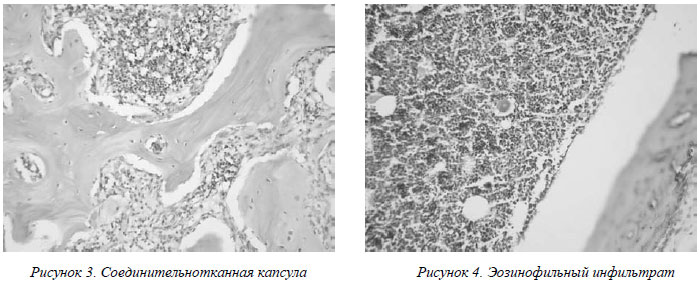
Морфологические изменения в месте стояния имплантата характеризуются новообразованием соединительной ткани разной степени зрелости с хорошо сохраненным костным мозгом (рис. 3). Степень зрелости соединительной ткани зависит от удаленности от имплантата и кости (молодая, богатая клетками, соединительная ткань – вблизи имплантата, более зрелая, с нарастанием содержания коллагена – на периферии). В единичных случаях между мышцами определялось аллергическое воспаление, скопления тучных клеток (рис.4). Отмечено сниженное содержание гликогена в ближайшем к имплантату мышечном слое. Однотипным изменением является разрастание соединительной ткани.
Полученные нами данные нашли воплощение в клинической практике. У больных со злокачественными опухолями длинных костей в послеоперационном периоде мы применяли высокоэнергетическое излучение, получаемое с помощью гамматерапевтических аппаратов типа "АГАТ-Р1", линейных ускорителей. Телегамматерапия предусматривала подведение к опухоли доз порядка 40-60 Гр в течение 6-8 недель.
Для повышения эффективности проводимой лучевой терапии в некоторых наблюдениях использовали турникетную гипоксию. Жгутовая методика вызывает стойкую гипоксию опухоли и местных тканей и таким образом устраняет эффект, связанный с неравномерностью оксигенации опухолевой и здоровой ткани. Использование данной методики позволяет подвести к очагу поражения дозу в 80-100 Гр.
Проведен ретроспективный анализ комбинированного лечения 168 пациентов с опухолями опорно-двигательного аппарата в возрасте от 18 до 75 лет (77 мужчин и 91 женщина), которым во время операций были установлены различные по форме и размерам металлополимерные конструкции, а в послеоперационном периоде осуществлялась дистанционная гамма-терапия в режиме стандартного курса.
Лучевое воздействие на область, где были установлены металлополимерные импланты, чаще всего проводили из-за условно радикального характера выполненных органосохраняющих операций.
Послеоперационный курс лучевой терапии проводили также при изменении морфологического диагноза в сторону «злокачественного» или в целях предупреждения местного рецидива опухоли.
Судьба пациентов и наблюдавшиеся лучевые изменения нормальных тканей в зоне облучения прослежены в различные сроки (от 6 месяцев до 7 лет) после окончания лечения в 63 случаях. Постлучевые изменения проявлялись в виде выраженной гиперпигментации кожи, склероза подкожной клетчатки и мягких тканей в зоне облучения, которой соответствовало расположение имплантов, причем степень выраженности этих изменений не отличалась от тех, которые наблюдались у пациентов, получавших исключительно консервативное лечение.
Выводы
Таким образом, мы утверждаем, что наличие металлополимерного имплантата не только не является противопоказанием к проведению послеоперационного лучевого воздействия на опухолевый очаг, но, напротив, его применение позволяет в короткие сроки после операции приступить к проведению курсов послеоперационной лучевой терапии и способствует профилактике местных рецидивов заболевания и улучшению качества жизни.
Изменения в месте стояния имплантата связаны исключительно с резорбтивным влиянием полиметилметакрилата, не отмечено их корреляционной взаимосвязи с проведенным лучевым воздействием на очаг в послеоперационном периоде.
- Котляр A.M., Севидова Е.К., Стеглик Т.В. Об изменении токов коррозионных элементов конструкций при их механической депассивации //Физико-химическая механика материалов.-1991.-№1.-С. 103-105.
- Кондратьева А. П. Лучевая терапия злокачественных опухолей. // РМЖ. 1998. № 10. С. 628-633.
-
Лучевая терапия злокачественных опухолей: Руководство.
/ Под ред. проф. Е. С. Киселевой. М.: Медицина, 1997. 532 с. - Кныш И.Т. Комбинированное лечение злокачественных опухолей костей. В кн.: Комплексное лечение опухолей костей. К.: Здоров'я. 1979. с.207-222.
- Мусабаева Л.И., Лисин В.А с соавт. Лучевая терапия больных с опухолями опорно-двигательного аппарата после органосохраняющих операций с имплантатами из немагнитных сплавов // Медицинская радиология и радиационная безопасность. – 2003, Том 48, №2 – с.56-62.
- Трапезников Н.Н., Цуркан A.M. //В кн.: Сберегательные и сберегат.-восстановительные операции при опухолях костей.- Кишинев, 1989.- 197 с.
- Тяжелов А.А., Чуйко А.Н., Рами М.А. Абу Хамди Самара Исследование напряженно-деформированного состояния системы кость-фиксатор на модели остеосинтеза бедренной кости // Травма 2003. - Том 4. - №1.- С.30-36.
- Тяжелов А.А., Михайлов СР., Суббота И.А., Рами М.А. Абу Хамди Самара Биомеханические исследования механических свойств жесткой и упруго-стабильной моделей остеосинтеза // Ортопедия, травматология и протезирование. - 2003. - № 2. - С.61-66.
- Опухоли костей: Руководство для студентов и врачей /Под ред. проф. В.А. Бабоши, проф. Ю.В. Думанского, проф. В.Г. Климовицкого. – Донецк: ДНМУ; ООО Полиграфическое предприятие «Крылья», 2008. – 192 с.