Журнал «Травма» Том 12, №1, 2011
Вернуться к номеру
Хирургическое лечение патологических переломов длинных костей конечностей на фоне метастазов гипернефроидного рака почки
Авторы: Бабоша В.А., Гребенюк Ю.А., Солоницын Е.А. Донецкий национальный медицинский университет им. М. Горького
Рубрики: Травматология и ортопедия
Версия для печати
В работе обобщен клинический опыт диагностики и хирургического лечения метастазов гипернефроидного рака почки в длинные кости конечностей. Наличие метастаза, особенно осложнившегося патологическим переломом, является показанием к ортопедическому лечению, влияющему на качество жизни и сроки выживаемости пациентов. Методом выбора являются сегментарная резекция опухолевого очага и эндопротезирование вставкой, для изготовления которой используются метилметакрилат и углерод-углеродистый композитный материал.
Гипернефрома почки, патологический перелом, метастазы, лечение.
Поражение длинных костей метастазами злокачественных опухолей внутренних органов, которые были удалены ранее или локализация которых, несмотря на комплекс диагностических мероприятий, не была установлена, представляет для онкоортопеда трудную задачу в плане лечебной тактики [1, 2]. Задача осложняется при патологическом переломе кости. Метастатическое поражение длинных костей чаще (25 %) наблюдается у лиц после 40 лет. Среди них метастазы рака почки в кости составляют 23–32 % [3, 4].
В структуре метастатического поражения длинных костей конечностей бедренная кость является наиболее частой «мишенью», ее разрушение наблюдается у 45–60 % больных, плечевой кости — у 35 %, всех остальных костей — примерно у 10 % [6–8]. Патологические переломы длинной кости на фоне метастазов опухоли встречаются у 38,3 % больных [5].
Целью данного сообщения является демонстрация возможностей хирургического лечения патологических переломов длинных костей конечностей на фоне гипернефроидного рака.
Материал и методы
Под нашим наблюдением находилось 74 больных с патологическим переломом длинной кости конечности на фоне метастаза гипернефромы почек. Среди них 25 мужчин и 49 женщин. Локализация метастазов и переломов длинной кости была различной (табл. 1). В наших наблюдениях метастазы в плечевую кость преобладали над метастазами в бедренную — 48 и 26 соответственно. Среди них наиболее частой локализацией в кости был ее диафиз: плечевой кости — в 68,8 %, бедренной — в 76,9 % случаев. Метастаз чаще поражал проксимальный метаэпифиз.
Диагностику основывали на клинике и данных рентгенологического, теплографического, сцинтиграфического, ультразвукового исследования, а также иммунологических и биохимических данных.
Из анамнеза установлено, что у всех больных в сроки от 1 года до 6 лет по поводу опухоли удалена почка. Первое обращение больных в поликлинику было связано с болью в плече или бедре. Через 3 и более месяца больные были осмотрены онкологом или онкоортопедом.
У трети больных проведено рентгенологическое исследование, однако его данные интерпретированы ошибочно, и только перелом определил источник клинических проявлений. Ретроспективный анализ рентгенограмм указал на динамику опухолевого процесса. Характерными рентгенологическими признаками развития метастаза гипернефромы являлись: эндостальное расположение очага деструкции костной ткани, форма которого приближалась к округлой, исчезновение костных балок, истончение кортикального слоя вплоть до полного его разрушения. По мере прогрессирования опухолевого процесса кости происходило увеличение размеров очага поражения по длиннику кости до 10–15 см. Компьютерная и магнитно-резонансная томография опухолевого очага позволяли детализировать распространенность процесса по кости, связь его с сосудисто-нервным пучком, распространение на окружающие мягкие ткани.
Для установления или исключения метастазов во внутренних органах каждому больному проводили рентгенографию легких, ультразвуковое исследование брюшной полости и органов таза. Сцинтиграфия позволила исключить или заподозрить метастазы в других костях опорно-двигательной системы. Лейкоцитоз, повышение уровня щелочной и кислой фосфатазы сыворотки крови, гиперкальциемия косвенно свидетельствовали о вторичном неопластическом процессе в костях. Окончательный диагноз был установлен путем морфологического исследования трепанобиопсийного материала. На основании полученных данных определяли лечебную тактику. При наличии отдаленных метастазов гипернефромы нашей задачей являлась стабилизация патологического перелома, химиолучевая терапия проводилась в онкодиспансерах. При отсутствии отдаленных метастазов задача становилась многоплановой: ампутация конечности или экзартикуляция, сохранная операция (табл. 2). При наличии отдаленных метастазов радикальное оперативное лечение метастаза длинной кости считали нецелесообразным. Стабилизацию перелома осуществляли в зависимости от пораженного сегмента длинной кости. Так, при переломах плечевой кости проводили иммобилизацию конечности гипсовой повязкой или брейсом, при переломах диафиза бедренной кости — путем остеосинтеза блокирующим стержнем, накостной пластиной, при переломах в районе метафиза — гонитной гипсовой повязкой или осуществляли временную фиксацию шейки бедра по нашему способу (патент Украины № 237832).
При отсутствии отдаленных метастазов и прорастании опухоли в окружающие перелом мягкие ткани, то есть при отсутствии возможности укрытия эндопротеза собственными мягкими тканями, что наблюдалось при циркулярном дефекте последних, осуществляли ампутацию или экзартикуляцию конечности.
Показанием к сохранной операции считали: возможность удаления опухолевого очага с патологическим переломом, замещение его эндопротезом, укрытие последнего сохранившимися окружающими мышцами.
В отдельных случаях операции предшествовало лучевое воздействие на метастатический очаг в суммарной очаговой дозе 24 Гр и курс регионарной внутрикостной химиотерапии метатрексатом в дозе 90 мг. Это способствовало регрессу клинической симптоматики: уменьшению размеров опухолевого очага, снижению болевого синдрома. Однако после лучевой терапии всегда отмечались значительные изменения окружающих метастаз тканей, что затрудняло укрытие эндопротеза, исключало гладкое течение раневого процесса, которое выражалось в некрозе мышц, костной ткани в местах соединения с эндопротезом. В связи с этим мы отказались от предоперационного применения лучевой терапии и осуществляли ее через месяц после восстановительной операции, когда имело место гладкое заживление раны. Патологический перелом кости в значительной степени осложняет определение хирургической тактики. Так, в этих случаях возникают затруднения с определением границ поражения тканей, которое нивелирует кровоизлияние и отек. При переломе мы почти всегда наблюдали разрушение ложной капсулы, гематому и отек окружающих тканей, что требовало более широкого (объемного) иссечения мышц, резекции кости.
С учетом гиперваскуляризации опухолевого очага операцию в средней и нижней трети плеча или бедра проводили под жгутом. При невозможности использовать последний удаление очага осуществляли этапно, лигируя или коагулируя все встречающиеся сосуды. От опухоли отходили, используя электронож, которым пересекали фасции, мышцы и надкостницу на уровне пересечения кости. Мышцы, которые полностью, т.е. в фасциальном футляре, отходили от опухолевого конгломерата, отводили в сторону, сохраняя их.
Пилой Джигли пересекали кость, отступив проксимально от видимой границы опухоли не менее чем на 6 см, в дистальном — на 4–6 см. В случае подозрения на поражение кости еще выше проводили пересечение ее до уровня здоровой кости и костного мозга. Описанная хирургическая тактика оправдала себя — ни в одном наблюдении не было продолженного роста гипернефромы в месте резекции.
Методика замещения костного дефекта зависела от уровня резекции, длины оставшихся проксимального и дистального костных фрагментов.
При дефекте диафиза плечевой кости в средней трети ее замещение осуществляли эндопротезом из металлополимерного или углерод-углеродистого композитного материала (патент Украины № 65120А) (рис. 1).
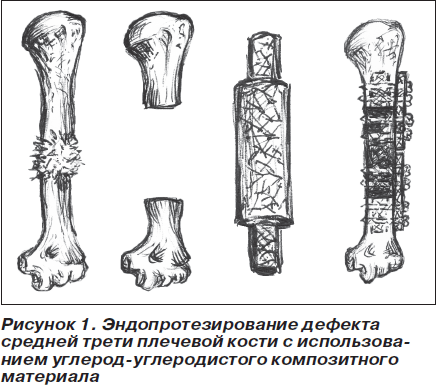
Металлополимерный эндопротез готовили в гипсовой форме, углерод-углеродистый эндопротез по размерам удаляемого сегмента вырезали из заводской заготовки. После удаления опухолевого очага его замещали эндопротезом. Дополнительную фиксацию последнего осуществляли пластинами АО. К эндопротезу фиксировали сохраненные мышцы. При большом дефекте и сложностях укрытия эндопротеза последний обворачивали полипропиленовой сеткой, к которой фиксировали мышцы.
Дефекты бедренной кости в средней трети диафиза замещали по следующей методике. В проксимальный фрагмент бедренной кости ретроградно вводили металлический стержень диаметром, соответствующим костномозговому каналу. После растягивания фрагментов на длину удаленного сегмента металлический стержень антеградно пробивали в дистальный фрагмент бедренной кости на длину, которая обеспечивала стабильность стержня. Если стержень нестабилен, осуществляли удаление костного мозга и частично спонгиозной кости метафиза. В образовавшуюся полость заливали жидкий костный цемент (полиметилметакрилат) и вводили дистальный конец металлического стержня. После полимеризации цемента дефект между костными фрагментами заполняли полиметилметакрилатом, используя желоб из жести или поливика (патент Украины № 15048) (рис. 1).
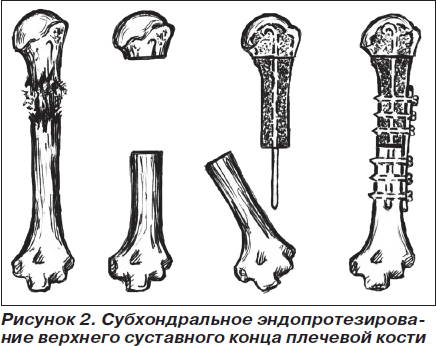
При поражении метастазом гипернефромы верхней или нижней трети диафиза осуществляли субхондральное эндопротезирование (патент Украины № 68570) (рис. 2). Методика заключалась в следующем. После удаления опухолевого очага оставался метаэпифиз плечевой или бедренной кости, возможно, с участком диафиза. В данном фрагменте с помощью фрезы и ложек Фолькмана удаляли спонгиозный слой кости до субхондральной пластины. Образовавшуюся полость заполняли жидким полиметилметакрилатом и в нее погружали проксимальный конец металлического стержня, ранее заготовленного металлополимерного эндопротеза. Для профилактики нестабильности в месте соединения эндопротеза и диафиза кости осуществляли дополнительную фиксацию накостной пластиной АО.
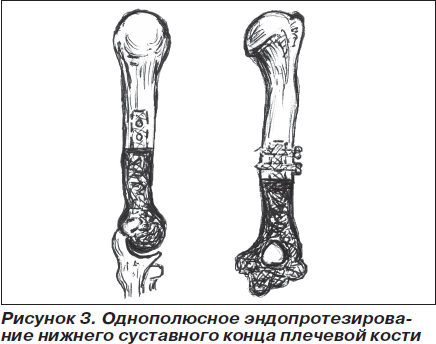
В случаях невозможности сохранить суставной конец пораженной кости осуществляли однополюсное эндопротезирование стандартными металлическими или индивидуально изготовленными по методике Воронцова или нашей (патент Украины № 42193А, № 16400) металлополимерными и углерод-углеродными эндопротезами (рис. 3).
Результаты и их обсуждение
Проведенный анализ результатов лечения пациентов с метастазами гипернефромы почек в длинные кости конечностей свидетельствует о зависимости сроков выживаемости больных от предложенной тактики лечения.
Радикальное удаление метастаза произведено у 60 человек (81,1 %). Консервативные методы применены у 14 пациентов (18,9 %). В случае консервативной тактики по отношению к метастазу показатели 3- и 5-летней выживаемости составляют соответственно 28 % (4 человека) и 12 % (2 пациента). После выполненной нефрэктомии и радикальной резекции солитарного метастаза опухоли в плечевую или бедренную кость (как органосохраняющие операции, так и калечащие) трехгодичная выживаемость составила 78 % (46 пациентов), пятилетняя — 62 % (37 пациентов), причем выживаемость после ампутаций и экзартикуляций не отличалась от выживаемости после органосохраняющих операций. Эти данные ставят под сомнение известное утверждение, что выживаемость больных с солитарными метастазами опухоли почек в кости не зависит от применения широких агрессивных хирургических вмешательств и не коррелирует с такими факторами, как пол, возраст, наступивший патологический перелом.
После радикального удаления опухоли хорошие и удовлетворительные результаты достигнуты у 45 больных (93,7 %), локальные рецидивы отмечены у 3 (6,3 %). Последнее связано с тем, что развитие опухолевого процесса находилось в запущенной стадии, анатомия и синтопия окружающих структур были нарушены, что привело к ошибкам в визуализации границ «опухоль — здоровая ткань». Наличие патологического перелома является показанием к оперативному вмешательству, даже если оно будет носить паллиативный характер и преследовать только цель стабилизации пораженного сегмента опорно-двигательного аппарата, так как и в том и другом случае оно повышает качество жизни.
Выводы
1. Активная хирургическая тактика по отношению к метастазам гипернефромы почек в длинные кости конечностей определяет более чем двукратное увеличение сроков выживаемости пациентов.
2. Органосохраняющие операции имеют преимущества перед калечащими вмешательствами, поскольку при отсутствии разницы в сроках выживаемости в зависимости от выбранной тактики они обеспечивают значительное улучшение качества жизни.
3. Применяемые способы резекции кости, механические, химические и термические средства санации метастаза, способы стабилизации имплантата определяют положительный результат лечения.
Бабоша В.А., Ферас Анабтави, Сирота Е.Г. и др. Комплексная диагностика патологических (опухолевых) переломов длинных костей конечностей // Український медичний альманах. — 2002. — Т. 5, № 3. — С. 15-18.
Гребенюк Ю.А. Индивидуальное эндопротезирование верхнего суставного конца плечевой кости // Вест. ортоп., травмат., протез. — 2005. —№ 3. — С. 56-58.
Гребенюк Ю.А. Лечение злокачественных опухолевых поражений диафиза плечевой кости // Вест. ортоп. травмат. протез. — 2005. — № 4. — С. 77-80.
Махсон А.Н., Махсон Н.Е. Хирургия при метастатических опухолях костей. — М., 2002. — 120 с.
Ломтатидзе Е.Ш., Ермолаев Е.К., Ломтатидзе В.Е. Ортопедическое лечение патологических переломов костей конечностей при их метастатических поражениях // Вестник травматологии и ортопедии им. Н.Н. Приорова. — 1998. — № 1. — С. 28-32.
Тепляков В.В., Карпенко В.Ю., Соколовский В.А., Алиев М.Д. Современные методы ортопедического лечения при осложненных метастатических поражениях скелета / VII Российская онкологическая конференция 27 ноября 2003. — С. 23-27.
Motzer R.J., Russo P., Nanus D.M. et al. Renal cell carcinoma // Curr. Probl. Cancer. — 1997. — 21. — 185-232.
Lokich J. Spontaneous regression of metastatic renal cell cancer // Am. J. Clin. Oncol. — 1997. — 20. — 416-418.