Вступ
Стандарти ведення гострого ішемічного інсульту (ГІІ) внаслідок оклюзії великих судин значно змінилися за останні роки завдяки досягненням у реперфузійних втручаннях, що базуються на доказах, особливо завдяки механічній тромбектомії (МТ), та легкому доступу до нейроваскулярної візуалізації (ангіо- або перфузійної КТ (КТ, КТП) або МРТ) [1]. Згідно з даними клінічних досліджень, реєстрів та досвіду з повсякденної практики, незважаючи на поліпшення менеджменту гострого інсульту, а також високі показники успішної реканалізації (понад 80 %), показники функціональної незалежності через 3 місяці після терапевтичного втручання все ще залишаються неоптимальними (від 30 до 58 %) як у ранньому (0–6 год), так і в пізньому періоді лікування (> 6 год) [2, 3].
Було показано, що в основі неуспішної реканалізації, тобто відсутності хорошого результату після правильно проведеної ендоваскулярної реканалізації, лежать різні механізми. До них належать реперфузійне пошкодження внаслідок оксидативного стресу, активація запальних каскадів, перевантаження кальцієм, що запускає апоптоз або некроз нейронів, мікросудинна недостатність з феноменом відсутності зворотного потоку та порушення гематоенцефалічного бар’єра (ГЕБ), що призводить до набряку мозку та вторинної внутрішньочерепної кровотечі (ВЧК) [4, 5]. Важливо, що систематичний огляд показав, що ризик ВЧК після ендоваскулярної терапії (ЕВТ) досягає 40 % і, крім того, ВЧК також може впливати на функціональний результат, навіть якщо є безсимптомним [6, 7]. Більшість факторів ризику невдалої реканалізації є незмінними [8, 9]. Для поліпшення результатів необхідно дослідити нові допоміжні методи терапії, спрямовані на численні механістичні шляхи, що беруть участь в ішемічному пошкодженні.
Чи може допоміжна терапія, додана до МТ, наприклад нейропротекція, підвищити загальну ефективність ЕВТ при ГІІ і мати значний потенціал для пом’якшення ускладнень МТ, досі невідомо, і це залишається предметом поточних доклінічних і клінічних досліджень [10]. Згідно з рекомендаціями XI Консорціуму Академічного галузевого круглого столу з лікування інсульту (STAIR), фокус нових досліджень слід змістити з нейро- на церебропротекцію або нейроваскулярний захист. Нейрони, мікроглія, перицити та ендотеліальні клітини — компоненти нейроваскулярної одиниці (НВУ) — демонструють різну схильність до ішемії протягом різних часових проміжків. НВУ має вирішальне значення для регуляції ГЕБ, збереження клітин та запальної імунної відповіді під час або після ГІІ [11, 12]. Дисфункція ГЕБ та НВУ активно призводить до пошкодження та є міцною основою для поточних патофізіологічних процесів, як-от оксидативний стрес, запалення та цитотоксичність. Це порушення сприяє не тільки розвитку ішемічного вогнища під час гострої фази, але й прогресуванню пошкодження в підгострій та хронічній фазах інсульту. Таким чином, більш успішними можуть виявитися церебропротекторні засоби, що є мультимодальними й багатоклітинними та впливають на різні шляхи в моменти часу, які найбільш чутливі до лікування [13, 14].
Церебролізин — це біотехнологічний препарат, що складається з низькомолекулярних нейропептидів та вільних амінокислот і, як було показано, успішно проходить через ГЕБ. Його фармакодинамічні властивості подібні до властивостей природних нейротрофічних факторів, а також він демонструє широкий та багатофакторний цитопротекторний потенціал [15]. На основі доклінічних моделей Церебролізин поліпшує виживання нейронів, сприяє нейронній пластичності та відновленню, пом’якшує ексайтотоксичні каскади шляхом зменшення перевантаження кальцієм і пригнічує апоптоз після ішемічного пошкодження та реперфузії [16]. Крім того, він має протизапальні та антиоксидантні властивості, тим самим зберігаючи вразливу тканину ішемічної напівтіні та зменшуючи вторинне пошкодження [17]. Нещодавнє дослідження in vitro показало, що Церебролізин захищає ГЕБ та справляє терапевтичний вплив на проникність ендотеліальних клітин головного мозку з порушенням фібрину шляхом зменшення прозапальних білків та підвищення рівня білків щільних контактів, тим самим зменшуючи геморагічну трансформацію [18]. У дослідженні CERE-LYSE фази 3 комбінація Церебролізину (30 мл/день протягом 10 днів) та r-tPA при ГІІ була безпечною, хоча суттєво не поліпшила функціональний результат через 3 місяці [19]. Однак в групі Церебролізину вірогідно більша кількість пацієнтів мала поліпшення на 6 або більше балів за шкалою NIHSS у ранній фазі відновлення. Нещодавнє дослідження CEREHETIS продемонструвало, що раннє додавання Церебролізину до r-tPA вірогідно знизило частоту симптоматичної ВЧК та раннього неврологічного дефіциту; однак це не вплинуло на функціональний результат на 90-й день [20]. Невелике пілотне дослідження Poljakovic et al. показало, що Церебролізин як допоміжна терапія після реперфузійної терапії у пацієнтів з невдалою реканалізацією знижував рівень смертності та ризик симптоматичної ВЧК [21]. Одним із можливих пояснень відсутності статистично вірогідного поліпшення функціональних результатів у цих дослідженнях з недостатньою потужністю є ефект стелі, що спостерігався у пацієнтів з легкими інсультами, які не отримували Церебролізин, що посилюється включенням гетерогенної популяції з невідомим статусом реканалізації. Тим не менш, два нещодавні метааналізи, що охоплюють загалом 12 рандомізованих контрольованих досліджень, підкреслили безпеку та ефективність поєднання Церебролізину зі стандартизованою реабілітаційною терапією для відновлення рухових і неврологічних функцій після інсульту [22, 23]. Ці результати сприяли тому, що Європейська академія неврології та Європейська федерація нейрореабілітаційних товариств включила у свої рекомендації використання Церебролізину для реабілітації після гострого ішемічного інсульту та в постінсультному періоді, а також сприяли включенню Церебролізину в інші національні рекомендації [24–26].
Однак на сьогодні жодне дослідження не оцінювало ефективність Церебролізину як додаткової терапії до ЕВТ у пацієнтів з ГІІ з хорошим колатеральним кровообігом та успішною реканалізацією. Вибір цих пацієнтів для нейропротекторних досліджень може максимізувати терапевтичні переваги шляхом поліпшення результатів реканалізації, перфузії для доставки ліків, зменшення реперфузійного пошкодження та вторинної геморагічної трансформації, а також стимулювання нейропластичності. Такий підхід також удосконалив би дизайн дослідження шляхом зменшення варіабельності результатів завдяки більш однорідній популяції пацієнтів, тим самим збільшуючи статистичну потужність та даючи чіткіші механістичні дані для розробки персоналізованих стратегій лікування.
Тому ми висунули гіпотезу, що використання Церебролізину протягом 8 годин після початку інсульту у ретельно відібраних пацієнтів — на основі клінічних та радіологічних критеріїв, а саме інсульт середнього та тяжкого ступеня, невелике початкове ішемічне вогнище, хороший колатеральний кровообіг та значна реканалізація після МТ, — може підвищити ефективність МТ шляхом запуску цитопротекторних ефектів, зменшення реперфузійного пошкодження та ризику симптоматичної ВЧК.
Матеріали та методи
Дизайн дослідження та учасники
Це проспективне одноцентрове відкрите нерандомізоване пілотне дослідження зі сліпою оцінкою результатів було проведено у Військовому медичному інституті — Національному дослідницькому інституті у Варшаві, Польща. Було включено 50 пацієнтів з ГІІ, які послідовно отримували Церебролізин (група Церебролізину) на додаток до МТ, а їх результати порівнювали з результатами 50 пацієнтів контрольної групи, тобто всього в дослідженні взяли участь 100 пацієнтів згідно з нашим розрахунком розміру вибірки. Пацієнти контрольної групи були відібрані з існуючої бази даних та порівнянні з основною групою за вихідними змінними, які, як відомо, впливають на результат інсульту (вік, тяжкість інсульту, ступінь реканалізації, r-tPA, місце оклюзії). Ключові етапи процесу порівняння включали оцінку показників схильності на основі логістичної регресійної моделі, подальше парне порівняння з методом найближчого сусіда (із каліпером 0,2, за наявності), а також аналіз балансу коваріат, що передбачав виключення пацієнтів без відповідних пар з метою мінімізації впливу змішаних факторів.
Протокол дослідження було розроблено відповідно до стандартних пунктів протоколу рекомендацій STROBE для обсерваційних досліджень [27]. Детальний протокол дослідження докладно описаний в іншому джерелі [28]. У табл. 1 стисло підсумовано ключові критерії включення та виключення, якими керувалися в процесі відбору учасників дослідження.
Учасників контрольної групи було ретроспективно відібрано з великого проспективного реєстру, що підтримується дослідником. Реєстр формувався з січня 2018 року, він базується на комплексній, формалізованій базі даних, необхідній для фінансових розрахунків з Національним фондом охорони здоров’я. Він включає дані візуалізації, демографічні та клінічні дані, а також результати (індекс Бартел, BI; модифікована шкала Ренкіна, mRS), за якими проводилася оцінка всіх пацієнтів під час госпіталізації та під час подальших візитів через 1, 3 та 12 місяців після МТ. Шкала Ренкіна — це порядкова шкала від 0 (відсутність симптомів) до 6 (смерть), де бали < 2 вказують на функціональну незалежність, а бали 3–5 — на залежність. Ми припустили, що очікувана частка пацієнтів, які досягнуть mRS 0–2 через 90 днів, становитиме 40 % у контрольній групі та 75 % у групі Церебролізину. Ці припущення ґрунтувалися на результатах досліджень МТ з використанням КТ для відбору пацієнтів (ESCAPE, SWIFT PRIME, MR CLEAN) та на дослідженні CARS, яке продемонструвало статистично вірогідне поліпшення балів за шкалою mRS при застосуванні Церебролізину порівняно з контрольною групою (OR 4,52, 95% ДІ 2,72–8,23) [29]. Виходячи з розрахункового розміру ефекту 35 %, для перевірки нульової гіпотези зі значенням 0,05 та потужністю 0,8 потрібно було загалом 100 пацієнтів.
50 контрольних пацієнтів було відібрано з існуючої бази даних пацієнтів, які отримували лікування з червня 2018 року по травень 2021 року (n = 342, 15 %) (рис. 1). Ці пацієнти, яких лікувала та сама команда з трьох досвідчених лікарів, що й у групі Церебролізину, були порівнянні за показником схильності (PSM) з тими, хто отримував Церебролізин [30]. Показник схильності оцінювався за допомогою коваріаційної логістичної регресійної моделі, яка включала десять базових змінних: вік, стать, сторону інсульту та місце оклюзії (середня мозкова артерія (СМА); СМА-M1 або СМА-M2), оцінку колатералей на КТ-ангіографії (2 або 3 бали за даними КТА), mRS до інсульту (0–1), використання r-tPA та змінні після МТ: оцінка за mTICI (2b, 2c або 3), час початку реперфузії, NIHSS при надходженні до інсультного відділення після МТ. Шкала mTICI диференціює рівні реперфузії: відсутність перфузії (0-й ступінь), мінімальний потік після оклюзії, але без перфузії (1-й ступінь), часткова реперфузія менше ніж половини цільової нижньої ділянки (2a ступінь), часткова реперфузія більше ніж половини ділянки (2b ступінь), майже повна перфузія (2c ступінь) та повна реперфузія без будь-яких дефектів потоку (3-й ступінь). КТА-CS використовує 4-бальну систему, де бал 0 означає відсутність колатеральної реперфузії, 1 означає реперфузію < 50 %, 2 означає реперфузію > 50 %, але < 100 %, а 3 означає реперфузію 100 %. Порівняння балів схильності проводилося за допомогою алгоритму порівняння найближчих сусідів з максимальною шириною каліпера 0,2. Баланс коваріат оцінювали шляхом аналізу стандартизованих середніх відмінностей між групами та вивчення графіків розподілу для кожної змінної. Пацієнти без відповідних збігів були виключені, щоб мінімізувати вплив факторів, які впливають на результати.
/67.jpg)
Втручання
Усі пацієнти проходили лікування у відділенні ней-роінтенсивної терапії, відділенні інсульту та лікування інсульту відповідно до рекомендацій. Перед проведенням МТ неврологи, що є спеціалістами з лікування інсульту, вводили внутрішньовенно r-tPA (0,9 мг/кг) пацієнтам, які відповідали критеріям, а відбір пацієнтів для процедури ЕВТ проводився спільно неврологом та інтервенційним радіологом відповідно до рекомендацій AHA/ASA та ESO-ESMINT [1, 31]. Тромбектомію виконували за допомогою будь-якого пристрою, схваленого для тромбектомії (стент-ретривер, аспіраційна тромбектомія або їх комбінація для досягнення безпечної реканалізації), на вибір спеціаліста з нейроінтервенційних втручань [32]. Усі процедури МТ виконували висококваліфіковані нейрорадіологи, що мали високі показники успішної реперфузії (наприклад, mTICI > 2b у більше ніж 85 % випадків) з низьким рівнем ускладнень. Церебролізин (30 мл/добу, змішаний з 250 мл фізіологічного розчину) вводили внутрішньовенно якомога швидше після ЕВТ та протягом 8 годин від початку інсульту і продовжували його застосування протягом 21 дня (під час госпіталізації або амбулаторно); курс повторювали з 69-го по 90-й день.
Усім пацієнтам проводилася реабілітація (сеанси фізіотерапії, трудотерапії та логопедії) у відділенні інсульту з 1-го дня до виписки та в клініці нейрореабілітації з мінімальною тривалістю 45 хвилин фізіотерапії 5 днів на тиждень та відповідно до місцевих стандартів (середня тривалість реабілітації становить 3 місяці після інсульту, максимальна — 4 місяці).
Протокол нейровізуалізації
Протокол нейровізуалізації при ГІІ передбачає, що всім пацієнтам, яким планується проведення MT, виконується неконтрастна комп’ютерна томографія (НКТ), КТ-ангіографія (КТА) та перфузійна КТ (КТП). Контрольна НКT виконується рутинно через 24 години (у всіх пацієнтів) та пізніше у разі погіршення неврологічного стану. Щоб диференціювати спонтанну ВЧК та контрастне забарвлення після МТ у 24-годинній НКТ, у незрозумілих випадках проводили контрольну візуалізацію через 24–48 годин за допомогою НКТ або МРТ зі зваженою за чутливістю візуалізацією (SWI). Стійка гіперщільність на НКТ або артефакт розквіту через магнітну чутливість свідчать про крововилив, на відміну від контрастного забарвлення.
Симптоматична ВЧК визначалася як внутрішньочерепний крововилив, що супроводжується клінічним погіршенням (збільшення показника за шкалою NIHSS > 4 бали від початкового стану), відповідно до критеріїв ECASS-3 [33]. Автоматизована обробка НКТ, КТА та КТП рутинно виконувалася у кожного пацієнта, який пройшов лікування та був госпіталізований безпосередньо до лікарні, з використанням останньої версії програмного забезпечення e-Stroke з маркуванням CE (Brainomix, Оксфорд, Велика Британія) [34]. У цьому дослідженні ми використовували e-Stroke для полегшення визначення критеріїв включення у потенційних пацієнтів та контрольної групи в минулому.
Неврологічна оцінка
Неврологічні оцінки базувалися на стандартній схемі обстеження, яке проводив старший невролог як у пацієнтів, що отримували Церебролізин, так і в конт-рольній групі до та після МТ (NIHSS0), через 24 години після МТ (NIHSS1), на 7-й день (NIHSS2, mRS7D) та за шкалою mRS, індексом Бартел через 30 (mRS30D) та 90 днів (mRS90D). Ми включили лише пацієнтів, у яких mRS був < 1, а бал за шкалою NIHSS0 > 5, що вказує на інсульт середнього або тяжкого ступеня.
Оцінка результатів
Показником первинного результату була частка пацієнтів, які отримували Церебролізин, у яких спостерігався сприятливий функціональний результат (mRS 0–2) через 90 днів після початку інсульту порівняно з контрольною групою.
Вторинними цілями було визначити ефективність Церебролізину порівняно з контрольною групою у зниженні рівня смертності (за 3 місяці) та ризику ВЧК (результати безпеки), поліпшенні неврологічного результату, оціненого за шкалою NIHSS (на 1-й та 7-й день), mRS через 7 та 30 днів, частці пацієнтів з mRS 0–1 через 90 днів та поліпшенні повсякденної активності (оціненої за допомогою індексу Бартел) на 30-й та 90-й дні. Для оцінки на 7-й день за NIHSS було встановлено максимальний бал 42 для померлих пацієнтів, щоб відобразити тяжкість результату та зберегти узгодженість у наборі даних.
Оскільки всі пацієнти з інсультом, які отримують ЕВТ у нашій клініці, проходять стандартне неврологічне обстеження у визначені терміни під час госпіталізації та після виписки, всі клінічні та радіологічні оцінки проводилися, за можливості, за умов засліплення, при цьому оцінювачі не знали ранніх результатів ЕВТ та розподілу на групи лікування. Усі клінічні результати були отримані шляхом особистих обстежень під час госпіталізації або шляхом телефонного спостереження після виписки.
Результати
У період з червня 2021 року по грудень 2023 року ми обстежили 291 пацієнта, госпіталізованого до нашого Комплексного центру лікування інсульту з помірним або тяжким ГІІ, спричиненим оклюзією передньої мозкової артерії, яким призначали МТ протягом 6 годин від початку інсульту. Зрештою, у дослідження було включено 50 пацієнтів (17 %), які досягли значної реперфузії після МТ (mTICI 2b–3), мали хороший колатеральний кровотік (КТА 2–3) та значний неврологічний дефіцит після МТ (NIHSS > 5) з кортикальними ознаками, які відповідали іншим клінічним та нейровізуалізаційним критеріям (табл. 1) та могли отримати Церебролізин протягом 8 годин від початку інсульту. Недостатній колатеральний кровотік і тяжка афазія або нехтування, що унеможливлювало надання інформованої згоди, були найчастішими причинами невдалого скринінгу та низького рівня набору (рис. 1).
Базові характеристики та курс ЕВТ
Пацієнти з групи Церебролізину та контрольної групи були добре порівнянні за більшістю вихідних змінних (табл. 2). Не було статистично вірогідних відмінностей у демографічних показниках, супутніх захворюваннях, етіології та тяжкості інсульту, а також у результатах, пов’язаних з процедурою. Водночас пацієнти з групи Церебролізину мали нижчий бал за шкалою ASPECTS порівняно з контрольною групою (медіана 9 проти 10 балів). Обидві групи не відрізнялися за вихідним об’ємом невідповідності (група Церебролізину проти контрольної: 90 мл [IQR 129] та 100 мл [68], p = 0,5) і за об’ємом ішемічного вогнища (визначеного як rCBF < 30 %: 10 мл [27] та 7 мл [15], p = 0,2 відповідно). В обох групах була схожа кількість пацієнтів з однаковою етіологією інсульту, майже у половини пацієнтів спостерігався кардіоемболічний інсульт, усі випадки зумовлені фібриляцією передсердь (AF).
Не було виявлено вірогідної різниці у вихідних характеристиках між популяціями ITT та PP.
Усі процедури ЕВТ були технічно успішними, і під час них не виникло жодних серйозних ускладнень (таких, що стосуються внутрішньочерепного кровообігу або судинної артерії, дисекції, дистальної емболії, необхідності внутрішньочерепного стентування). Медіана часу від початку інсульту до введення Церебролізину становила 250 хв [IQR 220]. Ця значна варіабельність була пов’язана з часом від початку інсульту до реканалізації (медіана 217 хв [IQR 168]), а також із затримками процедур, пов’язаних з дослідженням (наприклад, отримання інформованої згоди).
Первинні результати
Дослідження успішно досягло свого первинного результату, продемонструвавши вірогідне поліпшення функціональної незалежності через 3 місяці (виміряної за mRS 0–2) у групі Церебролізину порівняно з контрольною групою (68 проти 44 %, 2 p = 0,016; OR 2,7, 95% ДІ 1,2–6,1; NNT 4,2) (рис. 2). Поліпшення було вищим у підгрупі пацієнтів, які отримували r-tPA (80 проти 47,6 %, p = 0,03; OR 4,4, 95% ДІ 1,1–17,7), залишалося значним у тих, у кого ASPECTS < 10 (61,3 проти 26,3 %, p = 0,02; OR 4,4, 95% ДІ 1,3–15,5), і мало тенденцію до вірогідності у пацієнтів без будь-якої ВЧК (65,3 проти 34,7 %, p = 0,07; OR 2,39, 95% ДІ 0,9–6,4).
Вторинні результати
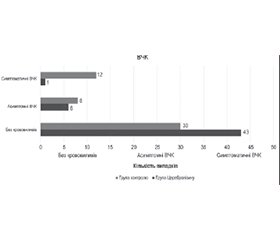
Пацієнти з групи Церебролізину частіше досягали відмінного результату (mRS 0–1) через 3 місяці порівняно з контрольною групою (50 проти 30 %, 2 p = 0,04; OR 2,3, 95% ДІ 1,02–5,3; NNT 5). Також спостерігалися вірогідні відмінності на користь групи Церебролізину у всьому діапазоні mRS через 7 днів (OR 0,79, 95% ДІ 0,63–0,99), 30 днів (OR 0,77, 95% ДІ 0,61–0,97) та 3 місяці (OR 0,78, 95% ДІ 0,63–0,97) (рис. 2). Значно більше пацієнтів з групи Церебролізину порівняно з контрольною групою досягли функціональної незалежності через 7 та 30 днів (mRS7D та mRS30D 0–2 відповідно 60 проти 36 %, p = 0,02, та 60 проти 40 %, p = 0,046). 16 пацієнтів з групи Церебролізину (32 %) проти 28 (56 %) з контрольної групи відповідали клінічним критеріям невдалої реканалізації (mRS 3–6 через 3 місяці, RR 0,57, 95% ДІ 0,276–1,184).
Не було виявлено вірогідної різниці в балах за шкалою NIHSS на початку дослідження (NIHSS0) та через 24 години (NIHSS1) між групами (рис. 3). Однак пацієнти з групи Церебролізину показали значно кращі результати, ніж контрольна група, на 7-й день після ЕВТ (NIHSS2) (медіана 3 [4] проти 6 [9], p = 0,01). Пацієнти, які отримували Церебролізин, показали швидше та вірогідне поліпшення між початковим рівнем (NIHSS0) та 1-м днем (NIHSS1) (різниця в середніх рангах 0,88; p < 0,01) та між 1-м та 7-м днем (різниця в середніх рангах 0,82; p < 0,01). Натомість контрольна група не показал
Список литературы
1. Turc G, Bhogal P, Fischer U, et al. European Stroke Organisation (ESO) — European society for minimally invasive neurological therapy (ESMINT) guidelines on mechanical thrombectomy in acute ischemic stroke. J NeuroIntervent Surg. 2019;15(8):e8. https://doi.org/10.1136/neurintsurg-2018-014569.
2. Zaidat OO, Fifi JT, Nanda A, et al. Endovascular treatment of acute ischemic stroke with the Penumbra System in routine practice: complete registry results. Stroke. 2022;53(3):769-78. https://doi.org/10.1161/strokeaha.121.034268.
3. Deb-Chatterji M, Pinnschmidt H, Flottmann F, et al. Stroke patients treated by thrombectomy in real life differ from cohorts of the clinical trials: a prospective observational study. BMC Neurol. 2020;20:81. https://doi.org/10.1186/s12883-020-01653-z.
4. Jayaraman MV, Grossberg JA, Meisel KM, Shaikhouni A, Silver B. The clinical and radiographic importance of distingui–shing partial from near-complete reperfusion following intra-arterial stroke therapy. AJNR Am J Neuroradiol. 2013;34:135-9. https://doi.org/10.3174/ajnr.A3278.
5. Deng G, Xiao J, Yu H, et al. Predictors of futile recanalization after endovascular treatment in acute ischemic stroke: a metaanalysis. J NeuroIntervent Surg. 2021;14(9):881-5. https://doi.org/10.1136/neurintsurg-2021-017963.
6. Hao Y, Zhang Z, Zhang H, et al. Risk of intracranial he–morrhage after endovascular treatment for acute ischemic stroke: systematic review and meta-analysis. Interv Neurol. 2017;6(1-2):57-64. https://doi.org/10.1159/000454721.
7. Sun D, Jia B, Tong X, et al. Predictors of parenchymal he–morrhage after endovascular treatment in acute ischemic stroke: data from ANGEL-ACT registry. J NeuroIntervent Surg. 2022;15(1):20-6. https://doi.org/10.1136/neurintsurg-2021-018292.
8. Cao Y, Zhao L, Jia Z, et al. Cerebral blood volume Alberta Stroke Program early computed tomography score predicts intracranial hemorrhage after thrombectomy in patients with acute ischemic stroke in an extended time window. Acta Radiol. 2021;63(3):393-400. https://doi.org/10.1177/0284185121990843.
9. Shen H, Killingsworth MC, Bhaskar SMM. Comprehensive metaanalysis of futile recanalization in acute ischemic stroke patients undergoing endovascular thrombectomy: prevalence, factors, and clinical outcomes. Life. 2023;13:1965.
10. Buchan A, Regenhardt R, Dmytriw A, Hirsch J, Buchan A. Cerebroprotection in the endovascular era: an update. J Neurol Neurosurg Psychiatry. 2022;94(4):267-71. https://doi.org/10.1136/jnnp-2022-330379.
11. Lyden P, Buchan A, Boltze J, et al. Top priorities for cerebroprotective studies — a paradigm shift: report from STAIR XI. Stroke. 2021;52:3063-71. https://doi.org/10.1161/STROKEAHA.121.034947.
12. Wang L, Xiong X, Zhang L, Shen J. Neurovascular unit: a critical role in ischemic stroke. CNS Neurosci Ther. 2021;27:7-16. https://doi.org/10.1111/cns.13561.
13. Xiong X, Liu L, Yang Q. Refocusing neuroprotection in cerebral reperfusion era: new challen
/67.jpg)
/69.jpg)

/68.jpg)
/70.jpg)