Международный эндокринологический журнал Том 21, №6, 2025
Вернуться к номеру
Потенційна роль поліморфізму C677T гена метилентетрагідрофолатредуктази в патогенетичних механізмах гормонально-метаболічної відповіді на цукрознижувальну терапію
Авторы: T. Tyzhnenko (1), K. Misіura (1), O. Plokhotnichenko (1), A. Pocherniaiev (1, 3), A. Kolesnikova (1), I. Marakhovskyi (1), M. Gorshunska (2), Z. Leshchenko (1), E. Jansen (4), K. Biernot Pamuła (5)
(1) - State Institution “V. Danilevsky Institute for Endocrine Pathology Problems of NAMSU”, Kharkiv, Ukraine
(2) - V.N. Karazin Kharkiv National University, Kharkiv, Ukraine
(3) - Poltava Research Forensic Center of the Ministry of Internal Affairs of Ukraine, Poltava, Ukraine
(4) - National Institute for Public Health and the Environment, Bilthoven, The Netherlands
(5) - 5th Military Clinical Hospital SPZOZ, Krakow, Poland
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
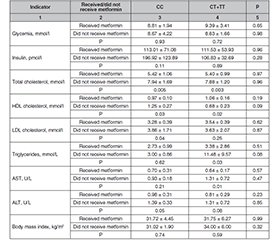
Актуальність. Цукровий діабет 2-го типу (ЦД2) є полігенним мультифакторним захворюванням, у розвитку якого беруть участь як генетичні, так і зовнішні чинники. Ген метилентетрагідрофолатредуктази (MTHFR) і, зокрема, поліморфізм C677T впливають на метаболізм фолієвої кислоти й рівень гомоцистеїну, що може змінювати перебіг метаболічних процесів та реакцію на фармакотерапію. Метформін є препаратом першої лінії для лікування ЦД2, однак спостерігається варіабельність у відповіді пацієнтів на його прийом. Мета: виявлення й оцінка потенційного впливу патогенетично значущого однонуклеотидного поліморфізму гена MTHFR на розвиток ожиріння та цукрового діабету 2-го типу при реалізації гормонального і метаболічного впливу фармакологічних факторів. Матеріали та методи. У дослідженні взяли участь 28 пацієнтів із ЦД2 та ожирінням (індекс маси тіла ≥ 30 кг/м2). Було проведено клінічне, біохімічне й антропометричне обстеження. Генотипування поліморфізму C677T гена MTHFR виконувалося методом полімеразної ланцюгової реакції та рестрикційного аналізу. Оцінювали ефекти терапії метформіном за показниками глікемічного контролю, ліпідного профілю, функції печінки, адипокінів та маркерів оксидативного стресу з урахуванням генотипу пацієнтів. Результати. В осіб з усіма генотипами, які приймали метформін, спостерігалося поліпшення ліпідного профілю. Печінкові показники змінювались генотипспецифічно: активність аспартатамінотрансферази вірогідно знижувалася в носіїв T-алеля, а аланінамінотрансферази — у носіїв генотипу CC. Це вказує на наявність гепатопротекторного ефекту метформіну, що залежить від генетичних варіантів. Частота генотипів між групами, які приймали та не приймали метформін, істотно не відрізнялась. Висновки. Метформін має сприятливий ефект на метаболічні показники в пацієнтів із ЦД2, демонструючи генотипзалежну гепатопротекторну дію. Поліморфізм C677T гена MTHFR не впливає на призначення метформіну, однак може модулювати біохімічну відповідь печінки на препарат. Це підкреслює доцільність фармакогенетичного підходу при персоналізації терапії ЦД2.
Background. Type 2 diabetes mellitus (T2DM) is a multifactorial disease involving both environmental and genetic components. The methylenetetrahydrofolate reductase (MTHFR) gene, particularly the C677T polymorphism, influences folate metabolism and homocysteine levels and may affect metabolic processes and pharmacological response. Metformin is the first-line antihyperglycemic agent for T2DM, but interindividual variability in treatment response remains a key issue. The purpose of the work is to identify and assess the potential impact of a pathogenetically significant single-nucleotide polymorphism of the MTHFR gene on the development of obesity and type 2 diabetes mellitus in the implementation of the hormonal and metabolic effects of pharmacological factors. Materials and methods. This study included 28 patients with T2DM and metabolic syndrome (body mass index ≥ 30 kg/m2). Clinical, biochemical, and anthropometric parameters were assessed. Genotyping of the MTHFR C677T polymorphism was performed using polymerase chain reaction and restriction fragment length polymorphism. The effects of metformin therapy were evaluated by analyzing glycemic control, lipid profile, liver function, adipokine levels, and oxidative stress markers, taking into account the patients’ MTHFR genotypes. Results. Metformin use was associated with improved lipid profile in all genotypes. In addition, a genotype-specific reduction in liver enzyme activity was observed: aspartate aminotransferase levels decreased significantly in T allele carriers, while alanine aminotransferase reduced in patients with the CC genotype. These results suggest both pleiotropic and genotype-dependent hepatoprotective effects of metformin. No significant differences in MTHFR genotype distribution were found between metformin-treated and untreated groups. Conclusions. Metformin has beneficial metabolic effects in T2DM patients and may exert genotype-specific hepatoprotective properties. The C677T polymorphism of the MTHFR gene did not determine whether patients were prescribed metformin, but it may modulate liver-related biochemical responses to the drug. These findings support the relevance of pharmacogenetic approaches to optimize therapy in T2DM.
цукровий діабет 2-го типу; MTHFR; поліморфізм C677T; метформін; фармакогенетика; метаболічний синдром; печінкові ферменти
type 2 diabetes mellitus; MTHFR; C677T polymorphism; metformin; pharmacogenetics; metabolic syndrome; liver enzymes
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Yu G, Tam CHT, Lim CKP, Shi M, Lau ESH, et al.; Hong Kong Diabetes Biobank Study Group; Chow E, Kong APS, Tam WH, Luk AOY, Weedon MN, et al.; TRANSCEND Consortium. Type 2 diabetes pathway-specific polygenic risk scores elucidate heterogeneity in clinical presentation, disease progression and diabetic complications in 18,217 Chinese individuals with type 2 diabetes. Diabetologia. 2025 Mar;68(3):602-614. doi: 10.1007/s00125-024-06309-y.
- Singh A, Shadangi S, Gupta PK, Rana S. Type 2 diabetes mellitus: a comprehensive review of pathophysiology, comorbidities, and emerging therapies. Compr Physiol. 2025 Feb;15(1):e70003. doi: 10.1002/cph4.70003.
- Lu X, Xie Q, Pan X, Zhang R, Zhang X, et al. Type 2 diabetes mellitus in adults: pathogenesis, prevention and therapy. Signal Transduct Target Ther. 2024 Oct 2;9(1):262. doi: 10.1038/s41392-024-01951-9.
- Smelyakov K, Lurin I, Misiura K, Chupryna A, Tyzhnenko T, et al. Smart diabetes management: remote monitoring and predictive health insights. Int J Endocrinol (Ukraine). 2025;21(4):433-440. doi: 10.22141/2224-0721.21.4.2025.1571.
- Luo JQ, Shu Y, Zhang W. Editorial: pharmacogenomics and pharmacomicrobiomics in type 2 diabetes mellitus (T2DM). Front Endocrinol (Lausanne). 2023 Sep 18;14:1287807. doi: 10.3389/fendo.2023.1287807.
- Bailey CJ. Metformin: therapeutic profile in the treatment of type 2 diabetes. Diabetes Obes Metab. 2024 Aug;26 Suppl 3:3-19. doi: 10.1111/dom.15663.
- Chan JCN, Yang A, Chu N, Chow E. Current type 2 diabetes guidelines: individualized treatment and how to make the most of metformin. Diabetes Obes Metab. 2024 Aug;26 Suppl 3:55-74. doi: 10.1111/dom.15700.
- Dutta S, Shah RB, Singhal S, Dutta SB, Bansal S, Sinha S, Haque M. Metformin: a review of potential mechanism and therapeutic utility beyond diabetes. Drug Des Devel Ther. 2023 Jun 26;17:1907-1932. doi: 10.2147/dddt.s409373.
- LaMoia TE, Shulman GI. Cellular and molecular mechanisms of metformin action. Endocr Rev. 2021 Jan 28;42(1):77-96. doi: 10.1210/endrev/bnaa023.
- Zhu H, Jia Z, Li YR, Danelisen I. Molecular mechanisms of action of metformin: latest advances and therapeutic implications. Clin Exp Med. 2023 Nov;23(7):2941-2951. doi: 10.1007/s10238-023-01051-y.
- Agius L, Ford BE, Chachra SS. The metformin mechanism on gluconeogenesis and AMPK activation: the metabolite perspective. Int J Mol Sci. 2020 May 3;21(9):3240. doi: 10.3390/ijms21093240.
- Li JH, Brenner LN, Kaur V, Figueroa K, Schroeder P, Huerta-Chagoya A; MAGIC Investigators; Diabetes Prevention Program (DPP) Research Group; Udler MS, Leong A, Mercader JM, Florez JC. Genome-wide association analysis identifies ancestry-specific genetic variation associated with acute response to metformin and glipizide in SUGAR-MGH. Diabetologia. 2023 Jul;66(7):1260-1272. doi: 10.1007/s00125-023-05922-7.
- Nguyen Ngoc N, Tran Ngoc Thao M, Trieu Tien S, Vu Tung S, Le H, et al. Evaluating the association between genetic polymorphisms related to homocysteine metabolism and unexplained recurrent pregnancy loss in women. Appl Clin Genet. 2022 Jun 7;15:55-62. doi: 10.2147/tacg.s365281.
- Liew SC, Gupta ED. Methylenetetrahydrofolate reductase (MTHFR) C677T polymorphism: epidemiology, metabolism and the associated diseases. Eur J Med Genet. 2015 Jan;58(1):1-10. doi: 10.1016/j.ejmg.2014.10.004.
- Pankiv V. Coexistence of accompanying autoimmune di–seases in adolescents with autoimmune thyroiditis. Child’s Health. 2024;19(7):429-433. doi: 10.22141/2224-0551.19.7.2024.1754.
- Wu AN, Yu RX, Song KW, Tuo Y. Genetic polymorphisms in folate metabolism and their association with recurrent spontaneous abortion. J Matern Fetal Neonatal Med. 2025 Dec;38(1):2505769. doi: 10.1080/14767058.2025.2505769.
- Li Y, Shu J, Tan P, Dong X, Zhang M, et al. Genetic variants in folate metabolism-related genes, serum folate and hepatocellular carcinoma survival: the Guangdong Liver Cancer Cohort study. Br J Nutr. 2024 Dec 14;132(11):1411-1422. doi: 10.1017/s0007114524001776.
- Muzurović E, Kraljević I, Solak M, Dragnić S, Mikhaili–dis DP. Homocysteine and diabetes: role in macrovascular and microvascular complications. J Diabetes Complications. 2021 Mar;35(3):107834. doi: 10.1016/j.jdiacomp.2020.107834.
- Cheng Y, Wang C, Zhang X, Zhao Y, Jin B, et al. Circulating homocysteine and folate concentrations and risk of type 2 diabetes: a retrospective observational study in Chinese adults and a Mendelian randomization analysis. Front Cardiovasc Med. 2022 Nov 14;9:978998. doi: 10.3389/fcvm.2022.978998.
- Li F, Qi JJ, Li LX, Yan TF. MTHFR C677T, MTHFR A1298C, MTRR A66G and MTR A2756G polymorphisms and male infertility risk: a systematic review and meta-analysis. Reprod Biol Endocrinol. 2024 Oct 30;22(1):133. doi: 10.1186/s12958-024-01306-7.
- Wang W, Jiao XH, Wang XP, Sun XY, Dong C. MTR, MTRR, and MTHFR gene polymorphisms and susceptibility to nonsyndromic cleft lip with or without cleft palate. Genet Test Mol Biomarkers. 2016 Jun;20(6):297-303. doi: 10.1089/gtmb.2015.0186.
- Wrzosek M, Ślusarczyk K. Methylenetetrahydrofolate reductase C677T gene variant in relation to body mass index and folate concentration in a Polish population. Biomedicines. 2022 Dec 6;10(12):3140. doi: 10.3390/biomedicines10123140.
- Cai Y, Liu B, Zhang Y, Zhou Y. MTHFR gene polymorphisms in diabetes mellitus. Clin Chim Acta. 2024 Jul 15;561:119825. doi: 10.1016/j.cca.2024.119825.
- Ventura P, Venturelli G, Marcacci M, Fiorini M, Marchini S, et al. Hyperhomocysteinemia and MTHFR C677T polymorphism in patients with portal vein thrombosis complicating liver cirrhosis. Thromb Res. 2016 May;141:189-195. doi: 10.1016/j.thromres.2016.03.024.
- Yoshida S, Takeuchi M, Kawakami C, Kawakami K, Ito S; Japan Environment and Children’s Study Group. Maternal multivitamin intake and orofacial clefts in offspring: Japan Environment and Children’s Study (JECS) cohort study. BMJ Open. 2020 Mar 30;10(3):e035817. doi: 10.1136/bmjopen-2019-035817.
- McCreight LJ, Bailey CJ, Pearson ER. Metformin and the gastrointestinal tract. Diabetologia. 2016 Mar;59(3):426-435. doi: 10.1007/s00125-015-3844-9.
- Cook MN, Girman CJ, Stein PP, Alexander CM. Initial monotherapy with either metformin or sulphonylureas often fails to achieve or maintain current glycaemic goals in patients with type 2 diabetes in UK primary care. Diabet Med. 2007 Apr;24(4):350-358. doi: 10.1111/j.1464-5491.2007.02078.x.
- Van Leeuwen N, Swen JJ, Guchelaar HJ, ‘t Hart LM. The role of pharmacogenetics in drug disposition and response of oral glucose-lowering drugs. Clin Pharmacokinet. 2013 Oct;52(10):833-854. doi: 10.1007/s40262-013-0076-3.
- Didushko OM, Herych PR, Cherniavska IV, Yatsyshyn RI, Pankiv VI. Influence of the complex treatment of hypothyroidism on the leptin level in patients with primary hypothyroidism. World Med Biol. 2018;(65):59-63. doi: 10.26724/2079-8334-2018-3-65-59-63.