Международный эндокринологический журнал Том 21, №6, 2025
Вернуться к номеру
Рівень греліну та зміни харчової поведінки на ранніх стадіях хронічної хвороби нирок, пов’язаної з ожирінням
Авторы: N.V. Gubina, V.H. Mishchuk, I.H. Kupnovytska
Ivano-Frankivsk National Medical University, Ivano-Frankivsk, Ukraine
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
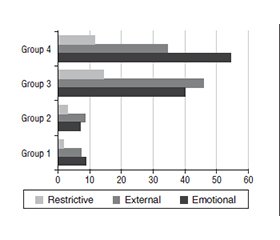
Актуальність. Ендокринний дисбаланс, який призводить до пошкодження клубочкової функції нирок, є маловивченим. Роль орексигенного гормону греліну в розвитку порушень функції нирок залишається не до кінця з’ясованою. Мета: вивчити рівень греліну, його зв’язок із метаболічними показниками, змінами харчової поведінки на ранніх стадіях хронічної хвороби нирок (ХХН), пов’язаної з ожирінням. Матеріали та методи. Обстежено 300 пацієнтів із ХХН. Їх було поділено на 4 групи: І (n = 70) — ХХН І ст. та нормальна маса тіла, ІІ (n = 72) — ХХН ІІ ст. і нормальна маса тіла; ІІІ (n = 70) — ХХН І ст. та ожиріння, ІV (n = 88) — ХХН ІІ ст. і ожиріння. Контрольну групу становили 30 практично здорових осіб. Усім хворим визначали індекс маси тіла, розраховували швидкість клубочкової фільтрації за формулами CKD-EPI на основі рівня креатиніну, цистатину С та їх поєднання (CKD-EPIcysC/cr). Уміст цистатину С і греліну в сироватці крові визначали методом імуноферментного аналізу. Розраховували індекс HOMA-IR. Харчову поведінку та її типи оцінювали за допомогою Голландського опитувальника харчової поведінки. Результати. Виявлено зниження рівня греліну в ІІІ групі та його зростання — в ІV. У пацієнтів з ожирінням спостерігався вірогідний кореляційний зв’язок між концентрацією загального греліну й індексом маси тіла: обернений — у ІІІ групі (r = –0,46, t = 2,1) і прямий — у ІV (r = 0,74, t = 2,5) (р3, 4 < 0,05). Кореляційний аналіз рівнів цистатину С і греліну продемонстрував прямий зв’язок між підвищенням обох показників у пацієнтів із ХХН ІІ ст. на тлі ожиріння. Виявлено вірогідний прямий зв’язок середньої сили між рівнем глюкози і греліном (r = 0,68, t = 2,9, р < 0,05), а також між концентрацією греліну в сироватці крові й індексом HOMA-IR (r = 0,56, t = 2,05, р < 0,05) у ІV групі. У цій групі також зафіксовано тісний кореляційний зв’язок між рівнем греліну й емоційним типом харчової поведінки (r = 0,59, t = 2,5, р < 0,05). Висновки. Із прогресуванням стадії ХХН зміни рівня греліну корелюють із підвищенням концентрації цистатину С, індексом HOMA-IR та емоційним типом харчової поведінки в пацієнтів із ХХН ІІ ст. на тлі ожиріння. Виявлені порушення очевидно призводять до пошкодження клубочків нирок.
Background. Endocrine imbalance leading to impaired glomerular renal function is poorly understood. The role of the orexigenic hormone ghrelin in the development of renal dysfunction remains incompletely clarified. The purpose was to study ghrelin levels, their relation to the metabolic parameters, and changes in eating behaviour characteristics in the early stages of obesity-related chronic kidney disease (CKD). Materials and methods. 300 patients with CKD were examined and divided into 4 groups: the first group consisted of 70 people with the first stage CKD and normal body weight, the second group included 72 patients with the second stage CKD and normal body weight; the third group consisted of 70 people with the first stage CKD and obesity, and the fourth group included 88 patients with the second stage CKD and obesity. The control group consisted of 30 practically healthy individuals. All participants had their body mass index measured, and glomerular filtration rate was calculated using CKD-EPI equations based on creatinine, cystatin C, and their combination (CKD-EPIcysC/cr). The levels of cystatin C and ghrelin in blood serum were determined by enzyme-linked immunosorbent assay. HOMA-IR was calculated as well. Eating behaviour and its types were assessed using the Dutch Eating Behaviour Questionnaire. Results. Ghrelin levels decreased in the third group and increased in the fourth one. In patients with obesity, a significant correlation was observed between the concentration of total ghrelin and body mass index: inverse in the third group (r = –0.46, t = 2.1), and direct in fourth group (r = 0.74, t = 2.5) (p3, 4 < 0.05). Correlation analysis of cystatin C and ghrelin levels showed a direct correlation between an increase in both indicators in patients with the second stage CKD against the background of obesity. A significant direct average correlation was also found between glucose and ghrelin levels (r = 0.68, t = 2.9, p < 0.05), as well as between ghrelin concentration in blood serum and HOMA-IR (r = 0.56, t = 2.05, p < 0.05) in the fourth group. In this group, there was a close correlation between ghrelin levels and emotional type of eating behaviour (r = 0.59, t = 2.5, p < 0.05). Conclusions. As CKD progresses, changes in ghrelin levels correlate with increased cystatin C, HOMA-IR, and emotional type of eating behaviour in patients with the second stage CKD against the background of obesity. These disorders apparently contribute to glomerular damage.
хронічна хвороба нирок; ожиріння; харчова поведінка; грелін; цистатин С
chronic kidney disease; obesity; eating behaviour; ghrelin; cystatin C
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Jiang Z, Wang Y, Zhao X, Cui H, Han M, et al. Obesity and chronic kidney disease. Am J Physiol Endocrinol Metab. 2023;324(1):E24-E41. doi: 10.1152/ajpendo.00179.2022.
- GBD 2021 US Obesity Forecasting Collaborators. National-le–vel and state-level prevalence of overweight and obesity among children, adolescents, and adults in the USA, 1990–2021, and forecasts up to 2050. Lancet. 2024;404(10469):2278-2298. doi: 10.1016/s0140-6736(24)01548-4.
- Hojs R, Ekart R, Bevc S, Vodošek Hojs N. Chronic kidney disease and obesity. Nephron. 2023;147(11):660-664. doi: 10.1159/000531379.
- Emmerich SD, Fryar CD, Stierman B, Ogden CL. Obesity and severe obesity prevalence in adults: United States, August 2021-August 2023. NCHS Data Brief. 2024;(508):10.15620/cdc/159281. doi: 10.15620/cdc/159281.
- Yarnoff BO, Hoerger TJ, Shrestha SS, Simpson SK, Burrows NR, et al.; CRIC Study Investigators. Modeling the impact of obesity on the lifetime risk of chronic kidney disease in the United States using updated estimates of GFR progression from the CRIC study. PLoS One. 2018;13(10):e0205530. doi: 10.1371/journal.pone.0205530.
- Heald A, Stedman M, Fryer AA, Davies MB, Rutter MK, et al. Counting the lifetime cost of obesity: analysis based on national England data. Diabetes Obes Metab. 2024;26(4):1464-1478. doi: 10.1111/dom.15447.
- Ge YZ, Liu T, Deng L, Zhang Q, Liu CA, et al.; Investigation on the Nutrition Status and Clinical Outcome of Common Cancers (INSCOC) Group. The age-related obesity paradigm: results from two large prospective cohort studies. J Cachexia Sarcopenia Muscle. 2024;15(1):442-452. doi: 10.1002/jcsm.13415.
- Tsur AM, Akavian I, Landau R, Derazne E, Tzur D, et al. Adolescent body mass index and early chronic kidney disease in young adulthood. JAMA Pediatr. 2024;178(2):142-150. doi: 10.1001/jamapediatrics.2023.5420.
- D’Agati VD, Chagnac A, de Vries AP, Levi M, Porrini E, et al. Obesity-related glomerulopathy: clinical and pathologic characteri–stics and pathogenesis. Nat Rev Nephrol. 2016;12(8):453-471. doi: 10.1038/nrneph.2016.75.
- Drozdz D, Alvarez-Pitti J, Wójcik M, Borghi C, Gabbianelli R, et al. Obesity and cardiometabolic risk factors: from childhood to adulthood. Nutrients. 2021;13(11):4176. doi: 10.3390/nu13114176.
- Avgoustou E, Tzivaki I, Diamantopoulou G, Zachariadou T, Avramidou D, et al. Obesity-related chronic kidney disease: from diagnosis to treatment. Diagnostics (Basel). 2025;15(2):169. doi: 10.3390/diagnostics15020169.
- Hill NR, Fatoba ST, Oke JL, Hirst JA, O’Callaghan CA, et al. Global prevalence of chronic kidney disease — a systematic review and meta-analysis. PLoS One. 2016;11(7):e0158765. doi: 10.1371/journal.pone.0158765.
- Kovesdy CP. Epidemiology of chronic kidney disease: an update 2022. Kidney Int Suppl (2011). 2022;12(1):7-11. doi: 10.1016/j.kisu.2021.11.003.
- Martínez-Montoro JI, Morales E, Cornejo-Pareja I, Tinahones FJ, Fernández-García JC. Obesity-related glomerulopathy: current approaches and future perspectives. Obes Rev. 2022;23(7):e13450. doi: 10.1111/obr.13450.
- Didushko OM, Herych PR, Cherniavska IV, Yatsyshyn RI, Pankiv VI. Influence of the complex treatment of hypothyroidism on the leptin level in patients with primary hypothyroidism. World of Medicine and Biology. 2018;(65):59-63. doi: 10.26724/2079-8334-2018-3-65-59-63.
- Makris MC, Alexandrou A, Papatsoutsos EG, Malietzis G, Tsilimigras DI, et al. Ghrelin and obesity: identifying gaps and dispelling myths. A reappraisal. In Vivo. 2017;31(6):1047-1050. doi: 10.21873/invivo.11168.
- Skoracka K, Hryhorowicz S, Schulz P, Zawada A, Rataj–czak-Pawłowska AE, et al. The role of leptin and ghrelin in the regulation of appetite in obesity. Peptides. 2025;186:171367. doi: 10.1016/j.peptides.2025.171367.
- Evangelista LS, Cho WK, Kim Y. Obesity and chronic kidney disease: a population-based study among South Koreans. PLoS One. 2018;13(2):e0193559. doi: 10.1371/journal.pone.0193559.
- Al Qarni AA, Joatar FE, Das N, Awad M, Eltayeb M, et al. Association of plasma ghrelin levels with insulin resistance in type 2 diabetes mellitus among Saudi subjects. Endocrinol Metab (Seoul). 2017;32(2):230-240. doi: 10.3803/enm.2017.32.2.230.
- Lv Y, Liang T, Wang G, Li Z. Ghrelin, a gastrointestinal hormone, regulates energy balance and lipid metabolism. Biosci Rep. 2018;38(5):BSR20181061. doi: 10.1042/bsr20181061.
- Laursen TL, Zak RB, Shute RJ, Heesch MWS, Dinan NE, et al. Leptin, adiponectin, and ghrelin responses to endurance exercise in different ambient conditions. Temperature (Austin). 2017;4(2):166-175. doi: 10.1080/23328940.2017.1294235.
- Monzani A, Perrone M, Prodam F, Moia S, Genoni G, et al. Unacylated ghrelin and obestatin: promising biomarkers of protein ener–gy wasting in children with chronic kidney disease. Pediatr Nephrol. 2018;33(4):661-672. doi: 10.1007/s00467-017-3840-z.
- Kounatidis D, Vallianou NG, Stratigou T, Voukali M, Karampela I, Dalamaga M. The kidney in obesity: current evidence, perspectives and controversies. Curr Obes Rep. 2024;13(4):680-702. doi: 10.1007/s13679-024-00583-y.
- James BL, Loken E, Roe LS, Rolls BJ. The weight-related eating questionnaire offers a concise alternative to the three-factor eating questionnaire for measuring eating behaviors related to weight loss. Appetite. 2017;116:108-114. doi: 10.1016/j.appet.2017.04.023.
- Huang Y, Fu R, Zhang J, Zhou J, Chen S, et al. Dynamic changes in metabolic syndrome components and chronic kidney disease risk: a population-based prospective cohort study. BMC Endocr Disord. 2025;25(1):137. doi: 10.1186/s12902-025-01958-5.
- Parvathareddy VP, Wu J, Thomas SS. Insulin resistance and insulin handling in chronic kidney disease. Compr Physiol. 2023;13(4):5069-5076. doi: 10.1002/cphy.c220019.
- Spoto B, Pisano A, Zoccali C. Insulin resistance in chro–nic kidney disease: a systematic review. Am J Physiol Renal Physiol. 2016;311(6):F1087-F1108. doi: 10.1152/ajprenal.00340.2016.
- Cao W, Shi M, Wu L, Yang Z, Yang X, et al. A renal-cerebral-peripheral sympathetic reflex mediates insulin resistance in chro–nic kidney disease. EBioMedicine. 2018;37:281-293. doi: 10.1016/j.ebiom.2018.10.054.
- Schrauben SJ, Jepson C, Hsu JY, Wilson FP, Zhang X, et al. Insulin resistance and chronic kidney disease progression, cardiovascular events, and death: findings from the chronic renal insufficiency cohort study. BMC Nephrol. 2019;20(1):60. doi: 10.1186/s12882-019-1220-6.
- Mishchuk V, Hryhoruk G, Mizyuk T, Kozinchuk G. The nature of eating behavior in patients with certain diseases of internal organs (review of the literature and own data). Therapeutics named after Prof. Berezhnytsky M.M. 2021;2(2):66-70. doi: 10.31793/2709-7404.2021.2-2.66.
- Serhiyenkо V, Chemerys O, Pankiv V, Serhiyenko A. Type 2 diabetes mellitus, cerebral small vessel disease and depressive disorders. International Neurological Journal. 2025;21(3):226-237. doi: 10.22141/2224-0713.21.3.2025.1178.
- Kokorina YY, Psatii AV. Eating behavior as a form of self-attitude. Insight: The Psychological Dimensions of Society. 2021;5:11-29. doi: 10.32999/2663-970X/2021-5-2.
- Benbaibeche H, Saidi H, Bounihi A, Koceir EA. Emotio–nal and external eating styles associated with obesity. J Eat Disord. 2023;11(1):67. doi: 10.1186/s40337-023-00797-w.
- Mammeri A, Tebaibia A. Cardiometabolic risk in Algeria: past and present. Intern Emerg Med. 2020;15(4):531-535. doi: 10.1007/s11739-019-02207-z.
- Kobrynska OYa, Didushko OM. Options of correcting insulin resistance and proinflammatory cytokine levels in patients with type 2 diabetes mellitus. Problems of Endocrine Pathology. 2022;1:36-41. doi: 10.21856/j-PEP.2022.1.05.
- Xu W, Zhu Y, Wang S, Liu J, Li H. From adipose to ailing kidneys: the role of lipid metabolism in obesity-related chronic kidney disease. Antioxidants (Basel). 2024;13(12):1540. doi: 10.3390/antiox13121540.
- Tsujimoto T, Sairenchi T, Iso H, Irie F, Yamagishi K, et al. The dose-response relationship between body mass index and the risk of incident stage ≥ 3 chronic kidney disease in a general Japanese population: the Ibaraki prefectural health study (IPHS). J Epidemiol. 2014;24(6):444-451. doi: 10.2188/jea.je20140028.
- Benoit SW, Ciccia EA, Devarajan P. Cystatin C as a biomar–ker of chronic kidney disease: latest developments. Expert Rev Mol Diagn. 2020;20(10):1019-1026. doi: 10.1080/14737159.2020.1768849.
- Canney M, Sexton DJ, O’Leary N, Healy M, Kenny RA, et al. Examining the utility of cystatin C as a confirmatory test of chronic kidney disease across the age range in middle-aged and older community-dwelling adults. J Epidemiol Community Health. 2018;72(4):287-293. doi: 10.1136/jech-2017-209864.
- Björk J, Bäck SE, Ebert N, Evans M, Grubb A, et al. GFR estimation based on standardized creatinine and cystatin C: a European multicenter analysis in older adults. Clin Chem Lab Med. 2018;56(3):422-435. doi: 10.1515/cclm-2017-0563.
- Yanagi S, Sato T, Kangawa K, Nakazato M. The homeostatic force of ghrelin. Cell Metab. 2018;27(4):786-804. doi: 10.1016/j.cmet.2018.02.008.
- Loos RJF, Yeo GSH. The genetics of obesity: from discovery to biology. Nat Rev Genet. 2022;23(2):120-133. doi: 10.1038/s41576-021-00414-z.
- Becer E, Ergoren MC. Dual effect of the GHRL gene va–riant in the molecular pathogenesis of obesity. Balkan J Med Genet. 2021;24(1):27-34. doi: 10.2478/bjmg-2021-0011.
- Atalayer D, Gibson C, Konopacka A, Geliebter A. Ghrelin and eating disorders. Prog Neuropsychopharmacol Biol Psychiatry. 2013;40:70-82. doi: 10.1016/j.pnpbp.2012.08.011.
- Kramer H. Diet and chronic kidney disease. Adv Nutr. 2019;10(Suppl 4):S367-S379. doi: 10.1093/advances/nmz011.
- Wang M, Wang Z, Chen Y, Dong Y. Kidney damage caused by obesity and its feasible treatment drugs. Int J Mol Sci. 2022;23(2):747. doi: 10.3390/ijms23020747.
- Ibrahim M, Khalife L, Abdel-Latif R, Faour WH. Ghrelin hormone a new molecular modulator between obesity and glomerular damage. Mol Biol Rep. 2023;50(12):10525-10533. doi: 10.1007/s11033-023-08866-8.