Международный эндокринологический журнал Том 21, №6, 2025
Вернуться к номеру
Генетичні аспекти дефіциту гормону росту у дітей: роль поліморфізмів VDR
Авторы: Ризничук М.О. (1), Большова О.В. (2), Кваченюк Д.А. (2), Пахомова В.Г. (2), Спринчук Н.А. (2)
(1) - Буковинський державний медичний університет, м. Чернівці, Україна
(2) - ДУ «Інститут ендокринології та обміну речовин імені В.П. Комісаренка НАМН України», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
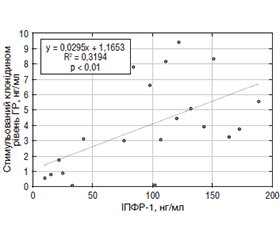
Актуальність. Останніми роками зростає увага до ролі вітаміну D та його рецептора (VDR) у регуляції не лише кальцієво-фосфорного обміну, але й диференціації соматотропних клітин гіпофіза, синтезу інсуліноподібного фактора росту-1 (ІПФР-1) у печінці та забезпечення нормального хрящового ремоделювання. Ген VDR містить низку поліморфізмів, серед яких найвивченішими є BsmI (rs1544410), TaqI (rs731236) та ApaI (rs7975232), що локалізовані в 3’-нетрансльованій ділянці гена. Хоча ці поліморфізми не змінюють амінокислотну послідовність рецептора, вони можуть впливати на стабільність мРНК та експресію VDR, модулюючи біологічну відповідь на вітамін D. Мета: визначення впливу поєднань поліморфізмів гена VDR (BsmI, TaqI, ApaI) на гормональні, метаболічні та біохімічні показники у дітей із дефіцитом гормону росту (ГР). Матеріали та методи. Генотипування було проведено у 42 дітей із підтвердженим дефіцитом ГР. Визначення поліморфізмів гена VDR (BsmI (rs1544410), TaqI (rs731236) та ApaI (rs7975232)) проводили за допомогою методу полімеразної ланцюгової реакції (ПЛР) з наступним аналізом довжини рестрикційних фрагментів при виявленні їх шляхом електрофорезу в агарозному гелі. Результати. Найчастіше виявлявся гетерозиготний генотип по трьох локусах гена VDR (G/A + T/C + А/С) — 55,56 %, а найрідше — патологічний гомозиготний варіант А/А + С/С + А/А (16,66 %). Аналіз основних клінічних та лабораторних показників продемонстрував, що діти з гомозиготним патологічним генотипом мали найнижчі значення базального та стимульованого рівня ГР, що вказує на більш виражений дефіцит гормональної активності. Рівень 25(ОН)D у крові був знижений у всіх групах, однак у дітей із нормальним генотипом фіксувався дефіцит, тоді як у гетеро- та гомозиготних групах — недостатність вітаміну D. Кореляційний аналіз показав значущі зв’язки між рівнем вітаміну D, показниками ІПФР-1, ГР, індексом маси тіла, кістковим віком (КВ) та показниками росту (Ht-SDS). Зокрема, виявлено сильний зворотний зв’язок між ІПФР-1 та Ht-SDS у дітей із патологічним гомозиготним генотипом. Біохімічні показники крові (кальцій, фосфор, креатинін, сечовина, холестерин) не мали значущих відмінностей між генотипами і знаходились у межах норми. Регресійний аналіз підтвердив значний вплив КВ на рівень ІПФР-1 та стимульованого ГР, а також взаємозв’язок між ІПФР-1 та стимульованим рівнем ГР. Висновки. Аналіз поєднань генотипів за поліморфізмами VDR та COL1A1 показав, що найбільш поширеним у дітей із дефіцитом ГР є комбінація GATCACGG (38,12 %). Отримані дані свідчать про важливу роль генетичних чинників у патогенезі дефіциту ГР, що може стати основою для розвитку персоніфікованих підходів у діагностиці, прогнозуванні та терапії даної патології.
Background. In recent years, growing attention has been focused on the role of vitamin D and its receptor (VDR) gene in regulating not only calcium-phosphorus metabolism but also the differentiation of somatotroph cells in the pituitary gland, synthesis of insulin-like growth factor 1 (IGF-1) in the liver, and the maintenance of normal cartilage remodeling. The VDR gene contains several polymorphisms, among which the most studied ones are BsmI (rs1544410), TaqI (rs731236), and ApaI (rs7975232), located in the 3’ untranslated region. Although these polymorphisms do not alter the amino acid sequence of the receptor, they may influence mRNA stability and VDR expression, thereby modulating the biological response to vitamin D. The purpose of the study was to assess the impact of combined VDR gene polymorphisms (BsmI, TaqI, ApaI) on hormonal, metabolic, and biochemical parameters in children with growth hormone (GH) deficiency. Materials and methods. Genotyping was performed in 42 children with confirmed GH deficiency. The VDR gene polymorphisms BsmI (rs1544410), TaqI (rs731236), and ApaI (rs7975232) were identified using polymerase chain reaction followed by restriction fragment length polymorphism analysis and agarose gel electrophoresis. Results. The most common genotype combination across the three loci was heterozygous (G/A + T/C + A/C) — 55.56 %, while the rarest was the homozygous pathological variant (A/A + C/C + A/A) — 16.66 %. Children with the homozygous pathological genotype had the lowest basal and stimulated GH levels, indicating more pronounced hormonal deficiency. Serum 25(OH)D levels were reduced in all groups; however, children with the normal genotype had vitamin D deficiency, while those with heterozygous and homozygous variants exhibited its insufficiency. Correlation analysis revealed significant relationships between vitamin D levels, IGF-1, GH, body mass index, bone age, and height standard deviation score. Notably, a strong inverse correlation was observed between IGF-1 and height standard deviation score in children with the pathological homozygous genotype. Blood biochemical parameters (calcium, phosphorus, creatinine, urea, cholesterol) showed no significant differences between genotypes and remained within normal limits. Regression analysis confirmed a significant influence of bone age on IGF-1 and stimulated GH levels, as well as an association between IGF-1 and stimulated GH. Conclusions. The analysis of combined genotypes of VDR and COL1A1 polymorphisms showed that the most prevalent combination in children with GH deficiency was GATCACGG (38.12 %). These findings underscore the critical role of genetic factors in the pathogenesis of GH deficiency and highlight the potential for developing personalized approaches to diagnosis, prognosis, and treatment of this condition.
дефіцит гормону росту; діти; поліморфізми гена VDR; кореляції
growth hormone deficiency; children; VDR gene polymorphisms; correlations
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Zhao Q, Li Y, Shao Q, Zhang C, Kou S, Yang W, Zhang M, Ban B. Clinical and genetic evaluation of children with short stature of unknown origin. BMC Med Genomics. 2023 Aug 21;16(1):194. doi: 10.1186/s12920-023-01626-4. PMID: 37605180; PMCID: PMC10441754.
- Martinez-Monseny AF. Unravelling short stature in pediatrics: the crucial role of genetic perspective. Transl Pediatr. 2024 May 31;13(5):864-868. doi: 10.21037/tp-24-46. Epub 2024 May 20. PMID: 38840673; PMCID: PMC11148743.
- Boguszewski MCS. Growth hormone deficiency and replacement in children. Rev Endocr Metab Disord. 2021 Mar;22(1):101-108. doi: 10.1007/s11154-020-09604-2. Epub 2020 Oct 8. PMID: 33029711.
- Vasques GA, Andrade NLM, Correa FA, Jorge AAL. Update on new GH-IGF axis genetic defects. Arch Endocrinol Metab. 2019 Nov-Dec;63(6):608-617. doi: 10.20945/2359-3997000000191. PMID: 31939486; PMCID: PMC10522240.
- Chinoy A, Murray PG. Diagnosis of growth hormone deficiency in the paediatric and transitional age. Best Pract Res Clin Endocrinol Metab. 2016 Dec;30(6):737-747. doi: 10.1016/j.beem.2016.11.002. Epub 2016 Nov 4. PMID: 27974187.
- Christakos S, Dhawan P, Verstuyf A, Verlinden L, Carmeliet G. Vitamin D: Metabolism, Molecular Mechanism of Action, and Pleiotropic Effects. Physiol Rev. 2016 Jan;96(1):365-408. doi: 10.1152/physrev.00014.2015. PMID: 26681795; PMCID: PMC4839493.
- Tsaryk I, Pashkovska N, Pankiv V, Pashkovskyy V, Stankova N. Features of Anxiety and Depression Indicators in Patients With Autoimmune Diabetes Mellitus on the Background of Different Vitamin D Status. Romanian Journal of Diabetes Nutrition and Metabolic Diseases. 2025;32(2):203-209. doi: 10.46389/rjd-2025-1873.
- Grygorieva N, Tronko M, Kovalenko V, Komisarenko S, Tatarchuk T, Dedukh N, Veliky M, et al. Ukrainian Consensus on Diag–nosis and Management of Vitamin D Deficiency in Adults. Nutrients. 2024 Jan 16;16(2):270. doi: 10.3390/nu16020270. PMID: 38257163; PMCID: PMC10820145.
- Bouillon R, Marcocci C, Carmeliet G, Bikle D, White JH, Dawson-Hughes B, Lips P, et al. Skeletal and Extraskeletal Actions of Vitamin D: Current Evidence and Outstanding Questions. Endocr Rev. 2019 Aug 1;40(4):1109-1151. doi: 10.1210/er.2018-00126. PMID: 30321335; PMCID: PMC6626501.
- Bikle D, Christakos S. New aspects of vitamin D metabolism and action – addressing the skin as source and target. Nat Rev Endocrinol. 2020 Apr;16(4):234-252. doi: 10.1038/s41574-019-0312-5. Epub 2020 Feb 6. PMID: 32029884.
- Gasperini B, Visconti VV, Ciccacci C, Falvino A, Gasbarra E, Iundusi R, Brandi ML, et al. Role of the Vitamin D Receptor (VDR) in the Pathogenesis of Osteoporosis: A Genetic, Epigenetic and Molecular Pilot Study. Genes (Basel). 2023 Feb 21;14(3):542. doi: 10.3390/genes14030542. PMID: 36980815; PMCID: PMC10048253.
- Li Y, Zhao P, Jiang B, Liu K, Zhang L, Wang H, Tian Y, et al. Modulation of the vitamin D/vitamin D receptor system in osteoporosis pathogenesis: insights and therapeutic approaches. J Orthop Surg Res. 2023 Nov 13;18(1):860. doi: 10.1186/s13018-023-04320-4. PMID: 37957749; PMCID: PMC10644527.
- Coşkun S, Şimşek Ş, Camkurt MA, Çim A, Çelik SB. Association of polymorphisms in the vitamin D receptor gene and serum 25-hydroxyvitamin D levels in children with autism spectrum disorder. Gene. 2016 Aug 22;588(2):109-14. doi: 10.1016/j.gene.2016.05.004. Epub 2016 May 4. PMID: 27155524.
- Abouzid M, Kruszyna M, Burchardt P, Kruszyna Ł, Główka FK, Karaźniewicz-Łada M. Vitamin D Receptor Gene Polymorphism and Vitamin D Status in Population of Patients with Cardiovascular Disease — A Preliminary Study. Nutrients. 2021 Sep 6;13(9):3117. doi: 10.3390/nu13093117. PMID: 34578994; PMCID: PMC8465937.
- Grant WB, Wimalawansa SJ, Pludowski P, Cheng RZ. Vitamin D: Evidence-Based Health Benefits and Recommendations for Population Guidelines. Nutrients. 2025 Jan 14;17(2):277. doi: 10.3390/nu17020277. PMID: 39861407; PMCID: PMC11767646.
- LeBoff MS, Greenspan SL, Insogna KL, Lewiecki EM, Saag KG, Singer AJ, Siris ES. The clinician’s guide to prevention and treatment of osteoporosis. Osteoporos Int. 2022 Oct;33(10):2049-2102. doi: 10.1007/s00198-021-05900-y. Epub 2022 Apr 28. Erratum in: Osteoporos Int. 2022 Oct;33(10):2243. doi: 10.1007/s00198-022-06479-8. PMID: 35478046; PMCID: PMC9546973.
- Demay MB, Pittas AG, Bikle DD, Diab DL, Kiely ME, Laza–retti-Castro M, Lips P, et al. Vitamin D for the Prevention of Disease: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2024 Jul 12;109(8):1907-1947. doi: 10.1210/clinem/dgae290. Erratum in: J Clin Endocrinol Metab. 2025 Feb 18;110(3):e916. doi: 10.1210/clinem/dgae854. Erratum in: J Clin Endocrinol Metab. 2025 Jul 15;110(8):e2810. doi: 10.1210/clinem/
- Sun J. Bringing Vitamin D and the Vitamin D Receptor into the Limelight. Biomolecules. 2024 Aug 31;14(9):1094. doi: 10.3390/biom14091094. PMID: 39334859; PMCID: PMC11430401.
- Saponaro F, Saba A, Zucchi R. An Update on Vitamin D Metabolism. Int J Mol Sci. 2020 Sep 8;21(18):6573. doi: 10.3390/ijms21186573. PMID: 32911795; PMCID: PMC7554947.
- Márquez Pete N, Pérez Ramírez C, Maldonado Montoro MDM, Martínez Martínez F, Fernández-Llimos F, Sánchez Pozo A, Ramírez Tortosa MDC, Jiménez Morales A. Association of vitamin D receptor gene polymorphisms with rheumatoid arthritis. Arch Med Sci. 2021 Mar 22;20(5):1529-1537. doi: 10.5114/aoms/116606. PMID: 39649257; PMCID: PMC11623149.
- Pankiv V, Yuzvenko T, Kobyliak N, Pankiv I. Correction of Androgen Deficiency in Men with Type 2 Diabetes. Rev Recent Clin Trials. 2022;17(1):34-39. doi: 10.2174/1574887116666211202155304. PMID: 34856912.
- Wimalawansa SJ, Weiss ST, Hollis BW. Integrating Endocrine, Genomic, and Extra-Skeletal Benefits of Vitamin D into National and Regional Clinical Guidelines. Nutrients. 2024 Nov 20;16(22):3969. doi: 10.3390/nu16223969. PMID: 39599755; PMCID: PMC11597479.
- De Azevêdo Silva J, de Lima CAD, Guaraná WL, Barbosa AD, Fragoso TS, Duarte ÂLBP, Crovella S, Sandrin-Garcia P. Vitamin D receptor gene polymorphisms influence on clinical profile and bone mineral density at different skeletal sites in postmenopausal osteoporotic women. Int J Immunogenet. 2023 Apr;50(2):75-81. doi: 10.1111/iji.12613. Epub 2023 Feb 1. PMID: 36725689.
- Holick MF. The vitamin D deficiency pandemic: Approaches for diagnosis, treatment and prevention. Rev Endocr Metab Disord. 2017 Jun;18(2):153-165. doi: 10.1007/s11154-017-9424-1. PMID: 28516265.
- Uitterlinden AG, Fang Y, Van Meurs JB, Pols HA, Van Leeuwen JP. Genetics and biology of vitamin D receptor polymorphisms. Gene. 2004 Sep 1;338(2):143-56. doi: 10.1016/j.gene.2004.05.014. PMID: 15315818.
- Juul A, Bang P, Hertel NT, Main K, Dalgaard P, Jørgensen K, Müller J, et al. Serum insulin-like growth factor-I in 1030 healthy children, adolescents, and adults: relation to age, sex, stage of puberty, testicular size, and body mass index. J Clin Endocrinol Metab. 1994 Mar;78(3):744-52. doi: 10.1210/jcem.78.3.8126152. PMID: 8126152.
- Fang Y, van Meurs JB, d’Alesio A, Jhamai M, Zhao H, Rivadeneira F, Hofman A, et al. Promoter and 3’-untranslated-region haplotypes in the vitamin d receptor gene predispose to osteoporotic fracture: the rotterdam study. Am J Hum Genet. 2005 Nov;77(5):807-23. doi: 10.1086/497438. Epub 2005 Sep 26. PMID: 16252240; PMCID: PMC1271389.