Журнал «Здоровье ребенка» Том 20, №6, 2025
Вернуться к номеру
Сучасні епідеміологічні особливості кашлюку та проблемні питання вакцинопрофілактики цієї інфекції
Авторы: Задорожна В.І. (1), Винник Н.П. (1), Сергеєва Т.А. (1), Подаваленко А.П. (2)
(1) - ДУ «Інститут епідеміології та інфекційних хвороб ім. Л.В. Громашевського НАМН України», м. Київ, Україна
(2) - Харківський національний медичний університет, м. Харків, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
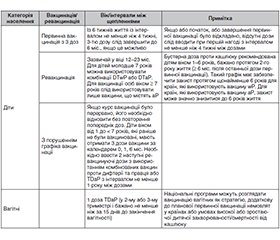
Актуальність. Для профілактики кашлюку застосовуються вакцини з цільноклітинним та ацелюлярним компонентами. Після пандемії COVID-19 у низці країн спостерігається зростання захворюваності, що свідчить про зниження вакциноконтрольованості. Мета роботи: оцінити тенденції епідемічного процесу кашлюку на глобальному та регіональному рівнях і проаналізувати причини зростання захворюваності, зокрема серед вакцинованих осіб. Матеріали та методи. Проведено систематичний аналіз публікацій і звітів із використанням баз даних (PubMed, Scopus, Web of Science, Google Scholar) та джерел ВООЗ, CDC, ECDC. Вивчено динаміку захворюваності, ефективність вакцинації, ріст випадків серед щеплених, регіональні особливості епідпроцесу, стан розробок щодо отримання нових вакцин. Для України порівнювали захворюваність за 6 міс. 2024 та 2025 рр. Результати. Найвищий приріст захворюваності зафіксовано в Європейському регіоні ВООЗ (53,6 % світових випадків). В Україні після спалаху у 2024 р. (7545 випадків; 18,4 на 100 тис. населення) за 6 міс. 2025 р. зареєстровано 842 випадки, що в 5,8 раза менше. Це свідчить про повернення циклічності інфекції. Офіційні показники в Україні є заниженими через розрахунки на довоєнну кількість населення, що особливо актуально в умовах війни. Гіподіагностика підтверджується серологічними дослідженнями серед здорового населення та пацієнтів із тривалим кашлем. Наявність безсимптомної персистенції Bordetella pertussis і гіподіагностика маніфестних форм створюють ризики для немовлят, які ще не були імунізовані. Високий відсоток хворих серед вакцинованих, формування антибіотикорезистентних штамів і зниження тривалості поствакцинального імунітету актуалізують потребу у створенні більш ефективних вакцин із урахуванням антигенної відповідності збудника. Висновки. Спостерігається зниження вакциноконтрольованості та зміна епідеміологічних характеристик кашлюку, особливо після пандемії COVID-19. В Україні після піку в 2024 р. відзначається зменшення захворюваності в 2025 р., що вказує на циклічність інфекції. Гіподіагностика та статистичні викривлення залишаються актуальними проблемами. Вакцинальні стратегії різняться між країнами. Тривають розробки нових вакцин з урахуванням еволюційних змін патогена.
Background. Whole-cell and acellular pertussis vaccines are used for the prevention of the disease. Following the COVID-19 pandemic, an increase in pertussis incidence has been observed in several countries, indicating a decline in vaccine-controlled disease management. The purpose was to assess global and regional trends in the pertussis epidemic process and analyze the causes of increasing incidence, particularly among vaccinated individuals. Materials and methods. A systematic review of publications and reports was conducted using databases (PubMed, Scopus, Web of Science, Google Scholar) and sources from the WHO, CDC, and ECDC. The analysis covered incidence trends, vaccine effectiveness, the rise in cases among vaccinated individuals, regional epidemiological patterns, and progress in the development of new vaccines. For Ukraine, incidence rates during the first 6 months of 2024 and 2025 were compared. Results. The highest increase in incidence was recorded in the WHO European Region (53.6 % of global cases). In Ukraine, following an outbreak in 2024 (7,545 cases; 18.4 per 100,000 population), 842 cases were reported in the first half of 2025 that is 5.8 times fewer, suggesting a return to the cyclical nature of the infection. Official incidence rates in Ukraine are underestimated due to calculations based on the pre-war population size, which is particularly relevant under wartime conditions. Underdiagnosis is confirmed by serological studies among healthy individuals and patients with prolonged cough. Asymptomatic persistence of Bordetella pertussis and underdiagnosis of manifest forms pose significant risks for infants who have not yet been immunized. A high proportion of cases among vaccinated individuals, the emergence of antibiotic-resistant strains, and the waning of post-vaccination immunity underscore the urgent need for more effective vaccines aligned with the antigenic characteristics of circulating strains. Conclusions. A decline in vaccine-controlled management and changes in the epidemiological features of pertussis have been observed, particularly following the COVID-19 pandemic. In Ukraine, after a peak in 2024, incidence has decreased in 2025, indicating the cyclical nature of the infection. Underdiagnosis and statistical distortions remain pressing issues. Vaccination strategies differ across countries, and efforts to develop new vaccines considering pathogen evolution are ongoing.
кашлюк; епідемічна ситуація; епідемічний процес; вакцинопрофілактика; вакцини проти кашлюку; Bordetella pertussis
pertussis; epidemic situation; epidemic process; vaccine prophylaxis; pertussis vaccines; Bordetella pertussis
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Belcher T, Dubois V, Rivera-Millot A, Locht C, Jacob-Dubuisson F. Pathogenicity and virulence of Bordetella pertussis and its adaptation to its strictly human host. Virulence. 2021 Dec;12(1):2608-2632. doi: 10.1080/21505594.2021.1980987. PMID: 34590541; PMCID: PMC8489951.
- Brenzel L, Wolfson LJ, Fox-Rushby J, Miller M, Halsey NA. Vaccine preventable diseases. In: Jamison DT, Breman JG, Measham AR, et al., editors. Disease control priorities in developing countries [Internet]. 2nd ed. New York: Oxford University Press; 2006 [cited 2025 Aug 1]. Р. 389-412. Available from: https://dcp-3.org/.
- WHO. Pertussis vaccines: WHO position paper, August 2015 — Recommendations. Vaccine. 2016 Mar 14;34(12):1423-5. doi: 10.1016/j.vaccine.2015.10.136. PMID: 26562318.
- Liu Y, Yang Y, Zhou J, Zhang X, Gu L, Xu Y, et al. Econo–mic burden of pertussis in children: A single-center analysis in Hangzhou, China. Hum Vaccin Immunother. 2024 Dec 31;20(1):2343199. doi: 10.1080/21645515.2024.2343199. PMID: 38647026; PMCID: PMC11037283.
- Shi W, Meng Q, Hu Y, Feng G, Wang X, Yao K. Epidemiology of pertussis among pediatric inpatients in mainland China. J Infect. 2024 Dec;89(6):106327. doi: 10.1016/j.jinf.2024.106327. PMID: 39490385.
- Finger H, von Koenig CHW. Bordetella. In: Baron S, editor. Me–dical Microbiology [Internet]. 4th ed. Galveston (TX): University of Texas Medical Branch at Galveston; 1996 [cited 2025 Aug 1]. Chapter 31. Avai–lable from: https://www.ncbi.nlm.nih.gov/books/NBK7813/.
- Hoffman CL, Gonyar LA, Zacca F, Sisti F, Fernandez J, Wong T, et al. Bordetella pertussis Can Be Motile and Express Flagellum-Like Structures. mBio. 2019 May 14;10(3):e00787-19. doi: 10.1128/mBio.00787-19. PMID: 31088927; PMCID: PMC6520453.
- National Institute of Infectious Diseases (Japan). Pertussis in Japan, as of January 2017. IASR [Internet]. 2017 Feb;38:23-24 [cited 2025 Aug 1]. Available from: https://www.niid.go.jp/niid/en/accessmap-2/865-iasr/7093-444te.html.
- Oviedo JM, Surmann K, Gorgojo JP, Valdez H, Dhople VM, Lamberti Y, et al. Shotgun proteomic analysis of Bordetella parapertussis provides insights into the physiological response to iron starvation and potential new virulence determinants absent in Bordetella pertussis. J Proteomics. 2019 Aug 30;206:103448. doi: 10.1016/j.jprot.2019.103448. Epub 2019 Jul 17. PMID: 31325608.
- Abu-Raya B, Esser MJ, Nakabembe E, Reiné J, Amaral K, Diks AM, et al. Antibody and B-cell Immune Responses Against Bordetella Pertussis Following Infection and Immunization. J Mol Biol. 2023 Dec 15;435(24):168344. doi: 10.1016/j.jmb.2023.168344. Epub 2023 Nov 4. PMID: 37926426.
- World Health Organization. WHO recommendations for routine immunization — summary tables [Internet]. Geneva: WHO; [cited 2025 Aug 1]. Available from: https://www.who.int/teams/immunization-vaccines-and-biologicals/policies/who-recommendations-for-routine-immunization---summary-tables).
- Chen GW, Guo L, Huang J, Ma H, Fernandez-Castillo S, Soubal-Mora JP, et al. Synthesis of oligosaccharides from terminal B. pertussis LPS pentasaccharide and definition of the minimal epitope recognized by anti-pertussis antibodies. Glycoconj J. 2024 Oct;41(4-5):241-254. doi: 10.1007/s10719-024-10160-z. PMID: 39046578.
- Hozbor D. New Pertussis Vaccines: A Need and a Challenge. Adv Exp Med Biol. 2019;1183:115-126. doi: 10.1007/5584_2019_407. PMID: 31432399.
- Centers for Disease Control and Prevention (CDC). Pertussis Surveillance and Trends [Internet]. Atlanta: CDC; [cited 2025 Aug 1]. Available from: https://www.cdc.gov/pertussis/php/surveillance/index.html.
- World Health Organization. A brief history of vaccination [Internet]. Geneva: WHO; [cited 2025 Aug 1]. Available from: https://www.who.int/news-room/spotlight/history-of-vaccination/a-brief-history-of-vaccination.
- Centers for Disease Control and Prevention (CDC). Pertussis cases by year (1922–2022) [Internet]. Atlanta: CDC; [cited 2025 Aug 1]. Available from: https://www.cdc.gov/pertussis/php/surveillance/pertussis-cases-by-year.html.
- Centers for Disease Control and Prevention (CDC). 2024 provisional pertussis surveillance report. 2025 Jan [Internet]. Atlanta: CDC; [cited 2025 Aug 1]. Available from: https://www.cdc.gov/pertussis/media/pdfs/2025/01/pertuss-surv-report-2024_PROVISIONAL-508.pdf.
- Elflein J. Pertussis number of cases by region worldwide 1980–2023 [Internet]. New York: Statista; 2024 Sep 24 [cited 2025 Aug 1]. Available from: https://www.statista.com/statistics/1121403/pertussis-cases-worldwide-by-region/.
- Centers for Disease Control and Prevention (CDC). Pertussis: (Week 16) Weekly cases* of notifiable diseases, United States, U.S. Territories, and Non-U.S. Residents week ending April 19, 2025 [Internet]. Atlanta: CDC; 2025 Apr 19 [cited 2025 Aug 1]. Available from: https://stacks.cdc.gov/view/cdc/177663.
- World Health Organization. Pertussis reported cases and incidence [Internet]. Geneva: WHO; [cited 2025 Aug 1]. Available from: https://immunizationdata.who.int/global/wiise-detail-page/pertussis-reported-cases-and-incidence?CODE=Global&YEAR=.
- Centers for Disease Control and Prevention (CDC). Whoo–ping Cough [Internet]. Atlanta: CDC; [cited 2025 Aug 1]. Available from: https://www.cdc.gov/pertussis/php/global/index.html.
- Venkatesan P. Whooping cough cases rising. Lancet Respir Med. 2024 Aug;12(8):e50. doi: 10.1016/S2213-2600(24)00204-2. PMID: 38909618.
- European Centre for Disease Prevention and Control (ECDC). Increase of pertussis cases in the EU/EEA [Internet]. Stockholm: ECDC; [cited 2025 Aug 1]. Available from: https://www.ecdc.europa.eu/en/publications-data/increase-pertussis-cases-eueea.
- Tessier E, Campbell H, Ribeiro S, Rai Y, Burton S, Roy P, et al. Impact of the COVID-19 pandemic on Bordetella pertussis infections in England. BMC Public Health. 2022 Feb 28;22(1):405. doi: 10.1186/s12889-022-12830-9. PMID: 35220973; PMCID: PMC8882439.
- Matczak S, Levy C, Fortas C, Cohen JF, Béchet S, Aït El Belghiti F, et al. Association between the COVID-19 pandemic and pertussis derived from multiple nationwide data sources, France, 2013 to 2020. Euro Surveill. 2022 Jun;27(25):2100933. doi: 10.2807/1560-7917.ES.2022.27.25.2100933. PMID: 35748301; PMCID: PMC9229195.
- Macina D, Evans KE. Bordetella pertussis in School-Age Children, Adolescents and Adults: A Systematic Review of Epidemio–logy and Mortality in Europe. Infect Dis Ther. 2021 Dec;10(4):2071-2118. doi: 10.1007/s40121-021-00520-9. PMID: 34435338; PMCID: PMC8387212.
- Connelly D. Whooping cough resurgence as vaccination rates slump. Pharm J. 2024 Mar;312(7983). doi: 10.1211/PJ.2024.1.306834.
- Miettinen M, Barkoff AM, Nyqvist A, Savolainen-Kopra C, Antikainen J, Mertsola J, et al. Macrolide-resistant Bordetella pertussis strain identified during an ongoing epidemic, Finland, January to October 2024. Euro Surveill. 2024 Dec;29(49):2400765. doi: 10.2807/1560-7917.ES.2024.29.49.2400765. PMID: 39639816; PMCID: PMC11650481.
- Ávila-Franco P, González MD, Puente-Fuertes L, Eiros JM. Brote de tosferina en 2024. ¿Nuevo patrón de distribución en el contagio? ¿Se debería replantear el refuerzo de dosis en la vacunación? [Whooping cough outbreak in 2024. New distribution pattern in contagion? Should the booster doses in vaccination be reconsidered?]. Rev Esp Quimioter. 2025 Mar 3;38(2):133-135 [Spanish]. doi: 10.37201/req/102.2024. PMID: 39950447; PMCID: PMC11894564.
- Podavalenko AP, Nessonova TD, Zadorozhna VI, Hrytsenko LМ. Epidemiological analysis of pertussis morbidity in Ukraine. Wiad Lek. 2021;74(7):1628-1633. doi: 10.36740/WLek202107114.
- Задорожна В.І., Винник Н.П., Сергеєва Т.А., Подаваленко А.П. Характеристика епідемічного процесу кашлюка в Україні на тлі пандемії COVID-19 і воєнного стану. Сучасна педіатрія. Україна. 2025;(3):6-19. doi: 10.15574/SP.2025.3(147).619.
- Du QQ, Hu YH, Meng QH, Yu D, Yao KH. Unique factors to consider when exploring the surge in reported pertussis cases in China. Lancet Microbe. 2024 Dec;5(12):100959. doi: 10.1016/j.lanmic.2024.100959. PMID: 39163868.
- Sun X, Zhang T, Sun J, Zhou J, Chen Q, Jia C, et al. The seroepidemiology of immunoglobulin G antibodies against pertussis toxin and filamentous hemagglutinin in the east of China during the COVID-19 pandemic. Hum Vaccin Immunother. 2024 Dec 31;20(1):2331438. doi: 10.1080/21645515.2024.2331438. PMID: 38517269; PMCID: PMC10962620.
- Xu W, Fu C, Zheng C, Gong X, Fang Q, Yin Z. Epidemiological characteristics and survival analysis of pertussis in Quzhou. Hum Vaccin Immunother. 2024;20(1). doi: 10.1080/21645515.2024.2420448. PMID: 39474925.
- Chitkara AJ, Balasubramanian S, Choudhury J, Dash N, Forsyth K, Heininger U, et al. Pertussis in India: Past, Present, and Future. Indian J Pediatr. 2023 Apr;90(4):393-399. doi: 10.1007/s12098-022-04384-w. PMID: 36522518.
- Medindia. Whooping cough — prevalence & deaths in India [Internet]. Chennai: Medindia; [cited 2025 Aug 1]. Available from: https://www.medindia.net/patients/patientinfo/whooping-cough-prevalence-and-deaths.htm.
- Irulappan M, Jacob JJ, Madhumathi J, Lydia Jennifer S, Kumaresan V, Kumar R, et al. Pertussis in India: Vaccine-driven evolution, waning immunity, and the urgent need for Tdap boosters. Indian J Med Microbiol. 2025 May — Jun;55:100846. doi: 10.1016/j.ijmmb.2025.100846. PMID: 40221094.
- Raufi R, Zareian-Jahromi F, Zangeneh S, Rajabi J, Shahriarirad R. Seroepidemiological Assessment of Bordetella pertussis in Jahrom, Southern Iran: A Cross-Sectional Study. Health Care Sci. 2025 Feb 17;4(1):44-51. doi: 10.1002/hcs2.70000.
- Pacific Community. Increasing trends of pertussis (whooping cough): Health advisory for Pacific Island health professionals, 1 August 2024 [Internet]. Noumea: Pacific Community; 2024 Aug 1 [cited 2025 Aug 1]. Available from: https://phd.spc.int/sites/default/files/p-related-files/2024-09/Health%20advisory%20for%20PICTs%20on%20increasing%20trends%20of%20pertussis_1%20August%202024.pdf.
- Althouse BM, Scarpino SV. Asymptomatic transmission and the resurgence of Bordetella pertussis. BMC Med. 2015 Jun 24;13:146. doi: 10.1186/s12916-015-0382-8. PMID: 26103968; PMCID: PMC4482312.
- Kim AR, Sette A, da Silva Antunes R. Adaptive immune response to bordetella pertussis during vaccination and infection: emerging perspectives and unanswered questions. Expert Rev Vaccines. 2024 Jan — Dec;23(1):705-714. doi: 10.1080/14760584.2024.2383745. PMID: 39037200; PMCID: PMC11306532.
- Kapil P, Merkel TJ. Pertussis vaccines and protective immunity. Curr Opin Immunol. 2019 Aug;59:72-78. doi: 10.1016/j.coi.2019.03.006. PMID: 31078081; PMCID: PMC6774807.
- Solans L, Locht C. The Role of Mucosal Immunity in Pertussis. Front Immunol. 2019 Jan 14;9:3068. doi: 10.3389/fimmu.2018.03068. PMID: 30692990; PMCID: PMC6339907.
- Silva RP, DiVenere AM, Amengor D, Maynard JA. Antibodies binding diverse pertactin epitopes protect mice from Bordetella pertussis infection. J Biol Chem. 2022 Mar;298(3):101715. doi: 10.1016/j.jbc.2022.101715. PMID: 35151691; PMCID: PMC8931430.
- Paireau J, Guillot S, Aït El Belghiti F, Matczak S, Trombert-Paolantoni S, Jacomo V, et al. Effect of change in vaccine schedule on pertussis epidemiology in France: a modelling and serological study. Lancet Infect Dis. 2022 Feb;22(2):265-273. doi: 10.1016/S1473-3099(21)00267-X. Epub 2021 Oct 18. Erratum in: Lancet Infect Dis. 2024 Sep;24(9):e549. doi: 10.1016/S1473-3099(21)00684-8. PMID: 34672963.
- Yu J, He H, Zhang Y, Gao Y, Chen C, Xu J, et al. Burden of whooping cough in China (PertussisChina): study protocol of a prospective, population-based case-control study. BMJ Open. 2022 Mar 10;12(3):e053316. doi: 10.1136/bmjopen-2021-053316. PMID: 35273046; PMCID: PMC8915282.
- Zhang Z, Pan J, Chen M, Zhang T, Li J, Lu L. Seroepidemiology of pertussis in China: A population-based, cross-sectional study. Vaccine. 2021 Mar 19;39(12):1687-1692. doi: 10.1016/j.vaccine.2021.02.032. PMID: 33642160.
- Puthanakit T, Chokephaibulkit K, Anugulruengkitt S, Chaithongwongwatthana S, Phongsamart W, Wittawatmongkol O, et al. Infant Responses to Primary Immunization Following Vaccination in Pregnancy With Varying Doses of Recombinant Acellular Pertussis Vaccine Alone or Combined With Tetanus-Diphtheria. Pediatr Infect Dis J. 2025 Feb 1;44(2S):S56-S60. doi: 10.1097/INF.0000000000004609. PMID: 39951076.
- Locht C. The Path to New Pediatric Vaccines against Pertussis. Vaccines (Basel). 2021 Mar 5;9(3):228. doi: 10.3390/vaccines9030228. PMID: 33807962; PMCID: PMC7998139.
- Škopová K, Holubová J, Bočková B, Slivenecká E, Santos de Barros JM, Staněk O, et al. Less reactogenic whole-cell pertussis vaccine confers protection from Bordetella pertussis infection. mSphere. 2025 Apr 29;10(4):e0063924. doi: 10.1128/msphere.00639-24. PMID: 40071951.
- Blanchard Rohner G, Chatzis O, Chinwangso P, Rohr M, Gril–let S, Salomon C, et al. Boosting Teenagers With Acellular Pertussis Vaccines Containing Recombinant or Chemically Inactivated Pertussis Toxin: A Randomized Clinical Trial. Clin Infect Dis. 2019 Mar 19;68(7):1213-1222. doi: 10.1093/cid/ciy594. PMID: 30759183.
- Zurita ME, Wilk MM, Carriquiriborde F, Bartel E, Moreno G, Misiak A, et al. A Pertussis Outer Membrane Vesicle-Based Vaccine Induces Lung-Resident Memory CD4 T Cells and Protection Against Bordetella pertussis, Including Pertactin Deficient Strains. Front Cell Infect Microbiol. 2019 Apr 26;9:125. doi: 10.3389/fcimb.2019.00125. PMID: 31106160; PMCID: PMC6498398.
- Carriquiriborde F, Martin Aispuro P, Ambrosis N, Zurita E, Bottero D, Gaillard ME, et al. Pertussis vaccine candidate based on outer membrane vesicles derived from biofilm culture. Front Immunol. 2021 Sep 15;12:730434. doi: 10.3389/fimmu.2021.730434. PMID: 34603306; PMCID: PMC8479151.
- Allen AC, Wilk MM, Misiak A, Borkner L, Murphy D, Mills KHG. Sustained protective immunity against Bordetella pertussis nasal colonization by intranasal immunization with a vaccine-adjuvant combination that induces IL-17-secreting TRM cells. Mucosal Immunol. 2018 Nov;11(6):1763-1776. doi: 10.1038/s41385-018-0080-x. PMID: 30127384.
- Wang P, Ramadan S, Dubey P, Deora R, Huang X. Development of carbohydrate based next-generation anti-pertussis vaccines. Bioorg Med Chem. 2022 Nov 15;74:117066. doi: 10.1016/j.bmc.2022.117066. PMID: 36283250; PMCID: PMC9925305.
- Monterrubio-López GP, Llamas-Monroy JL, Martínez-Gómez ÁA, Delgadillo-Gutiérrez K. Novel vaccine candidates of Bordetella pertussis identified by reverse vaccinology. Biologicals. 2024 Feb;85:101740. doi: 10.1016/j.biologicals.2023.101740. PMID: 38217963.
- Chasaide CN, Mills KHG. Next-Generation Pertussis Vaccines Based on the Induction of Protective T Cells in the Respiratory Tract. Vaccines (Basel). 2020 Oct 21;8(4):621. doi: 10.3390/vaccines8040621. PMID: 33096737; PMCID: PMC7711671.