Журнал «Здоровье ребенка» Том 20, №6, 2025
Вернуться к номеру
Прогнозування ризику розвитку олігоорганного та поліорганних фенотипів атопічного маршу в дітей
Авторы: Дитятковський В.О., Абатуров О.Є.
Дніпровський державний медичний університет, м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
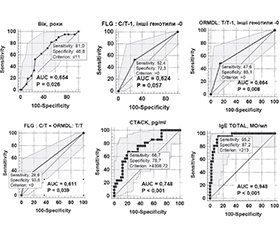
Актуальність. На сьогодні існує невирішене питання персоналізованої діагностики та предикції ризиків розвитку фенотипів атопічних хвороб (АХ) та атопічного маршу (АМ) у дітей. Метою поданого дослідження була розробка інтегральної моделі персоналізовано-прецизійної предикативної генотип-асоційованої діагностики щодо ризику розвитку олігоорганного та поліорганних фенотипів (ООФ, ПОФ) АМ у дітей. Матеріали та методи. У дослідження були залучені 68 дітей віком від 3 до 18 років: 21 — до основної групи; 47 — до контрольної групи. Критеріями включення до основної групи були АХ у комбінаціях атопічного дерматиту (АД), алергічного риніту або ринокон’юнктивіту (АР/АРК) і/або бронхіальної астми (БА): АД+АР/АРК, БА+АР/АРК, АД+АР/АРК+БА. Критерії включення до контрольної групи: функціональна і/або органічна патологія травної системи, відсутність АХ. Усім дітям було зроблено генотипування на варіанти однонуклеотидних варіацій (SNV) rs7927894 гена філагрину (filaggrin — FLG) і rs7216389 гена оросомукоїд-1-подібного білка 3 (orosomucoid-like 3 — ORMDL3) і визначено концентрації в сироватці крові біомаркерів: рутинного загального імуноглобуліну Е (IgE) і новітнього біомаркера-кандидата, кутанного Т-клітинного атрактивного хемокіну (cuteaneous t-cell attracting chemokine — CTACK/CCL27). Результати. Були отримані такі функціональні значення предикторів ризику розвитку ООФ і ПОФ АМ у дітей: вік дитини ≤ 11 років — співвідношення шансів (СШ) з 95% довірчим інтервалом (95% ДІ) становило 3,74 (1,09–12,8), р = 0,025; гетерозиготний генотип С/Т rs7927894 FLG — 2,88 (0,99–8,38), р = 0,051; гомозиготний генотип Т/Т rs7216389 ORMDL3 — 5,19 (1,61–16,8), р = 0,051; комбінація генотипів С/Т rs_7927894 FLG + Т/T rs_7216389 ORMDL3 — 5,87 (1,30–26,42), р = 0,017; концентрація в сироватці крові CTACK/CCL27 ≥ 4308,8 пг/мл — 7,4 (2,35–23,26), р < 0,001; концентрація в сироватці крові загального IgE ≥ 213 МО/мл — 136,7 (15,4–1213,2), р < 0,001. Надалі були отримані діагностичні коефіцієнти (ДК) для моделі персоналізованої предикативної генотип-асоційованої діагностики ризику розвитку ПОФ АМ у дітей (за рангом): 1 — загальний IgE ≥ 213 МО/мл — ДК = +8,7; 2 — CTACK/CCL27 ≥ 4308,8 пг/мл — ДК = +5,0; 3 — Т/T rs_7216389 ORMDL3 — ДК = +5,0; 4 — С/Т rs_7927894 FLG + Т/T rs_7216389 ORMDL3 – ДК = +6,5; 5 — С/Т rs7927894 FLG — ДК = +2,8; 6 — вік ≤ 11 років — ДК = +1,8. Пороговим значенням суми ДК було визначено > 11,8 бала: при значенні 0–6,8 бала ризик розвитку ПОФ АМ у дітей був дуже низьким, при 7,8–9,6 бала — низьким, при 10–11,8 бала — підвищеним, при 12,8–14,6 бала — високим і при ≥ 15,5 бала — дуже високим. Висновки. Для персоналізовано-прецизійної предикції ризику розвитку олігоорганних і/або поліорганних фенотипів АМ у дітей пропонується застосування генотип-асоційованої інтегральної моделі, яка включає широкий спектр факторів-предикторів, як-от: загальнобіологічний — вік дітей до 11 років; генетичні — генотипи С/Т rs7927894 FLG, Т/Т rs7216389 ORMDL3; біохімічні — рівні сироваткових концентрацій загального IgE ≥ 213 МО/мл і CTACK/CCL27 ≥ 4308,8 пг/мл. Пороговим значенням підвищеного ризику розвитку даних фенотипів у дітей є сума ДК > 11,8 бала.
Background. To date, there is an unresolved issue of personalized diagnosis and predicting the risks of developing phenotypes of atopic disorders (ADis) and atopic march (AM) in children. The objective: to design an integrated model of personalized precision predictive genotype-associated diagnosis (PPPGAD) regarding the risk of developing oligoorgan (OOPh) and multiorgan phenotypes (MOPh) of AM in children. Materials and methods. The study involved 68 children aged 3 to 18 years: 21 in the main group and 47 in the control group. Inclusion criteria for the main group were ADis in combinations of atopic dermatitis (AD), allergic rhinitis or rhinoconjunctivitis (AR/ARC) and/or bronchial asthma (BA): AD+AR/ARC, BA+AR/ARC, AD+AR/ARC+BA. Inclusion criteria for the control group were functional and/or organic pathology of the digestive system, the absence of ADis. All children had been genotyped for single nucleotide variants rs7927894 of the filaggrin gene (FLG) and rs7216389 of the orosomucoid-1-like protein 3 (ORMDL3) gene; also, the serum concentration of biomarkers was determined: the routine total immunoglobulin E (IgE) and the new, candidate one, cutaneous T-cell attracting chemokine (CTACK/CCL27). Results. The following functional values of predictors of the risk of developing OOPh and MOPh of AM in children were obtained: child age ≤ 11 years — odds ratio with 95% confidence interval was 3.74 (1.09–12.8), p = 0.025; heterozygous genotype C/T rs7927894 FLG — 2.88 (0.99–8.38), p = 0.051; homozygous genotype T/T rs7216389 ORMDL3 — 5.19 (1.61–16.8), p = 0.051; combination of genotypes — C/T rs_7927894 FLG + T/T rs_7216389 ORMDL3 — 5.87 (1.30–26.42), p = 0.017; serum concentration of CTACK/CCL27 ≥ 4308.8 pg/ml — 7.4 (2.35–23.26), p < 0.001; serum level of total IgE ≥ 213 IU/ml — 136.7 (15.4–1213.2), p < 0.001. Next, diagnostic coefficients (DC) were obtained for the model of PPPGAD of the risk of developing OOPh and MOPh of AM in children (by rank): 1) total IgE ≥ 213 IU/ml — DC = +8.7; 2) CTACK/CCL27 ≥ 4308.8 pg/ml — DC = +5.0; 3) T/T rs_7216389 ORMDL3 — DC = +5.0; 4) C/T rs_7927894 FLG + T/T rs_7216389 ORMDL3 — DC= +6.5; 5) C/T rs7927894 FLG — DC = +2.8; 6) age ≤ 11 years — DC = +1.8. The cut-off value of the DC sum was detected as > 11.8 points: with 0–6.8 points, the risk of developing OOPh and MOPh of AM in children was very low, with 7.8–9.6 — low, with 10–11.8 — increased, with 12.8–14.6 — high and with ≥ 15.5 points — very high. Conclusions. For personalized precision predictive diagnosis of the risk of developing OOPh and MOPh of AM in children, the use of the genotype-associated integral model is proposed, which includes the wide range of predictor factors: overall biologic — age of children up to 11 years, genetic — genotypes C/T rs7927894 FLG, T/T rs7216389 ORMDL3, biochemical — serum concentrations of the total IgE ≥ 213 IU/ml and CTACK/CCL27 ≥ 4308.8 pg/ml. The cut-off value for the increased risk of developing these phenotypes in children is the DC sum > 11.8 points.
атопічний марш; діти; персоналізована предикативна генотип-асоційована діагностика; інтегральна модель; генотип; біомаркери
atopic march; children; personalized precision predictive genotype-associated diagnosis; integral model; genotype; biomarkers
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Mastraftsi S, Vrioni G, Bakakis M, Nicolaidou E, Rigopoulos D, Stratigos AJ, Gregoriou S. Atopic Dermatitis: Striving for Reliable Biomarkers. J Clin Med. 2022 Aug 9;11(16):4639. doi: 10.3390/jcm11164639. PMID: 36012878; PMCID: PMC9410433.
- Bakker DS, Nierkens S, Knol EF, Giovannone B, Delemarre EM, van der Schaft J et al. Confirmation of multiple endotypes in atopic dermatitis based on serum biomarkers. J Allergy Clin Immunol. 2021 Jan;147(1):189-198. doi: 10.1016/j.jaci.2020.04.062. Epub 2020 Jun 8. PMID: 32526312.
- WHO International Programme on Chemical Safety Biomarkers in Risk Assessment: Validity and Validation. 2001. [(accessed on 20 June 2022)]. http://www.inchem.org/documents/ehc/ehc/ehc222.htm.
- Dytiatkovskyi V, Abaturov O, Dosenko V, Drevytska T, Lapikova-Bryhinska T, Naumenko N, Alifirenko O. Personalized multi-marker panel in the risk assessment of atopic dermatitis phenotypes in children. Pediatria Polska. 2023;98(2):116-122. http://doi.org/10.5114/polp.2023.128063.
- Дитятковський В.О. Асоціація однонуклеотидних варіантів гена орсомукоїд-1-подібного білка 3 з фенотипами атопічного маршу в дітей. Здоров’я дитини. 2023. Т. 18. № 3. С. 52-58. DOI: https://doi.org/10.22141/2224-0551.18.3.2023.1586.
- Дитятковський В.О., Абатуров О.Є., Науменко Н.В., Аліфіренко О.О., Таран С.М., Філатова І.А. Роль кутанного Т-клітинного атрактивного хемокіну у розвитку різних фенотипів атопічного дерматиту у дітей. Медичні перспективи. 2021. Т. 26. № 3. С. 39-46. https://doi.org/10.22141/2224-0551.16.2.2021.229876.
- Дитятковський В.О., Абатуров О.Є., Аліфіренко О.О., Філатова І.А., Таран С.М. Роль поліморфізму rs_7927894 гену FLG та загального IgЕ у прогнозуванні клінічних фенотипів атопічного дерматиту у дітей. Сучасна педіатрія. Україна. 2021. № 3(115). С. 31-39. doi: 10.15574/SP.2021.115.31.
- Dêbiñska A, Danielewicz H, Drabik-Chamerska A, Kalita D, Boznañski A. Chromosome 11q13.5 variant as a risk factor for atopic dermatitis in children. Postepy Dermatol Alergol. 2020 Feb;37(1):103-110. doi: 10.5114/ada.2020.93388. Epub 2020 Mar 9. PMID: 32467693; –PMCID: PMC7247065.
- Kitazawa H, Masuko H, Kanazawa J, Shigemasa R, Hyodo K, Yamada H et al. ORMDL3/GSDMB genotype as a risk factor for early-onset adult asthma is linked to total serum IgE levels but not to allergic sensitization. Allergol Int. 2021 Jan;70(1):55-60. doi: 10.1016/j.alit.2020.04.009. Epub 2020 May 20. PMID: 32444308.
- Khan QU, Banu A, Mazhar I, Asif AB, Waseem A. Genetic and Pathological Insights into the rs7216389 Polymorphism in Gasdermin B and Its Association with Childhood Asthma. Discoveries (Craiova). 2024 Dec 31;12(4):e196. doi: 10.15190/d.2024.15. PMID: 40104184; –PMCID: PMC11913562.
- Johansson SGO. The discovery of IgE. J Allergy Clin Immunol. 2016 Jun;137(6):1671-1673. doi: 10.1016/j.jaci.2016.04.004. Epub 2016 Apr 23. PMID: 27264002.
- Vaneckova J, Bukač J. The severity of atopic dermatitis and the relation to the level of total IgE, onset of atopic dermatitis and family history about atopy. Food and Agricultural Immunology. 2016;27:734-741. doi: 10.1080/09540105.2016.1183598.
- Rosińska-Więckowicz A, Czarnecka-Operacz M, Adamski Z. Selected immunological parameters in clinical evaluation of patients with atopic dermatitis. Postepy Dermatol Alergol. 2016 Jun;33(3):211-8. doi: 10.5114/ada.2016.60614. Epub 2016 Jun 17. PMID: 27512357; –PMCID: PMC4969417.
- Ungar B, Garcet S, Gonzalez J, Dhingra N, Correa da Rosa J, Shemer A et al. An Integrated Model of Atopic Dermatitis Biomarkers Highlights the Systemic Nature of the Disease. J Invest Dermatol. 2017 Mar;137(3):603-613. doi: 10.1016/j.jid.2016.09.037. Epub 2016 Nov 4. PMID: 27825969.
- Renert-Yuval Y, Thyssen JP, Bissonnette R, Bieber T, Kabashima K, Hijnen D, Guttman-Yassky E. Biomarkers in atopic dermatitis — a review on behalf of the International Eczema Council. J Allergy Clin Immunol. 2021 Apr;147(4):1174-1190.e1. doi: 10.1016/j.jaci.2021.01.013. Epub 2021 Jan 28. PMID: 33516871; PMCID: PMC11304440.
- Machura E, Rusek-Zychma M, Jachimowicz M, Wrzask M, Mazur B, Kasperska-Zajac A. Serum TARC and CTACK concentrations in children with atopic dermatitis, allergic asthma, and urticaria. Pediatr Allergy Immunol. 2012 May;23(3):278-84. doi: 10.1111/j.1399-3038.2011.01225.x. Epub 2011 Oct 21. PMID: 22017510.
- Фаюра О.П., Максимук А.О., Абрагамович О.О. та ін. Чинники ризику: методика визначення й оцінювання, прогнозування в медицині (огляд літератури; приклади використання у власній клінічній практиці) — повідомлення перше. Львівський клінічний вісник. 2021;1–2(33–34):51-64.
- Кашуба М.О., Корда М.М. Основи медичної статистики та проведення комп’ютерного статистичного аналізу даних статистичними програмами: навч.-метод. посіб.: [у 4 ч.]. Тернопіль: ТНМУ, Укрмедкнига, 2021–2022.
- Thijs JL, de Bruin-Weller MS, Hijnen D. Current and Future Biomar–kers in Atopic Dermatitis. Immunol Allergy Clin North Am. 2017 Feb;37(1):51-61. doi: 10.1016/j.iac.2016.08.008. Epub 2016 Oct 28. PMID: 27886910.
- Choi UE, Deng J, Parthasarathy V, Liao V, D’Amiano A, Taylor M et al. Risk factors and temporal associations of progression of the atopic march in children with early-onset atopic dermatitis. J Am Acad Dermatol. 2025 Apr;92(4):732-740. doi: 10.1016/j.jaad.2024.10.107. Epub 2024 Nov 28. PMID: 39615548.
- Paller AS, Spergel JM, Mina-Osorio P, Irvine AD. The ato–pic march and atopic multimorbidity: Many trajectories, many pathways. J Allergy Clin Immunol. 2019;143(1):46-55. doi:10.1016/j.jaci.2018.11.006.
- Paternoster L, Savenije OEM, Heron J, et al. Identification of atopic dermatitis subgroups in children from 2 longitudinal birth cohorts. J Allergy Clin Immunol. 2018;141(3):964-971. doi: 10.1016/j.jaci.2017.09.044.