Журнал «Здоровье ребенка» Том 20, №6, 2025
Вернуться к номеру
Характер зв’язків між наднирковими і статевими гормонами при порушеннях менструального циклу в дівчат із прифронтового міста залежно від психопатології
Авторы: V.O. Dynnik (1), O.O. Dynnik (2), O.G. Verhoshanova (1), H.O. Havenko (1)
(1) - State Institution “Institute for Children and Adolescents Health Care of the National Academy of Medical Sciences of Ukraine”, Kharkiv, Ukraine
(2) - National Technical University “Kharkiv Polytechnic Institute”, Kharkiv, Ukraine
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
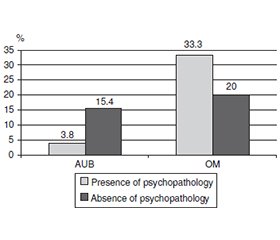
Актуальність. З огляду на зростання поширеності психічних проблем в українських дівчат під впливом війни існує значний інтерес до розуміння потенційних біологічних механізмів, зокрема ролі статевих гормонів. Мета дослідження: вивчити патерни зв’язків між наднирковими й статевими гормонами в дівчат-підлітків із розладами менструального циклу у прифронтовому місті з урахуванням психічного статусу. Матеріали та методи. У період 2022–2024 років обстежено 179 дівчат-підлітків віком 11–17 років із порушеннями менструального циклу: 85 — з аномальними матковими кровотечами (АМК) та 94 — з олігоменореєю (ОМ). До алгоритму обстеження входило визначення рівнів в крові тестостерону (Т), естрадіолу (Е2), кортизолу (К), дегідроепіандростерону сульфату (ДГЕА-С). Обчислювали коефіцієнти Т/Е2, Т/К, К/ДГЕА-С, використовуючи неперетворені, необроблені значення базального рівня гормонів. Психопатологію діагностували на основі відповідності клінічної картини на момент обстеження критеріям МКХ-10. Результати. При порівнянні середніх рівнів стероїдних гормонів у хворих з АМК і ОМ з’ясувалося, що вміст статевих гормонів (тестостерон, Е2, Т/Е2) у дівчат з ОМ без проявів психопатології був значно вищим, ніж при АМК (Р < 0,04–0,002). За наявності психічних проблем вірогідність зберігалася тільки щодо Е2 (Р < 0,04). Уміст надниркових гормонів (кортизол, ДГЕА-С, К/ДГЕА-С) не мав суттєвої різниці в пацієнток з АМК і ОМ без проявів психопатології. При розладах психічної сфери рівень ДГЕА-С був значно вищим у підлітків з ОМ (Р < 0,02), а співвідношення К/ДГЕА-С — нижчим (Р < 0,03), ніж у дівчат з АМК. Формування психопатології на тлі війни в дівчат-підлітків із різними за типом порушеннями менструальної функції відбувається під впливом специфічних змін стероїдних гормонів. Для АМК характерно підвищення статевих гормонів (тестостерон, Е2), зниження кортизолу і збільшення співвідношення К/ДГЕА-С. Психопатологія при ОМ, навпаки, формується на тлі зниження рівнів статевих гормонів, збільшення захисного надниркового гормону ДГЕА-С і зменшення коефіцієнта К/ДГЕА-С. Усе це може свідчити, що в дівчат з ОМ і психопатологією показники надниркової системи демонструють більш адекватну реакцію організму на стрес. Підлітки з АМК більш дезадаптовані, що може призводити до переходу АМК в рецидивуючу форму. Висновки. Реалізація відповіді стероїдних гормонів на стрес війни в дівчат із протилежними розладами менструальної функції (АМК і ОМ) відбувається по-різному залежно від типу порушення. При АМК і ОМ відмічаються протилежні зміни статевих гормонів, особливо на тлі психопатологічних станів. Концентрації надниркових гормонів також суттєво відрізняються в підлітків з АМК і ОМ. Загальний патерн стероїдних гормонів свідчить про більш адекватну реакцію на стрес у дівчат з ОМ.
Background. Given the increasing prevalence of mental health problems in the Ukrainian population of girls affected by war, there is significant interest in understanding potential biological mechanisms, including the contribution of sex hormones. The purpose was to clarify the patterns of relationships of adrenal and sex hormones in adolescent girls with menstrual disorders in a front-line city, taking into account mental status. Materials and methods. In 2022–2024, 179 adolescent girls aged 11–17 years with menstrual disorders were examined: 85 with abnormal uterine bleeding (AUB) and 94 with oligomenorrhea (OM). The examination algorithm included determination of blood levels of testosterone (T), estradiol (E2), cortisol (C), dehydroepiandrosterone sulfate (DHEA-S). The coefficients T/E2, T/C, C/DHEA-S were calculated using untransformed, raw values of basal hormone levels. The diagnosis of psychopathology was made based on the clinical picture at the time of examination meeting the ICD-10 criteria. Results. When comparing the average levels of steroid hormones between patients with AUB and OM, it was found that the content of sex hormones (testosterone, E2, T/E2) in girls with OM without manifestations of psychopathology was significantly higher than in AUB (P < 0.04–0.002). In the presence of psychopathology, the reliability was maintained only in relation to E2 (P < 0.04). Adrenal hormones (cortisol, DHEA-S, C/DHEA-S) did not have a significant difference between patients with AUB and OM without manifestations of psychopathology. In mental disorders, the level of DHEA-S was significantly higher in adolescents with OM (P < 0.02), and the ratio of C/DHEA-S was lower (P < 0.03) than in girls with AUB. The formation of psychopathology against the background of war in adolescent girls with different types of menstrual disorders occurs under the influence of specific changes in steroid hormones. AUB is characterized by an increase in sex hormones (testosterone, E2), a decrease in cortisol and an increase in the ratio of C/DHEA-S. Psychopathology in OM, on the contrary, is formed against the background of reduced levels of sex hormones, an increase in the protective adrenal hormone DHEA-S and a decrease in the ratio of C/DHEA-S. All this may indicate that in girls with OM and psychopathology, the adrenal system parameters demonstrate a more adequate response of the body to stress. Adolescents with AUB are more maladapted, which may contribute to the transition of AUB to a recurrent form. Conclusions. The implementation of the steroid hormone response to war stress in girls with opposite conditions (AUB and OM) occurs differently depending on the type of disorder. In AUB and OM, opposite changes in sex hormones are noted, especially against the background of psychopathological states. The concentration of adrenal hormones also differs significantly in adolescents with AUB and OM. The general pattern of steroid hormones indicates a more adequate response to stress in girls with OM.
дівчата-підлітки; порушення менструальної функції; аномальні маткові кровотечі; олігоменорея; статеві й надниркові гормони; стрес; війна
adolescent girls; menstrual disorders; abnormal uterine bleeding; oligomenorrhea; sex and adrenal hormones; stress; war
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Breehl L, Caban O. Physiology, Puberty. In: StatPearls. Treasure Island (FL): StatPearls Publishing; 2025 Jan. Available from: https://www.ncbi.nlm.nih.gov/books/NBK534827/.
- Smith CE, Biro FM. Pubertal Development: What’s Normal/What’s Not. Clin Obstet Gynecol. 2020 Sep;63(3):491-503. doi: 10.1097/GRF.0000000000000537.
- Jayuphan J, Sangthong R, Hayeevani N, Assanangkornchai S, McNeil E. Mental health problems from direct vs indirect exposure to violent events among children born and growing up in a conflict zone of southern Thailand. Soc Psychiatry Psychiatr Epidemiol. 2020 Jan;55(1):57-62. doi: 10.1007/s00127-019-01732-8.
- Avendaño-Vásquez CJ, Reina-Gamba NC, Daza-Castillo LA, Quarantini L. Nursing Interventions in Children Living Under Armed Conflict Situations and Quality of Life: A Scoping Review. J Pediatr Nurs. 2021 May-Jun;58:44-52. doi: 10.1016/j.pedn.2020.11.012.
- Bendavid E, Boerma T, Akseer N, Langer A, Malembaka EB, Okiro EA, et al. The effects of armed conflict on the health of women and children. Lancet. 2021 Feb 6;397(10273):522-532. doi: 10.1016/S0140-6736(21)00131-8.
- Slone M, Peer A. Children’s Reactions to War, Armed Conflict and Displacement: Resilience in a Social Climate of Support. Curr Psychiatry Rep. 2021 Oct 6;23(11):76. doi: 10.1007/s11920-021-01283-3.
- Kadir A, Shenoda S, Goldhagen J. Effects of armed conflict on child health and development: A systematic review. PLoS One. 2019 Jan 16;14(1):e0210071. doi: 10.1371/journal.pone.0210071.
- Sundari T, George AJ, Sinu E. Psychosocial Problems of Adolescent Girls during Menstruation. J Mental Health Educ. 2022 Apr;3(2):47-63.
- Rafique N, Al-Sheikh MH. Prevalence of menstrual problems and their association with psychological stress in young female students studying health sciences. Saudi Med J. 2018 Jan;39(1):67-73. doi: 10.15537/smj.2018.1.21438.
- Keenan K, Hipwell AE, Polonsky TS. Menstrual Cycle Irregularity in Adolescence Is Associated With Cardiometabolic Health in Early Adulthood. J Am Heart Assoc. 2023 Sep 19;12(18):e029372. doi: 10.1161/JAHA.123.029372.
- Vurgun E, Memet B, Kocaturk E, Guntas G. Evaluation of serum 25-hydroxyvitamin D levels and cortisol/dehydroepiandrosterone sulfate ratio in chronic spontaneous urticaria. Turkish Journal of Biochemistry. 2021;46(2):191-196. doi: 10.1515/tjb-2020-0304.
- De Sanctis V, Soliman AT, Tzoulis P, et al. Hypomenorrhea in Adolescents and Youths: Normal Variant or Menstrual Disorder? Revision of Literature and Personal Experience. Acta Biomed. 2022 Mar 14;93(1):e2022157. doi: 10.23750/abm.v93i1.12804.
- Itriyeva K. The normal menstrual cycle. Curr Probl Pediatr Adolesc Health Care. 2022 May;52(5):101183. doi: 10.1016/j.cppeds.2022.101183.
- Abbasi S, Naz S, Khalid S, Bukhari A. Menstrual Pattern and Common Menstrual Disorders among Adolescent Girls. Pakistan Journal of Medical and Health Sciences. 2022;16(6):1031-1033. doi: 10.53350/pjmhs221661031.
- Koysombat K, Dhillo WS, Abbara A. Assessing hypothalamic pituitary gonadal function in reproductive disorders. Clin Sci (Lond). 2023 Jun 14;137(11):863-879. doi: 10.1042/CS20220146.
- Krinke E, Held U, Steigmiller K, Felmingham K, Kleim B. Sex hormones and cortisol during experimental trauma memory consolidation: Prospective association with intrusive memories. Eur J Psychotraumatol. 2022 Mar 31;13(1):2040818. doi: 10.1080/20008198.2022.2040818.
- Chafkin JE, O’Brien JM, Medrano FN, et al. A dual-system, machine-learning approach reveals how daily pubertal hormones relate to psychological well-being in everyday life. Dev Cogn Neurosci. 2022 Dec;58:101158. doi: 10.1016/j.dcn.2022.101158.
- Rosen Vollmar AK, Mahalingaiah S, Jukic AM. The Menstrual Cycle as a Vital Sign: A Comprehensive Review. F&S Reviews. 2024:100081. doi: 10.1016/j.xfnr.2024.100081.
- Wang YX, Stuart JJ, Rich-Edwards JW, et al. Menstrual Cycle Regularity and Length Across the Reproductive Lifespan and Risk of Cardiovascular Disease. JAMA Netw Open. 2022 Oct 3;5(10):e2238513. doi: 10.1001/jamanetworkopen.2022.38513.
- Shea AA, Vitzthum VJ. The extent and causes of natural variation in menstrual cycles: Integrating empirically-based models of ovarian cycling into research on women’s health. Drug Discovery Today: Disease Models. 2020;32:41-49. doi: 10.1016/j.ddmod.2020.11.002.
- Chronister BN, Gonzalez E, Lopez-Paredes D, et al. Testoste–rone, estradiol, DHEA and cortisol in relation to anxiety and depression scores in adolescents. J Affect Disord. 2021 Nov 1;294:838-846. doi: 10.1016/j.jad.2021.07.026.
- Luo D, Dashti SG, Sawyer SM, Vijayakumar N. Pubertal hormones and mental health problems in children and adolescents: a systematic review of population-based studies. EClinicalMedicine. 2024 Oct 1;76:102828. doi: 10.1016/j.eclinm.2024.102828.
- Bashkatov SA, Garipova MI. On the age-specific neurochemical and endocrine biomarkers of temperament traits in adolescents. Current Opinion in Behavioral Sciences. 2022;43:118-124. doi: 10.1016/j.cobeha.2021.09.002.
- Young AH, Gallagher P, Porter RJ. Elevation of the cortisol-dehydroepiandrosterone ratio in drug-free depressed patients. Am J Psychiatry. 2002 Jul;159(7):1237-1239. doi: 10.1176/appi.ajp.159.7.1237.
- Hamidovic A, Soumare F, Naveed A, et al. Reduced Dehydroepiandrosterone-Sulfate Levels in the Mid-Luteal Subphase of the Menstrual Cycle: Implications to Women’s Health Research. Metabolites. 2022 Oct 4;12(10):941. doi: 10.3390/metabo12100941.
- Pletzer B, Poppelaars ES, Klackl J, Jonas E. The gonadal response to social stress and its relationship to cortisol. Stress. 2021;24(6):866-875. doi: 10.1080/10253890.2021.1891220.
- Koskinen MK, Aatsinki A, Kortesluoma S, et al. Hair cortisol, cortisone and DHEA concentrations and the composition of microbiota in toddlers. Psychoneuroendocrinology. 2023 Aug;154:106309. doi: 10.1016/j.psyneuen.2023.106309.
- Marceau K, Shirtcliff EA, Hastings PD, et al. Within-adolescent coupled changes in cortisol with DHEA and testosterone in response to three stressors during adolescence. Psychoneuroendocrinology. 2014 Mar;41:33-45. doi: 10.1016/j.psyneuen.2013.12.002.
- Mouthaan J, Sijbrandij M, Luitse JS, et al. The role of acute cortisol and DHEAS in predicting acute and chronic PTSD symptoms. Psychoneuroendocrinology. 2014 Jul;45:179-186. doi: 10.1016/j.psyneuen.2014.04.001.
- Wieczorek K, Targonskaya A, Maslowski K. Reproductive hormones and female mental wellbeing. Women. 2023; 3(3):432-444. doi: 10.3390/women3030033.
- Andersen E, Klusmann H, Eisenlohr-Moul T, Baresich K, Girdler S. Life stress influences the relationship between sex hormone fluctuation and affective symptoms in peripubertal female adolescents. Dev Psychopathol. 2024 May;36(2):821-833. doi: 10.1017/S095457942300010X.