Журнал «Здоровье ребенка» Том 20, №2, 2025
Вернуться к номеру
Вплив воєнних дій на території України на стан психічного здоров’я та тиреоїдної системи в підлітків із цукровим діабетом 1-го типу
Авторы: Турчина С.І., Матковська Т.М., Мітельов Д.А., Нікітіна Л.Д., Волкова Ю.В.
Державна установа «Інститут охорони здоров’я дітей та підлітків НАМН України», м. Харків, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
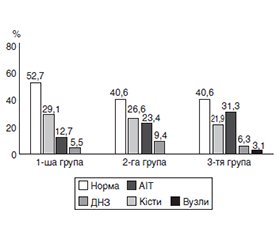
Актуальність. Особливу увагу лікарів і науковців привертають порушення функції ендокринної системи в дітей і підлітків, які потерпають від воєнних дій на території України. Встановлено, що впродовж воєнного періоду серед дітей і підлітків, хворих на цукровий діабет 1-го типу (ЦД1), вірогідно зросла кількість випадків тиреоїдної патології та спостерігається погіршення психічного здоров’я. Актуальним залишається питання про взаємозв’язок між порушенням психічного здоров’я та станом тиреоїдної системи у хворих на ЦД1, які проживають в несприятливих умовах сьогодення. Мета дослідження: оцінити стан гіпофізарно-тиреоїдної системи в підлітків із ЦД1 з урахуванням наявності ознак порушень психічного здоров’я в умовах сучасної воєнної ситуації. Матеріали та методи. Обстежено пацієнтів віком 10–18 років із ЦД1, які перебували на обстеженні й лікуванні в клініці ДУ «ІОЗДП НАМН» у період після початку повномасштабної війни в Україні (із жовтня 2022 року і до цього часу). Клініко-анамнестичне й лабораторно-інструментальне обстеження проводили відповідно до стандарту медичної допомоги «Цукровий діабет у дітей» і протоколів надання медичної допомоги за спеціальністю «дитяча ендокринологія». У сироватці крові імуноферментним методом визначали рівні тиреотропного гормону (ТТГ), вільних фракцій тироксину (fT4) і трийодтироніну (fT3), обчислювали співвідношення ТТГ/fТ4. Визначали рівень антитіл до тиреопероксидази. Усім пацієнтам проводили ультразвукове дослідження щитоподібної залози. Результати обстежень внесено до електронного банку даних, їх статистичну обробку проведено з використанням програм SPSS Statistics 17.0 і Microsoft Excel 2007. Критичний рівень значущості для перевірки статистичних гіпотез становив 0,05. Результати. На підставі оцінки психічного стану підлітків із ЦД1 сформовано три групи: 1-ша група — пацієнти з нормальним психічним станом (22,2 %); 2-га група — пацієнти з непатологічними реакціями на стрес (48,6 %); 3-тя група — пацієнти з різними психічними розладами (29,2 %). Тиреоїдна патологія виявлена в 49,9 % обстежених. Зокрема, автоімунний тиреоїдит (АІТ) — у 21,4 %, дифузний нетоксичний зоб (ДНЗ) — у 16,1 %, кісти — у 8,9 %, вузли щитоподібної залози — в 1,8%. У підлітків 1-ї групи переважав ДНЗ (29,1 %), тоді як АІТ траплявся вірогідно рідше (12,7 %, p < 0,05). У 2-й групі ДНЗ (26,6 %) і АІТ (23,4 %, p > 0,05) мали подібну частоту. У 3-й групі частота АІТ (31,3 %) була вірогідно вищою, ніж у 1-й (12,7 %, p1 < 0,05) і 2-й (23,4 %, p2 < 0,05) групах. Серед підлітків 3-ї групи тиреоїдну недостатність різного ступеня тяжкості діагностовано вірогідно частіше (52,4 %) порівняно з 1-ю (24,1 %, p1 < 0,05) і 2-ю (31,3 %, p2 < 0,05) групами. Висновки. Встановлено вірогідний зв’язок між станом тиреоїдної системи і психічним здоров’ям у підлітків із ЦД1, які мешкають в умовах війни. Комплексна реабілітація таких пацієнтів має включати лікування і профілактику тиреопатій з використанням препаратів калію йодиду і L-тироксину (Йодомарин® 100/200, L-тироксин Берлін Хемі®), а також нейрореабілітаційні заходи.
Background. Particular attention of physicians and researchers is drawn to endocrine system dysfunctions in children and adolescents affected by the ongoing war in Ukraine. It has been found that during the war period, the number of thyroid disorders among children and adolescents with type 1 diabetes (DM1) has significantly increased, accompanied by a deterioration in their mental health. The issue of the relationship between mental health disorders and the state of the thyroid system in DM1 patients living under today’s adverse conditions remains highly relevant. Objective: to assess the status of the hypothalamic-pituitary-thyroid axis in adolescents with DM1 considering the presence of mental health disorders in the context of ongoing warfare in Ukraine. Materials and methods. The study included patients aged 10–18 years with DM1 who underwent clinical evaluation and treatment at the clinic of the State Institution “Institute for Children and Adolescents Health Care of the National Academy of Medical Sciences of Ukraine” between October 2022 and the present time. Clinical-anamnestic, and laboratory-instrumental examinations were conducted in accordance with the national standard of care for children with diabetes and the pediatric endocrinology guidelines. Serum levels of thyroid-stimulating hormone (TSH), free thyroxine (fT4), and free triiodothyronine were measured using enzyme-linked immunosorbent assay, and the TSH/fT4 ratio was calculated. Anti-thyroid peroxidase antibodies were assessed. All participants underwent thyroid ultrasound. Data were compiled into an electronic database and analyzed statistically using SPSS Statistics 17.0 and Microsoft Excel 2007. The critical significance level was set at 0.05. Results. Based on the evaluation of mental health status of adolescents with DM1, they were divided into three groups: group 1 — normal mental health (22.2 %); group 2 — non-pathological stress reactions (48.6 %); group 3 — various mental disorders (29.2 %). Thyroid disorders were diagnosed in 49.9 % of patients: autoimmune thyroiditis (AIT) in 21.4 %, diffuse non-toxic goiter (DNG) in 16.1 %, thyroid cysts in 8.9 %, and thyroid nodules in 1.8 %. In group 1, DNG prevailed (29.1 %), while the AIT incidence was significantly lower (12.7 %, p < 0.05). In group 2, the frequency of DNG (26.6 %) and AIT (23.4 %, p > 0.05) was comparable. In group 3, AIT was significantly more prevalent (31.3 %) than in groups 1 (12.7 %, p1 < 0.05) and 2 (23.4 %, p2 < 0.05). Thyroid insufficiency of varying degrees was more frequently diagnosed in group 3 (52.4 %) compared to groups 1 (24.1 %, p1 < 0.05) and 2 (31.3 %, p2 < 0.05). Conclusions. A significant correlation was found between thyroid dysfunction and mental health disturbances in adolescents with DM1 living under wartime stress. Comprehensive rehabilitation for such patients should include both treatment and prevention of thyroid disorders using potassium iodide and levothyroxine preparations (Jodomarin® 100/200, L-thyroxin Berlin-Chemie®), along with neurorehabilitation interventions.
цукровий діабет 1-го типу; психічне здоров’я; тиреоїдна патологія; підлітки; війна в Україні
type 1 diabetes; mental health; thyroid pathology; adolescents; war in Ukraine
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- Wichers M, et al. Psychosocial stress and thyroid function in humans. Psychoneuroendocrinology. 2002;27(2):131-141. doi: 10.1016/S0306-4530(01)00042-1.
- Charmandari E, Tsigos C, Chrousos G. Endocrinology of the stress response. Annu Rev Physiol. 2005;67:259-284. doi: 10.1146/annurev.physiol.67.040403.120816.
- Boelen A, Kwakkel J, Fliers E. Beyond low plasma T3: local thyroid hormone metabolism during inflammation and infection. Endocr Rev. 2011;32(5):670-693. doi: 10.1210/er.2011-0007.
- Fliers E, Boelen A. An update on non-thyroidal illness syndrome. J Endocrinol Invest. 2021;44(8):1597-1607. doi: 10.1007/s40618-021-01501-4.
- Boelen A, et al. Role of type 1 and 2 deiodinases in the non-thyroidal illness syndrome. Endocrinology. 2015;156(6):2315-2325. doi: 10.1210/en.2014-1856.
- Panicker V, et al. Common variation in the DIO2 gene predicts baseline psychological well-being. J Clin Endocrinol Metab. 2009;94(5):1623-1629. doi: 10.1210/jc.2008-1301.
- Jung SJ, et al. PTSD and thyroid dysfunction: a meta-analysis. Endocr Pract. 2021;27(2):145-153. doi: 10.1016/j.eprac.2020.09.002.
- Mason JW, et al. Thyroid function in posttraumatic stress disorder. Psychoneuroendocrinology. 1996;21(2):115-130. doi: 10.1016/0306-4530(95)00042-9.
- Li H, et al. PTSD and Autoimmune Thyroid Disease: A Mendelian Randomization Study. Front Psychiatry. 2024;15:1417302. doi: 10.3389/fpsyt.2024.1417302.
- Kochmanski N, et al. HPT axis dysfunction in adolescents with non-suicidal self-injury. Psychoneuroendocrinology. 2021;131:105315. doi: 10.1016/j.psyneuen.2021.105315.
- Amaral FG, et al. Adolescent stress alters thyroid hormone-related gene expression. Front Endocrinol. 2021;12:668252. doi: 10.3389/fendo.2021.668252.
- Focus.ua. Здоров’я населення України після війни. 2024. https://focus.ua/eksklyuzivy/677587-zdorove-naseleniya-padaet-kakie-bolezni-pridut-v-ukrainu-posle-voyny.
- Мітельов Д.А., Михайлова Е.А. Порушення сну у дітей та підлітків, хворих на цукровий діабет 1 типу, під час війни. Український журнал дитячої ендокринології. 2024. № 2–3. C. 19-24. https://doi.org/10.30978/UJPE2024-2-3-19.
- Turchyna SI, et al. Incidence of comorbid thyroid pathology in adolescents with type 1 diabetes mellitus under adverse conditions of war in Ukraine. Здоров’я дитини. 2024. Т. 19. № 4. С. 88-92. URL: http://www.mif-ua.com/archive/issue-35159.
- Ministry of Health of Ukraine. Standard of medical care “Diabetes Mellitus in Children”. Order of the Ministry of Health of Ukraine No. 413 dated 28.02.2023.
- Child Endocrinology: Protocols on medical assistance to children for the specialty. Kyiv, 2006: 94 p.
- di Munno C, Busiello RA, Calonne J, Salzano AM, Miles-Chan J, Scaloni A, et al. Adaptive Thermogenesis driving catch-up fat is associated with increased muscle type 3 and decreased hepatic type 1 iodothyronine deiodinase activities: a functional and proteomic study. Front Endocrinol (Lausanne). 2021;12:31176. doi: 10.3389/fendo.2021.631176.
- Hong H, Lee J. Thyroid-stimulating hormone as a biomarker for stress after thyroid surgery: a prospective cohort study. Med Sci Monit. 2022;28:E937957. doi: 10.12659/MSM.93795.
- Cheung YM, Wang W, McGregor B, Hamnvik OR. Associations between immune-related thyroid dysfunction and efficacy of immune checkpoint inhibitors: a systematic review and meta-analysis. Cancer Immunol Immunother. 2022;71(8):1795-1812. doi: 10.1007/s00262-021-03128-7.
- Турчина С.І., Нікітіна Л.Д., Чумак С.А., Шушляпіна О.В., Цирюлік С.М. Вплив комплексної етапної реабілітації на компенсацію цукрового діабету І типу у дітей та підлітків. Український журнал дитячої ендокринології. 2020. № 3(35). С. 12-19. DOI: https://doi.org/10.30978/UJPE2020-3-12.
- ATA Guidelines Taskforce. 2014 American Thyroid Association Guidelines for Diagnosis and Management of Hyperthyroidism and Other Causes of Thyrotoxicosis. Thyroid. 2016;26(10):1343-1421. doi: 10.1089/thy.2016.0229.
- WHO. Technical guidance on medical response in humanitarian settings. Geneva: WHO; 2022. https://www.who.int/publications/i/item/WHO-HEP-EHC-2022.1.
- European Thyroid Association (ETA). Best Practice Recommendations in Endocrinology for Crisis Situations. Eur Thyroid J. 2022;11(3):e210113. doi: 10.1159/000521655.
- Інструкція для медичного застосування лікарського засобу ЙОДОМАРИН® 100 від 30.11.2018 № 2237, РП № UA/0156/01/01.
- Інструкція для медичного застосування лікарського засобу ЙОДОМАРИН® 200 від 06.03.2018 № 450, РП № UA/0156/01/02.
- Milczarek M, Stępniak J, Lewiński A. et al. Potassium iodide, but not potassium iodate, as a potential protective agent against oxidative damage to membrane lipids in porcine thyroid. Thyroid Res. 2013;6(10).
- Sorrenti S, Baldini E, Pironi D, Lauro A, D’Orazi V, Tartaglia F, et al. Iodine: Its Role in Thyroid Hormone Biosynthesis and Beyond. Nutrients. 2021 Dec 14;13(12):4469.
- Annex 9 Guidelines on packaging for pharmaceutical Products. WHO Technical Report Series, No. 902, 2002. https://cdn.who.int/media/docs/default-source/medicines/norms-and-standards/guidelines/regulatory-standards/trs902-annex9.pdf?sfvrsn=82b4c57d_2.
- Iнструкція для медичного застосування лікарських засобів L-ТИРОКСИН 50/100 БЕРЛIН-ХЕМI від 17.06.2024 № 1056, РП № UA/8133/01/02 та № 8133/01/01.
- Iнструкція для медичного застосування лікарського засобу L-ТИРОКСИН 75 БЕРЛIН-ХЕМI від 17.06.2024 № 1056, РП № UA/8133/01/03.
- Iнструкція для медичного застосування лікарського засобу L-ТИРОКСИН 125 БЕРЛIН-ХЕМI від 17.06.2024 № 1056, РП № UA/8133/01/04.
- Iнструкція для медичного застосування лікарського засобу L-ТИРОКСИН 150 БЕРЛIН-ХЕМI від 17.06.2024 № 1056, РП № UA/8133/01/05.

/11.jpg)