Журнал «Боль. Суставы. Позвоночник» Том 15, №1, 2025
Вернуться к номеру
Медикаментозна терапія у хворих з остеоартритом та метаболічними порушеннями: у фокусі діацереїн
Авторы: Курята О.В., Гречаник М.М.
Дніпровський державний медичний університет, м. Дніпро, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Справочник специалиста
Версия для печати
Актуальність. Остеоартрит (ОА) є найпоширенішим віковим дегенеративним захворюванням суглобів і основною причиною болю та інвалідності у старіючій популяції. Мета дослідження: проаналізувати сучасні рекомендації та літературні дані про підходи до лікування ОА у пацієнтів з коморбідністю та метаболічними порушеннями, сконцентрувавши увагу на діацереїні. Матеріали та методи. Аналітичний огляд літературних даних проведено з 2003 до 2024 р. у наукометричних базах даних PubMed, Web of Science, Scopus, Google Scholar. Пошук здійснювали за ключовими словами «остеоартрит», «метаболічні порушення», «коморбідність», «подагра», «гіперурикемія», «SYSADOA», «діацереїн», «ефективність». Результати. ОА часто співіснує з метаболічними захворюваннями та іншими патологіями, які призводять до більш швидкого його прогресування та істотно погіршують фізичні функції та спричиняють вищу смертність у хворих на ОА. На сьогодні розглядається взаємозв’язок ОА з іншими захворюваннями та його залежність від віку, статі, ожиріння, гіперурикемії та подагричного артриту (ПА). Коморбідність ОА з ПА впливає на клінічну картину обох захворювань та погіршує якість життя пацієнтів, а отже, потребує персоніфікованого підходу до вибору медикаментозної терапії. Зараз усе більш значне місце в лікуванні ОА займають симптоматичні засоби сповільненої дії (SYSADOA), але позиції різних лікарських асоціацій з точки зору їх клінічної та економічної обґрунтованості різняться. Можливо, перспективним є проведення диференціації їх використання залежно від локалізації ураження суглобів, що знайшло відображення в рекомендаціях ESCEO, або персоніфікації підходів при певних фенотипах та коморбідності пацієнта (рекомендації OARSI). Висновки. На нашу думку, на сучасному етапі недооціненим у рекомендаціях залишається поєднання ОА з гіперурикемією та подагрою, зокрема й стосовно підходів до лікування, з огляду на особливості даної коморбідності щодо індукції запалення. Однією з можливих перспективних опцій серед препаратів SYSADOA за цих умов може бути діацереїн через особливості його ефектів та профіль безпеки.
Background. Osteoarthritis (OA) is the most common age-related degenerative joint disease and a leading cause of pain and disability in the ageing population. The study aimed to analyze current recommendations and literature data on approaches to OA treatment in patients with comorbidities and metabolic disorders, focusing on diacerein. Materials and methods. An analytical review of literature data from 2003 to 2024 was conducted using scientific databases such as PubMed, Web of Science, Scopus, and Google Scholar. The search was performed using key terms “osteoarthritis”, “metabolic disorders”, “comorbidity, “gout”, “hyperuricemia”, “SYSADOA”, “diacerein” and “effectiveness”. Results. OA frequently coexists with metabolic diseases and other pathologies that accelerate OA progression, significantly worsen physical function impairment, and increase mortality in OA patients. Current research examined the relationship between OA and other diseases, considering age, gender, obesity, hyperuricemia, and gouty arthritis (GA). Comorbidity of OA with GA affects the clinical picture of both diseases, worsens patients’ quality of life, and therefore requires a personalized approach to pharmacotherapy selection. Symptomatic slow-acting drugs for osteoarthritis (SYSADOA) are gaining increasing importance in OA treatment, but various medical associations have differing views on their clinical and economic justification. Future research may focus on differentiating their use based on the affected joint area, as reflected in ESCEO recommendations, or on personalized approaches tailored to specific phenotypes and comorbidities (OARSI recommendations). Conclusions. In our opinion, the combination of OA with hyperuricemia and gout remains underestimated in current recommendations, particularly regarding treatment approaches that consider the inflammatory induction characteristics of this comorbidity. One potentially promising option among SYSADOA drugs in these conditions is diacerein, given its specific effects and safety profile.
остеоартрит; метаболічні порушення; коморбідність; подагра; гіперурикемія; SYSADOA; діацереїн; ефективність
osteoarthritis; metabolic disorders; comorbidity; gout; hyperuricemia; SYSADOA; diacerein; effectiveness
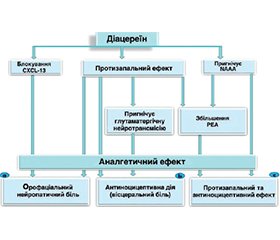
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Neogi T, Krasnokutsky S, Pillinger MH. Urate and osteoarthritis: evidence for a reciprocal relationship. Joint Bone Spine. 2019 Oct 1;86(5):576-82. doi: 10.1016/J.JBSPIN.2018.11.002.
- Steinmetz JD, Culbreth GT, Haile LM, et al. Global, regional, and national burden of osteoarthritis, 1990-2020 and projections to 2050: a syste–matic analysis for the Global Burden of Disease Study 2021. Lancet Rheumatol. 2023 Sep 1;5(9):e508-22. doi: 10.1016/S2665-9913(23)00163-7.
- Giorgino R, Albano D, Fusco S, et al. Knee osteoarthritis: epidemiology, pathogenesis, and mesenchymal stem cells: what else is new? An update. International Journal of Molecular Sciences. Multidisciplinary Digital Publishing Institute (MDPI). 2023 Mar 29;24(7):6405. doi: 10.3390/ijms24076405.
- Li D, Li S, Chen Q, Xie X. The prevalence of symptomatic knee osteoarthritis in relation to age, sex, area, region, and body mass index in China: a systematic review and meta-analysis. Front Med (Lausanne). 2020 Jul 16;7:304. doi: 10.3389/fmed.2020.00304.
- Hong JW, Noh JH, Kim DJ. The prevalence of and demographic factors associated with radiographic knee osteoarthritis in Korean adults aged ≥ 50 years: The 2010-2013 Korea National Health and Nutrition Examination Survey. PLoS One. 2020 Mar 20;15(3):e0230613. doi:10.1371/journal.pone.0230613.
- Mihalko WM, Kerkhof AL, Ford MC, Crocka–rell JR Jr, Harkess JW, Guyton JL. Сryoneurolysis before total knee arthroplasty in patients with severe osteoarthritis for reduction of postoperative pain and opioid use in a single-center randomized controlled trial. J Arthroplasty. 2021 May;36(5):1590-8. doi: 10.1016/j.arth.2020.11.013.
- Dieleman JL, Baral R, Birger M, et al. US spen–ding on personal health care and public health, 1996-2013. JAMA. 2016 Dec 27;316(24):2627-46. doi: 10.1001/jama.2016.16885.
- Mont MA, Lin JH, Spitzer AI, et al. Cryoneurolysis associated with improved pain, function, and sleep in patients following total knee arthroplasty: use of a new real-world registry. J Arthroplasty. 2025;40(1):92-101.e3. doi: 10.1016/j.arth.2024.06.054.
- Etkin CD, Springer BD. The American Joint Replacement Registry — the first 5 years. Arthroplast Today. 2017;3:67-9. https://doi.org/10.1016/j.artd.2017.02.002.
- Loskutov OYe, Oliinyk OYe, Loskutov OO, Sy–niehubov DA. Development of national arthroplasty (results of 30-year research). Transplantation and Artificial Organs. 2021;2(3):37-50. doi: 10.30702/transpaorg/10_21.2710/0437-50/451.30(477).
- Savvari P, Skiadas I, Barmpouni M, et al. Mode–rate to severe osteoarthritis: what is the economic burden for patients and the health care system? Insights from the “PONOS” study. Cartilage. 2024 Sep 1;15(3):268-77. doi: 10.1177/19476035231196524.
- Swain S, Sarmanova A, Coupland C, Doherty M, Zhang W. Comorbidities in osteoarthritis: a systematic review and meta-analysis of observational studies. Arthritis Care Res (Hoboken). 2020 Jul 1;72(7):991-1000. doi: 10.1002/acr.24008.
- Allen KD, Thoma LM, Golightly YM. Epidemiology of osteoarthritis. Osteoarthritis Cartilage. 2022 Feb 1;30(2):184-95. doi: 10.1016/j.joca.2021.04.020.
- Tong L, Yu H, Huang X, et al. Current understan–ding of osteoarthritis pathogenesis and relevant new approaches. Bone Res. 2022 Sep 20;10(1):60. doi: 10.1038/s41413-022-00226-9.
- Zheng L, Zhang Z, Sheng P, Mobasheri A. The role of metabolism in chondrocyte dysfunction and the progression of osteoarthritis. Ageing Res Rev. 2021 Mar;66:101249. doi: 10.1016/j.arr.2020.101249.
- Mobasheri A, Batt M. An update on the pathophysiology of osteoarthritis. Ann Phys Rehabil Med. 2016 Dec;59(5-6):333-339. doi: 10.1016/j.rehab.2016.07.004.
- Mobasheri A, Saarakkala S, Finnilä M, Karsdal MA, Bay-Jensen AC, van Spil WE. Recent advances in understanding the phenotypes of osteoarthritis. F1000Res. 2019 Dec 12;8:F1000 Faculty Rev-2091. doi: 10.12688/f1000research.20575.1.
- Kolasinski SL, Neogi T, Hochberg MC, et al. 2019 American college of rheumatology/arthritis foundation guideline for the management of osteoarthritis of the hand, hip, and knee. Arthritis Rheumatol. 2020 Feb;72(2):220-233. doi: 10.1002/art.41142.
- Kraus VB, Blanco FJ, Englund M, Karsdal MA, Lohmander LS. Call for standardized definitions of osteoarthritis and risk stratification for clinical trials and clinical use. Osteoarthritis Cartilage. 2015;23:1233-41. doi: 10.1016/j.joca.2015.03.036.
- Li B, Yang Z, Li Y, Zhang J, Li C, Lv N. Exploration beyond osteoarthritis: the association and mechanism of its related comorbidities. Front Endocrinol (Lausanne). 2024 Apr 19;15:1352671. doi: 10.3389/fendo.2024.1352671.
- Wei G, Lu K, Umar M, Zhu Z, Lu WW, Speakman JR, Chen Y, Tong L, Chen D. Risk of metabolic abnormalities in osteoarthritis: a new perspective to understand its pathological mechanisms. Bone Res. 2023 Dec 6;11(1):63. doi: 10.1038/s41413-023-00301-9.
- Veronese N, Honvo G, Bruyère O, et al. Knee osteoarthritis and adverse health outcomes: an umbrella review of meta-analyses of observational studies. Aging Clin Exp Res. 2023 Feb;35(2):245-252. doi: 10.1007/s40520-022-02289-4.
- Проценко Г.О. Застосування хондропротекторів у хворих на остеоартрит в поєднанні з подагрою. Український ревматологічний журнал. 2024;96:12-18. doi: 10.32471/rheumatology.2707-6970.96.18848.
- McAlindon TE, Bannuru RR, Sullivan MC, et al. OARSI guidelines for the non-surgical management of knee osteoarthritis. Osteoarthritis Cartilage. 2014 Mar;22(3):363-88. doi: 10.1016/j.joca.2014.01.003.
- Chen D, Xu H, Sun L, Li Y, Wang T. Assessing causality between osteoarthritis with urate levels and gout: a bidirectional Mendelian randomization study. Osteoarthritis Cartilage. 2022 Apr;30(4):551-558. doi: 10.1016/j.joca.2021.12.001.
- Kapoor M, Martel-Pelletier J, Lajeunesse D, Pelletier JP, Fahmi H. Role of proinflammatory cytokines in the pathophysiology of osteoarthritis. Nat Rev Rheumatol. 2011 Jan;7(1):33-42. doi: 10.1038/nrrheum.2010.196.
- Frallonardo P, Ramonda R, Peruzzo L, et al. Basic calcium phosphate and pyrophosphate crystals in early and late osteoarthritis: relationship with clinical indices and inflammation. Clin Rheumatol. 2018 Oct;37(10):2847-2853. doi: 10.1007/s10067-018-4166-3.
- Mai NTT, Hang NT, Hanh DH, et al. Leptin and interleukin-1β levels associated with osteoarthritis in Vietnamese patients: a cross-sectional analysis. Braz J Med Biol Res. 2023 Sep 8;56:e12746. doi: 10.1590/1414-431X2023e12746.
- Шуба Н.М., Воронова Т.Д., Крилова А.С., Пилипенко А.В., Хамбір Т.С. Клінічні особливості остеоартрозу в поєднанні з гіперурикемією. Український ревматологічний журнал. 2015;2(60):24-27. Режим доступу: https://www.rheumatology.kiev.ua/article/7846/klinichni-osoblivosti-perebigu-osteoartrozu-u-poyednanni-z-giperurikemiyeyu.
- Denoble AE, Huffman KM, Stabler TV, et al. Uric acid is a danger signal of increasing risk for osteoarthritis through inflammasome activation. Proc Natl Acad Sci USA. 2011 Feb 1;108(5):2088-93. doi: 10.1073/pnas.1012743108.
- Moseng T, Vliet Vlieland TPM, Battista S, et al. –EULAR recommendations for the non-pharmacological core management of hip and knee osteoarthritis: 2023 update. Ann Rheum Dis. 2024 May 15;83(6):730-740. doi: 10.1136/ard-2023-225041.
- Osteoarthritis in over 16s: diagnosis and management. London: National Institute for Health and Care Excellence (NICE). 2022 Oct 19. PMID: 36745715.
- Bannuru RR, Osani MC, Vaysbrot EE, et al. OARSI guidelines for the non-surgical management of knee, hip, and polyarticular osteoarthritis. Osteoarthritis Cartilage. 2019 Nov;27(11):1578-1589. doi: 10.1016/j.joca.2019.06.011.
- Zhang Z, Huang C, Cao Y, et al. 2021 revised algorithm for the management of knee osteoarthritis — the Chinese viewpoint. Aging Clin Exp Res. 2021;33:2141-7. doi: 10.1007/s40520-021-01906-y.
- Arden NK, Perry TA, Bannuru RR, et al. Non-surgical management of knee osteoarthritis: comparison of ESCEO and OARSI 2019 guidelines. Nat Rev Rheumatol. 2021 Jan;17(1):59-66. doi: 10.1038/s41584-020-00523-9.
- Misra D, Felson DT. Evidence-based review of nonsurgical treatments for knee and hip osteoarthritis. Eur J Rheumatol. 2024 Mar 25;11(1):S48-52. doi: 10.5152/eurjrheum.2024.22096.
- Mao L, Wu W, Wang M, et al. Targeted treatment for osteoarthritis: drugs and delivery system. Drug Deliv. 2021 Dec;28(1):1861-1876. doi: 10.1080/10717544. 2021.1971798.
- Kuryata O, Akimov O, Denisenko S, et al. Chondroitin sulfate in osteoarthritis management among diabetic patients: molecular mechanisms and clinical potential. Rom J Diabetes Nutr Metab Dis. 2023;30:481-93. doi: 10.46389/rjd-2023-1425.
- Шуба Н.М., Цимбалюк Т.С., Крилова А.С. Ефективність екстракту кореня імбиру та його протизапальні властивості при остеоартриті колінного суглоба. Український ревматологічний журнал. 2023;92:42-46. doi: 10.32471/rheumatology.2707-6970.92.17989.
- Zeng F, Wang K, Duan H, Xu X-T, Kuang G-Y, Lu M. Diacerein versus non-steroidal anti-inflammatory drugs in the treatment of knee osteoarthritis: a meta-analysis. J Orthop Surg Res. 2023 Apr 18;18(1):308. doi: 10.1186/s13018-023-03786-6.
- Magni A, Agostoni P, Bonezzi C, et al. Management of osteoarthritis: expert opinion on NSAIDs. Pain Ther. 2021 Dec;10(2):783-808. doi: 10.1007/s40122-021-00260-1.
- Katz JN, Arant KR, Loeser RF. Diagnosis and treatment of hip and knee osteoarthritis: a review. JAMA. 2021 Feb 9;325(6):568-578. doi: 10.1001/jama.2020.22171.
- King LK. Osteoarthritis and comorbidity: time for action. Osteoarthritis Cartilage. 2023 Apr;31(4):423-424. doi: 10.1016/j.joca.2023.01.007.
- Шуба Н.М., Воронова Т.Д., Крилова А.С., Хамбір Т.С., Пилипенко А.В. Диференційований підхід до лікування остеоартрозу з супутніми захворюваннями. Український ревматологічний журнал. 2017;68:6-16. Режим доступу: https://www.rheumatology.kiev.ua/article/9984/diferencijovanij-pidxid-do-likuvannya-osteoartrozu-z-komorbidnoyu-patologiyeyu.
- Pavelka K, Bruyère O, Cooper C, et al. Diacerein: benefits, risks and place in the management of osteoarthritis. An opinion-based report from the ESCEO. Drugs Aging. 2016 Feb;33(2):75-85. doi: 10.1007/s40266-016-0347-4.
- Cherniavskyi VV, Baylo AE, Onyshuk LO, Tishchenko VV. Critical evaluation of the current role of –SYSADOA in the management of osteoarthritis (literature review). Pain, Joints, Spine. 2024;14:96-105. doi: 10.22141/pjs.14.2.2024.423.
- Brito R, Costa D, Dias C, Cruz P, Barros P. Chondroitin Sulfate Supplements for Osteoarthritis: A Critical Review. Cureus. 2023 Jun 9;15(6):e40192. doi: 10.7759/cureus.40192.
- Reichenbach S, Sterchi R, Scherer M, et al. Meta-analysis: chondroitin for osteoarthritis of the knee or hip. Ann Intern Med. 2007 Apr 17;146(8):580-90. doi: 10.7326/0003-4819-146-8-200704170-00009.
- Wandel S, Jüni P, Tendal B, et al. Effects of gluco–samine, chondroitin, or placebo in patients with osteoarthritis of hip or knee: network meta-analysis. BMJ. 2010 Sep 16;341:c4675. doi: 10.1136/bmj.c4675.
- Bruyère O, Cooper C, Al-Daghri NM, Dennison EM, Rizzoli R, Reginster JY. Inappropriate claims from non-equivalent medications in osteoarthritis: a position paper endorsed by the European Society for Clinical and Economic Aspects of Osteoporosis, Osteoarthritis and Musculoskeletal Diseases (ESCEO). Aging Clin Exp Res. 2018 Feb;30(2):111-117. doi: 10.1007/s40520-017-0861-1.
- Long H, Liu Q, Yin H, et al. Prevalence trends of site-specific osteoarthritis from 1990 to 2019: findings from the global burden of disease study 2019. Arthritis Rheumatol. 2022 Jul;74(7):1172-1183. doi: 10.1002/art.42089.
- Hermann W, Lambova S, Muller-Ladner U. Current treatment options for osteoarthritis. Curr Rheumatol Rev. 2018;14(2):108-116. doi: 10.2174/1573397113666170829155149.
- Martel-Pelletier J, Pelletier JP. Effects of diacerein at the molecular level in the osteoarthritis disease process. Ther Adv Musculoskelet Dis. 2010 Apr;2(2):95-104. doi: 10.1177/1759720X09359104.
- Yaron M, Shirazi I, Yaron I. Anti-interleukin-1 effects of diacerein and rhein in human osteoarthritic synovial tissue and cartilage cultures. Osteoarthritis Cartilage. 1999 May;7(3):272-80. doi: 10.1053/joca.1998.0201.
- Rintelen B, Neumann K, Leeb BF. A meta-ana–lysis of controlled clinical studies with diacerein in the treatment of osteoarthritis. Arch Intern Med. 2006 Sep 25;166(17):1899-906. doi: 10.1001/archinte.166.17.1899.
- Zhang W, Nuki G, Moskowitz RW, et al. OARSI re–commendations for the management of hip and knee osteoarthritis: part III: Changes in evidence following syste–matic cumulative update of research published through January 2009. Osteoarthritis Cartilage. 2010 Apr;18(4):476-99. doi: 10.1016/j.joca.2010.01.013.
- Almezgagi M, Zhang Y, Hezam K, et al. Diacerein: Recent insight into pharmacological activities and molecular pathways. Biomed Pharmacother. 2020 Nov;131:110594. doi: 10.1016/j.biopha.2020.110594.