Журнал «Боль. Суставы. Позвоночник» Том 15, №1, 2025
Вернуться к номеру
Вивчення ефективності застосування подвійної дози екстракту кореня імбиру для лікування остеоартриту колінних суглобів та кистей
Авторы: Коваленко В.М.1, 2, Крилова А.С.1
1Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
2ДУ «Національний науковий центр «Інститут кардіології, клінічної та регенеративної медицини
імені академіка М.Д. Стражеска Національної академії медичних наук України», м. Київ, Україна
Рубрики: Ревматология, Травматология и ортопедия
Разделы: Клинические исследования
Версия для печати
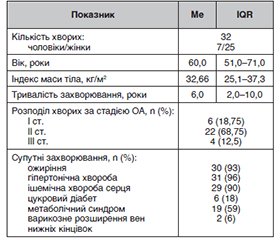
Актуальність. Oстеоартрит є найпоширенішою формою артриту та основною причиною інвалідності. Одним із перспективних препаратів для його лікування є екстракт кореня імбиру, оскільки наявні дані щодо його знеболювальних та протизапальних властивостей. Мета дослідження: вивчити ефективність та безпеку подвійної дози екстракту кореня імбиру у пацієнтів з остеоартритом колінних суглобів та суглобів кистей. Матеріали та методи. Проведено дослідження за участю 58 пацієнтів (11 чоловіків та 47 жінок) віком 30–80 років, які страждали на остеоартрит (32 особи з остеоартритом колінних суглобів та 26 хворих з остеоартритом кистей). Пацієнти приймали фітопрепарат стандартизованого екстракту кореня імбиру в дозі 1200 мг на добу протягом 6 місяців. Методи дослідження: загальноклінічні, анкетування, лабораторні (визначення показників ліпідного, вуглеводного обміну, печінкових маркерів), інструментальні (рентгенологічне дослідження колінних суглобів, ультразвукове дослідження суглобів), методи біомедичної статистики. Результати. На фоні лікування екстрактом кореня імбиру у хворих з остеоартритом колінних суглобів отримано статистично вірогідне зниження вираженості болю за візуально-аналоговою шкалою (ВАШ) на 60 % (р < 0,05), вірогідне (р < 0,05) зменшення кількості загострень захворювання, тривалості загострень у днях та кількості днів прийому нестероїдних протизапальних засобів. У хворих з остеоартритом кистей також отримано статистично вірогідне (р < 0,05) зменшення інтенсивності больового синдрому за ВАШ (на 33 %), індексом FIHOA (на 28 %) та показниками анкети AUSCAN (біль і функціональна активність). Також встановлено зменшення сумарного бала синовіту та доплерівської активності за даними УЗД проксимальних міжфалангових суглобів ІІ–ІV пальців. Підтверджено хорошу переносимість екстракту кореня імбиру у дозі 1200 мг на добу за показниками опитувальників RSI та SODA. Висновки. Результати дослідження свідчать про те, що збільшена доза екстракту кореня імбиру (1200 мг на добу) є ефективною та безпечною для лікування остеоартриту колінних суглобів та кистей.
Background. Osteoarthritis is the most common form of arthritis and the main cause of disability. One of the promising drugs is ginger root extract, since there is a new data on its analgetic and anti-inflammatory properties. The aim of the study was to test effectiveness and safety of a double dose of ginger root extract treatment in patients with knee and hands osteoarthritis. Materials and methods. The study included 58 patients (11 men and 47 women) with osteoarthritis, aged 30 to 80 years, 32 patients had knee osteoarthritis and 26 patients — hand osteoarthritis. Patients were orally administered 1200 mg per day commercially available ginger extract for 6 months. Methods: general clinical, questionnaires (filling in adapted questionnaires), laboratory (cholesterol, blood glucose, bilirubin, ALT, AST, creatinine in the blood), instrumental studies (X-ray examination of joints, ultrasound examination of joints), methods of biomedical statistics. Results. Ginger root extract treatment resulted in a statistically significant decrease in the severity of pain according to visual analogue scale (VAS) by 60 % (p < 0.05), a statistically significant (p < 0.05) decrease in the number of attacks of knee osteoarthritis, the duration of attacks in days and the number of days NSAIDs intake. Beneficial effects of a double dose of ginger root extract are a statistically significant (p < 0.05) decrease in the intensity of the pain syndrome according to VAS by 33 %, the FIHOA index by 28 % and the AUSCAN pain, functional activity indices, a decrease in the total synovitis score and Doppler activity by ultrasound of the hand joints for the distal and proximal interphalangeal joints of the II–IV fingers. The tolerability of 1200 mg of ginger root extract per day was confirmed by reflux (RSI) and dyspepsia (SODA) questionnaires. Conclusion. Based on our study, it can be assumed that an increased dose of ginger root extract (1200 mg per day) may be effective and safe for the treatment knee and hand osteoarthritis.
остеоартрит; гонартрит; остеоартрит кистей; екстракт кореня імбиру
osteoarthritis; knee osteoarthritis; hand osteoarthritis; ginger root extract
Вступ
Матеріали та методи
Методи дослідження
/31.jpg)
Результати
Обговорення
Висновки
- Kolasinski SL, Neogi T, Hochberg MC, et al. American College of Rheumatology/Arthritis Foundation guideline for the management of osteoarthritis of the hand, hip, and knee. Arthritis Rheumatol. 2020 Feb;72(2):220-233. doi: 10.1002/art.41142.
- Wood G, Neilson J, Cottrell E, et al. Osteoarthritis in people over 16: diagnosis and management — updated summary of NICE guidance. BMJ. 2023;380:24. doi: 10.1136/bmj.p24.
- Xu Q, Chen B, Wang Y, et al. The effectiveness of manual therapy for relieving pain, stiffness, and dysfunction in knee osteoarthritis: a systematic review and meta-analysis. Pain Physician. 2017 May;20(4):229-243. doi: 10.36076/pj.2017.243.
- Heidari-Beni M, Moravejolahkami AR, Gorgian P, et al. Herbal formulation “turmeric extract, black pepper, and ginger” versus Naproxen for chronic knee osteoarthritis: A randomized, double-blind, controlled clinical trial. Phytother Res. 2020 Aug;34(8):2067-2073. doi: 10.1002/ptr.6671.
- Bartels EM, Folmer VN, Bliddal H, et al. Efficacy and safety of ginger in osteoarthritis patients: a meta-analysis of randomized placebo-controlled trials. Osteoarthritis Cartilage. 2015 Jan;23(1):13-21. doi: 10.1016/j.joca.2014.09.024.
- Araya-Quintanilla F, Gutierrez-Espinoza H, Munoz-Yanez MJ, Sanchez-Montoya U, Lopez-Jeldes J. Effectiveness of Ginger on Pain and Function in Knee Osteoarthritis: A PRISMA Systematic Review and Meta-Analysis. Pain Physician. 2020 Mar;23(2):E151-E161. PMID: 32214292.
- Lakhan SE, Ford CT, Tepper D. 2015 Zingiberaceae extracts for pain: a systematic review and meta-analysis. Nutr J. 2015 May 14;14:50. doi: 10.1186/s12937-015-0038-8.
- Zhang W, Doherty M, Leeb BF, et al. EULAR evidence-based recommendations for the diagnosis of hand osteoarthritis: report of a task force of ESCISIT. Ann Rheum Dis. 2009 Jan;68(1):8-17. doi: 10.1136/ard.2007.084772.
- Hawker GA, Mian S, Kendzerska T, et al. Measures of adult pain: Visual Analog Scale for Pain (VAS Pain), Numeric Rating Scale for Pain (NRS Pain), McGill Pain Questionnaire (MPQ), Short-Form McGill Pain Questionnaire (SF-MPQ), Chronic Pain Grade Scale (CPGS), Short Form-36 Bodily Pain Scale (SF-36 BPS), and Measure of Intermittent and Constant Osteoarthritis Pain (ICOAP). Arthritis Care Res (Hoboken). 2011 Nov;63 Suppl 11:S240-52. doi: 10.1002/acr.20543.
- Hammer HB, Iagnocco A, Mathiessen A, et al. 2016 Global ultrasound assessment of structural lesions in osteoarthritis: a reliability study by the OMERACT ultrasonography group on scoring cartilage and osteophytes in finger joints. Ann Rheum Dis. 2016 Feb;75(2):402-7. doi: 10.1136/annrheumdis-2014-206289.
- Belafsky PC, Postma GN, Koufman JA. Validity and reliability of the reflux symptom index (RSI). J Voice. 2002 Jun;16(2):274-7. doi: 10.1016/s0892-1997(02)00097-8.
- Rabeneck L. Measuring dyspepsia-related health in randomized trials: the Severity of Dyspepsia Assessment (SODA) and its use in treatment with NSAIDs and COX-2-specific inhibitors. Rheumatology. 2003 Nov; 42(3):iii32-iii39. doi: 10.1093/rheumatology/keg496.
- Moseng T, Vliet Vlieland TPM, Battista S, et al. 2024 EULAR recommendations for the non-pharmacological core management of hip and knee osteoarthritis: 2023 update. Ann Rheum Dis. May 15;83(6):730-740. doi: 10.1136/ard-2023-225041.
- Geng R, Li J, Yu C, Zhang C, et al. Knee osteoarthritis: Current status and research progress in treatment (Review). Exp Ther Med. 2023 Aug 25;26(4):481. doi: 10.3892/etm.2023.12180.
- Jha SK, Kumar B, Paudel KR, et al. The application of bioglass to treat osteoarthritis. EXCLI J. 2023 Dec 4;22:1232-1234. doi: 10.17179/excli2023-6613.
- Buhrmann C, Honarvar A, Setayeshmehr M, et al. Herbal Remedies as Potential in Cartilage Tissue Engineering: An Overview of New Therapeutic Approaches and Strategies. Molecules. 2020 Jul 6;25(13):3075. doi: 10.3390/molecules25133075.
- Mozaffari-Khosravi H, Naderi Z, Dehghan A, et al. Effect of ginger supplementation on proinflammatory cytokines in older patients with osteoarthritis: outcomes of a randomized controlled clinical trial. J Nutr Gerontol Geriatr. 2016 Jul-Sep;35(3):209-18. doi: 10.1080/21551197.2016.1206762.
- Aryaeian N, Mahmoudi M, Shahram F. The Effect of Ginger Supplementation on IL2, TNFα, and IL1β Cytokines Gene Expression Levels in Patients with Active Rheumatoid Arthritis: A Randomized Controlled Trial. Med. J. Islam. Repub. Iran. 2019;33:154. doi: 10.34171/mjiri.33.154.
- Baek HI, Shen L, Ha KC, et al. Effectiveness and safety of steamed ginger extract on mild osteoarthritis: a randomized, double-blind, placebo-controlled clinical trial. Food Funct. 2024 Sep 16;15(18):9512-9523. doi: 10.1039/d4fo01640h.
- Aryaeian N, Shahram F, Mahmoudi M, et al. The effect of ginger supplementation on some immunity and inflammation intermediate genes expression in patients with active Rheumatoid Arthritis. Gene. 2019 May 25;698:179-185. doi: 10.1016/j.gene.2019.01.048.
- Amorndoljai P, Taneepanichskul S, Niempoog S, et al. Comparative of Ginger Extract in Nanostructure Lipid Carrier (NLC) and 1% Diclofenac Gel for Treatment of Knee Osteoarthritis (OA). J Med Assoc Thai. 2017 Apr;100(4):447-56. PMID: 29911849.
- Zhang Y. Studies on Compositions of Ginger Oleoresin by Su-Percritical CO2 Extraction compare with ultrasonic solvent extraction. Acad. J. Eng. Technol. Sci. 2021;4(8):22-25. doi: 10.25236/AJETS.2021.040803.
- Szymczak J, Grygiel-Górniak B, Cielecka-Piontek J. Zingiber Officinale Roscoe: the antiarthritic potential of a popular spice — preclinical and clinical evidence. Nutrients. 2024;16(5):741. doi: 10.3390/nu16050741.
- Niempoog S, Pawa KK, Amatyakul C. The efficacy of powdered ginger in osteoarthritis of the knee. J Med Assoc Thai. 2012 Jan;95 Suppl 1:S59-64. PMID: 23964445.
- Nevalainen MT, Uusimaa AP, Saarakkala S. The ultrasound assessment of osteoarthritis: the current status. Skeletal Radiol. 2023 Nov;52(11):2271-2282. doi: 10.1007/s00256-023-04342-3.

/32.jpg)
/32_2.jpg)
/33.jpg)
/34.jpg)