Журнал «Медицина неотложных состояний» Том 20, №7, 2024
Вернуться к номеру
Нові методи лікування післяопераційного больового синдрому сильної та середньої інтенсивності в пацієнтів з онкологічними захворюваннями
Авторы: Дмитрієв Д.В. (1), Барса М.М. (2)
(1) - Комунальне некомерційне підприємство «Подільський регіональний центр онкології Вінницької
обласної ради», м. Вінниця, Україна
(2) - Комунальне підприємство «Рівненська обласна клінічна лікарня імені Юрія Семенюка»
Рівненської обласної ради, м. Рівне, Україна
Рубрики: Медицина неотложных состояний
Разделы: Клинические исследования
Версия для печати
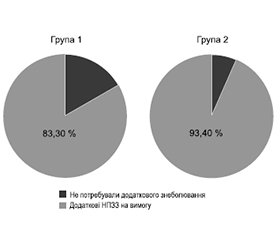
Актуальність. Анестезіологічне забезпечення операцій в онкології є викликом для лікаря-анестезіолога, що пов’язано як з об’ємом хірургічної травми, так і з наявністю таких проблем, як попередній хронічний біль і тривале споживання наркотичних аналгетиків до операції. Тому необхідний пошук нових стратегій оптимізації післяопераційного знеболювання саме в цій когорті пацієнтів. Мета: оцінка клінічної ефективності й безпеки лікарського засобу з діючою речовиною диналбуфіну себакат (150 мг/2 мл) у пацієнтів з больовим синдромом середньої та вираженої інтенсивності після реконструктивних операцій (мамопластика) внаслідок хірургічного лікування пухлин молочної залози. Матеріали та методи. Дизайн дослідження — багатоцентрове рандомізоване проспективне відкрите. Включено 60 стаціонарних пацієнтів, які перенесли мамопластику як наслідок хірургічного лікування пухлин молочної залози. Обидві групи отримували препарати згідно з протоколами мультимодальної аналгезії (парацетамол 1 г 4 р/добу, декскетопрофен 50 мг 3 р/добу, додаткові дози нестероїдних протизапальних засобів (НПЗЗ) на вимогу) і морфін на вимогу не більше ніж 40 мг/добу. Пацієнти дослідної групи (30 осіб) отримали 150 мг диналбуфіну себакату внутрішньом’язово за 12–24 год до оперативного втручання. Кінцевими точками дослідження були: вираженість больового синдрому за цифровою рейтинговою шкалою в часових точках 6, 24, 48, 96 і 120 год, кількість доз НПЗЗ і морфіну на вимогу, кількість і структура ускладнень від введення препарату. Результати. Статистично значиму різницю в рівнях болю за цифровою рейтинговою шкалою було виявлено в часових точках 6 і 24 год (р < 0,05). Через 48, 96 і 120 год рівень болю не відрізнявся в обох групах. Споживання морфіну вірогідно відрізнялося в дослідній і контрольній групі в першу добу (0 [0; 10] мг і 10,0 [0; 10] мг відповідно, р < 0,05). Для другої доби показники становили 0 [0; 10] мг і 0 [0; 10] мг, р = 0,232. 83,3 % пацієнтів дослідної групи і 93,4 % пацієнтів конт-рольної групи потребували додаткового призначення НПЗЗ. Висновки. У дослідженні було продемонстровано, що диналбуфіну себакат є ефективним і безпечним компонентом мультимодальної аналгезії, при цьому в дослідній групі, на відміну від контрольної, було досягнуто цільових рівнів контролю над післяопераційним болем упродовж перших 24 годин після оперативного втручання.
Background. Anesthesia management in oncology surgeries poses significant challenges for anesthesiologists due to the extent of surgical trauma and the presence of pre-existing conditions such as chronic pain and prolonged use of narcotic analgesics. This necessitates the development of novel strategies to optimize postoperative pain management, particularly in this cohort. Objective: to evaluate the clinical efficacy and safety of a medicinal product with active ingredient dinalbuphine sebacate (150 mg/2 ml) in patients with moderate to severe pain syndrome following reconstructive mammoplasty due to breast cancer surgery. Materials and methods. This was a multicenter, randomized, prospective, open-label study involving 60 inpatients who underwent mammoplasty as a result of breast cancer surgery. Both groups received medications in accordance with multimodal analgesia protocols (paracetamol 1 g four times daily, dexketoprofen 50 mg three times daily, additional doses of non-steroidal anti-inflammatory drugs (NSAIDs) as needed) and morphine as needed at a maximum dose of 40 mg/day. Patients in the experimental group (30 participants) received 150 mg of dinalbuphine sebacate intramuscularly 12–24 hours before surgery. The primary endpoints included pain intensity measured on a numerical rating scale at 6, 24, 48, 96, and 120 hours postoperatively, the number of doses of NSAIDs and morphine as needed, and the incidence and nature of complications associated with drug administration. Results. A statistically significant difference in pain levels on the numerical rating scale was observed at 6 and 24 hours (p < 0.05). After 48, 96, and 120 hours, pain levels did not differ between the groups. Morphine consumption differed significantly between the experimental and control groups on the first postoperative day (0 [0; 10] mg vs. 10.0 [0; 10] mg, respectively, p < 0.05). On the second day, the values were 0 [0; 10] mg vs. 0 [0; 10] mg, respectively, p = 0.232. Additional NSAIDs administration was required by 83.3 % of patients in the experimental group and 93.4 % of controls. Conclusions. The study demonstrated that dinalbuphine sebacate is an effective and safe component of multimodal analgesia. In the experimental group, target levels of postoperative pain control were achieved during the first 24 hours following surgery, unlike the control group.
диналбуфіну себакат; післяопераційний біль; онкологія; мамоплаcтика
dinalbuphine sebacate; postoperative pain; oncology; mammoplasty
Вступ
Матеріали та методи
Результати
Обговорення
- Bray F, Laversanne M, Sung H, Ferlay J, Siegel RL, Soerjomataram I, Jemal A. Global Cancer Statistics 2022: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA: A Cancer Journal for Clinicians. 2024;74(3). https://doi.org/10.3322/caac.21834.
- Bray F, Laversanne M, Weiderpass E, Soerjomataram I. The ever increasing importance of cancer as a leading cause of premature death worldwide. Cancer. 2021;127(16).
- Ferlay J, Ervik M, Lam F, Laversanne M, Colombet M, Mery L et al. Global Cancer Observatory: Cancer Today. Lyon, France: International Agency for Research on Cancer. 2024. https://gco.iarc.who.int/tod.
- Cata JP, Corrales G, Speer B, Owusu-Agyemang P. Postoperative acute pain challenges in patients with cancer. Best Practice & Research Clinical Anaesthesiology. 2019;33(3). https://doi.org/10.1016/j.bpa.2019.07.018.
- Okuda J, Suzuki T, Wakaizumi K, Kato J, Yamada T, Morisaki H. Effects of Thoracic Epidural Anesthesia on Systemic and Local Inflammatory Responses in Patients Undergoing Lung Cancer Surgery: A Randomized Controlled Trial. Journal of Cardiothoracic and Vascular Anesthesia. 2022;36(5):1380-1386. https://doi.org/10.1053/j.jvca.2021.08.026.
- Müller SD, Ziegler JSH, Piegeler T. Local Anesthetics and Recurrence after Cancer Surgery — What’s New? A Narrative Review. Journal of Clinical Medicine. 2021;10(4):719. https://doi.org/10.3390/jcm10040719.
- Kietaibl S, Ferrandis R, Godier A, Llau J, Lobo C, Macfarlane AJ et al. Regional anaesthesia in patients on antithrombotic drugs. European Journal of Anaesthesiology. 2022;39(2):100-132. https://doi.org/10.1097/eja.0000000000001600.
- Falanga A, Marchetti M. Cancer-Associated Thrombosis: Enhanced awareness and pathophysiologic complexity. Journal of Thrombosis and Haemostasis. 2023;21(6). https://doi.org/10.1016/j.jtha.2023.02.029.
- Elsabeeny WY, Ibrahim MA, Shehab NN, Mohamed A, Wadod MA. Serratus Anterior Plane Block and Erector Spinae Plane Block Versus Thoracic Epidural Analgesia for Perioperative Thoracotomy Pain Control: A Randomized Controlled Study. Journal of Cardiothoracic and Vascular Anesthesia. 2021;35(10). https://doi.org/10.1053/j.jvca.2020.12.047.
- Stewart JW, Yopp A, Porembka MR, Karalis JD, Sunna M, Schulz C. et al. Pain Management After Open Liver Resection: Epidural Analgesia Versus Ultrasound-Guided Erector Spinae Plane Block. Cureus. 2022;14(8). https://doi.org/10.7759/cureus.28185.
- Van Herreweghe І, De Fré О, Polus F, Cops J, López AM, Vandepitte C et al. Spinal anesthesia in patients with aortic stenosis: a research report. Regional Anesthesia and Pain Medicine. 2024:rapm-105113. https://doi.org/10.1136/rapm-2023-105113.
- Malinovsky J-M, Chiriac AM, Tacquard C, Mertes PM, Demoly P. Allergy to local anesthetics: Reality or myth? La Presse Médicale. 2016;45(9):753-757. https://doi.org/10.1016/j.lpm.2016.05.011.
- Ramirez M, Strang A, Roland G, Lasala J, Owusu-Agyemang P. Perioperative Pain Management and Cancer Outcomes: A Narrative Review. Journal of Pain Research. 2023;16:4181-4189. https://doi.org/10.2147/JPR.S432444.
- Ash SA, Buggy DJ. Does regional anaesthesia and analgesia or opioid analgesia influence recurrence after primary cancer surgery? An update of available evidence. Best Practice & Research Clinical Anaesthesiology. 2023;27(4):441-456. https://doi.org/10.1016/j.bpa.2013.10.005.
- Paice JA, Bohlke K, Barton D, Craig DS, El-Jawahri A, Hershman DL et al. Use of Opioids for Adults With Pain From Cancer or Cancer Treatment: ASCO Guideline. Journal of Clinical Oncology. 2023;41(4):914-930. https://doi.org/10.1200/jco.22.02198.
- Baldo BA. Toxicities of opioid analgesics: respiratory depression, histamine release, hemodynamic changes, hypersensitivity, serotonin toxicity. Archives of Toxicology. 2021;95(8):2627-2642. https://doi.org/10.1007/s00204-021-03068-2.
- Duong A, Ponniah AK, VanDeCapelle C, Mossuto F, Rome-ril E, Phillips S et al. Effect of a Postoperative Multimodal Opioid-Sparing Protocol vs Standard Opioid Prescribing on Postoperative Opioid Consumption After Knee or Shoulder Arthroscopy. JAMA. 2022;328(13):1326. https://doi.org/10.1001/jama.2022.16844.
- List MA, Knackstedt M, Liu L, Kasabali A, Mansour J, Pang J et al. Enhanced recovery after surgery, current, and future considerations in head and neck cancer. Laryngoscope Investigative Otolaryngology. 2023;8(5):1240-1256. https://doi.org/10.1002/lio2.1126.
- Kharasch ED, Avram MJ, Clark JD. Rational Periope-rative Opioid Management in the Era of the Opioid Crisis. Ane-sthesiology. 2020;132(4):603-605. https://doi.org/10.1097/aln.0000000000003166.
- Schwenk W. Optimized perioperative management (fast-track, ERAS) to enhance postoperative recovery in elective colorectal surgery. GMS Hygiene and Infection Control. 2022;17:Doc10. https://doi.org/10.3205/dgkh000413.
- Kaski SW, White AN, Gross JD, Siderovski DP. Potential for Kappa-Opioid Receptor Agonists to Engineer Nonaddictive Analgesics: A Narrative Review. Anesthesia & Analgesia. 2020;132(2):406-419. https://doi.org/10.1213/ane.0000000000005309.
- Zhou Q, Zhang Z, Long S, Li W, Wang B, Liang N. Opioids in cancer: The κ opioid receptor (Review). Molecular Medicine Reports. 2022;25(2):44. https://doi.org/10.3892/mmr.2021.12560.
- Tien Y, Huang W-C, Kuo H-Y, Tai L, Uang Y-S, Chern WH, Huang J-D. Pharmacokinetics of dinalbuphine sebacate and nalbuphine in human after intramuscular injection of dinalbuphine sebacate in an extended-release formulation. Biopharmaceutics & Drug Disposition. 2017;38(8):494-497. https://doi.org/10.1002/bdd.2088.
- Dmytriiev D. Study of the intensity of postoperative pain after mine-explosive injury: A pilot study of different analgesics [Вивчення інтенсивністі післяопераційного болю після мінно-вибухової травми: пілотне дослідження різних аналгетиків]. Emergency Medicine (Ukraine). 2024;20(5):356-362.
- Altman AD, Helpman L, McGee J, Samouëlian V, Auclair M-H, Brar H, Nelson GS. Enhanced recovery after surgery: implementing a new standard of surgical care. Canadian Medical Association Journal. 2019;191(17):E469-E475. https://doi.org/10.1503/cmaj.180635.
- Rivas E, Cohen B, Pu X, Xiang L, Saasouh W, Mao G et al. Pain and Opioid Consumption and Mobilization after Surgery: Post Hoc Analysis of Two Randomized Trials. Anesthesiology. 2022;136(1):115-126. https://doi.org/10.1097/ALN.0000000000004037.
- Toleska M, Dimitrovski A. Is Opioid-Free General Anesthesia More Superior for Postoperative Pain Versus Opioid General Anesthesia in Laparoscopic Cholecystectomy? Prilozi. 2019;40(2):81-87. https://doi.org/10.2478/prilozi-2019-0018.
- Rosenberger DC, Pogatzki-Zahn EM. Chronic post-surgical pain — update on incidence, risk factors and preventive treatment options. BJA Education. 2022;22(5). https://doi.org/10.1016/j.bjae.2021.11.008.
- Zhou Y, Liu X, Ding C, Xiang B, Yan L. Positive Preemptive Analgesia Effectiveness of Pregabalin Combined with Celecoxib in Total Knee Arthroplasty: A Prospective Controlled Randomized Study. Pain Research and Management. 2023;2023(12):1-10. https://doi.org/10.1155/2023/7088004.
- Schug SA, Lavand’homme P, Barke A, Korwisi B, Rief W, Treede R-D. The IASP classification of chronic pain for ICD-11. Pain. 2019;160(1):45-52. https://doi.org/10.1097/j.pain.0000000000001413.
- Chou R, Gordon DB, de Leon-Casasola OA, Rosenberg JM, Bickler S, Brennan T et al. Management of Postoperative Pain: A Clinical Practice Guideline From the American Pain Society, the American Society of Regional Anesthesia and Pain Medicine, and the American Society of Anesthesiologists’ Committee on Regional Anesthesia, Executive Committee, and Administrative Council. The Journal of Pain. 2016;17(2):131-157. https://doi.org/10.1016/j.jpain.2015.12.008.
- Gan TJ, Habib AS, Miller TE, White W, Apfelbaum JL. Incidence, patient satisfaction, and perceptions of post-surgical pain: results from a US national survey. Current Medical Research and Opinion. 2013;30(1):149-160. https://doi.org/10.1185/03007995.2013.860019.
- Myles PS, Myles DB, Galagher W, Boyd D, Chew C, MacDonald N, Dennis A. Measuring acute postoperative pain using the visual analog scale: the minimal clinically important difference and patient acceptable symptom state. British Journal of Anaesthesia. 2017;118(3):424-429. https://doi.org/10.1093/bja/aew466.
- Moore RA, Straube S, Aldington D. Pain measures and cut-offs — “no worse than mild pain” as a simple, universal outcome. Anaesthesia. 2013;68(4):400-412. https://doi.org/10.1111/anae.12148.
- Carroll IR, Hah JM, Barelka PL, Wang CKM, Wang BM, Gillespie MJ et al. Pain Duration and Resolution following Surgery: An Inception Cohort Study. Pain Medicine. 2015;16(12):2386-2396. https://doi.org/10.1111/pme.12842.
- Tighe PJ, King CD, Zou B, Fillingim RB. Time to Onset of Sustained Postoperative Pain Relief (SuPPR). The Clinical Journal of Pain. 2016;32(5):371-379. https://doi.org/10.1097/ajp.0000000000000285.
- Schwartz J, Gan TJ. Management of postoperative nausea and vomiting in the context of an Enhanced Recovery after Surgery program. Best Practice & Research Clinical Anaesthesiology. 2020;34(4):687-700. https://doi.org/10.1016/j.bpa.2020.07.011.
- Dmytriiev D, Dmytriiev K, Stoliarchuk O, Semenenko A. Multiple organ dysfunction syndrome: What do we know about pain management? A narrative review. Anaesthesia, Pain and Intensive Care. 2019;23(1):84-91.
- Ahmed HM, Atterton BP, Crowe GG, Barratta JL, Johnson M, Viscusi E et al. Recommendations for effective documentation in regional anesthesia: An expert panel Delphi consensus project. Regional Anesthesia and Pain Medicine. 2022;47(5):301-308, DOI: 10.1136/RAPM-2021-103136.
- Dobrovanov O, Dmytriiev D, Prochotsky A, Vidiscak M, Furkova K. Pain in COVID-19: Quis est culpa? Electronic Journal of Ge-neral Medicine. 2023;20(1):art. no. em435. DOI: 10.29333/ejgm/12672.

/50.jpg)