Международный эндокринологический журнал Том 19, №8, 2023
Вернуться к номеру
Оцінка функції аденогіпофіза та рівня греліну у дітей із синдромом біологічно неактивного гормону росту
Авторы: Спринчук Н.А. (1), Марушко Ю.В. (2), Маліновська Т.М. (1)
(1) - ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ, Україна
(2) - Інститут післядипломної освіти Національного медичного університету імені О.О. Богомольця, м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
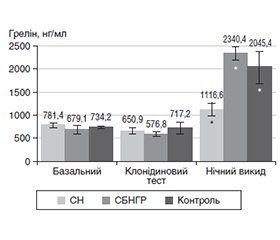
Актуальність. Мутації у гені гормону росту (ГР) викликають різні форми синдрому біологічно неактивного гормону росту (СБНГР). Грелін потенціює секрецію ГР. Гормони аденогіпофіза беруть участь у механізмах росту людини. Рівень інсуліноподібного фактора росту-1 (ІФР-1) є критерієм активності ГР. Мета дослідження. Оцінити функції аденогіпофіза та визначити рівень греліну в пацієнтів із СБНГР для оптимізації діагностики й лікування хворих цієї категорії. Матеріали та методи. Було оцінено антропометричні параметри у 158 дітей із СБНГР, середній вік яких становив 7,83 ± 1,23 року. Функцію аденогіпофіза оцінювали за рівнями соматотропного (СТГ), тиреотропного (ТТГ), адренокортикотропного (АКТГ), лютеїнізуючого (ЛГ), фолікулостимулюючого (ФСГ) гормонів та їхніми відповідними периферичними гормонами, які визначали за допомогою радіоімунологічних методик і хемілюмінесцентного імуноаналізу. Проведений статистичний аналіз результатів дослідження. Результати. Викид СТГ на тлі фармтестів у пацієнтів із СБНГР був вищим за 10 нг/мл, базальний рівень ІФР-1 — значно менший від референтних значень. Після проведення 4-денної проби на чутливість до ГР рівень ІФР-1 зростав більше ніж удвічі. На тлі лікування рГР показники ТТГ, АКТГ і кортизолу сироватки вірогідно змінювались, але їхні рівні перебували у межах референтних значень. Вірогідні зміни рівня греліну виявили через 120 хв після засинання. Більшість дітей із СБНГР мали вчасний статевий розвиток, раннє статеве дозрівання спостерігали в 19 дітей, найменшою була група пацієнтів із затримкою пубертату (5 дітей). За незадовільного кінцевого зросту (КЗ) при лікуванні ГР додавали аналоги гонадотропін-рилізинг-гормону (аГРГ). Висновки. Для СБНГР є характерними нормальні/високі рівні СТГ і знижений ІФР-1. Крім того, у дітей із СБНГР встановлено суттєве підвищення греліну в перші години після засинання. Проба на чутливість до ГР є вірогідним діагностичним методом. У пацієнтів із СБНГР не виявлено порушень щитоподібної та надниркових залоз. У дітей із СБНГР спостерігають нормальний статевий розвиток зі схильністю до раннього. Одночасне застосування аГРГ у поєднанні з препаратами ГР вірогідно поліпшує КЗ пацієнтів.
Background. Mutations in the growth hormone (GH) gene cause various forms of biologically inactive growth hormone (BIGH) syndrome. Ghrelin potentiates the secretion of GH. Adenohypophysis hormones take part in human growth mechanisms. Insulin-like growth factor 1 (IGF-1) level is a criterion of GH activity. The purpose of the study was to assess the adenohypophysis functions and to determine the role of ghrelin in patients with BIGH syndrome to optimize the diagnosis and treatment. Materials and methods. Anthropometric parameters were evaluated in 158 children with BIGH syndrome whose average age was 7.83 ± 1.23 years. The function of the adenohypophysis was evaluated according to the levels of somatotropin, thyroid-stimulating, adrenocorticotropic, luteinizing, follicle-stimulating hormone and their corresponding peripheral hormones, which were determined by radioimmunological methods and chemiluminescent immunoassay. A statistical analysis of the results was carried out. Results. The release of GH against the background of clonidine and insulin tests in patients with BIGH syndrome was higher than 10 ng/ml, the basal level of IGF-1 was significantly lower than the reference values. After a 4-day test for sensitivity to GH, the level of IGF-1 increased more than 2 times. Against the background of treatment with recombinant GH, serum thyroid-stimulating, adrenocorticotropic hormone, and cortisol indicators changed significantly, but their levels fluctuated within the reference values. Significant changes in ghrelin content were detected 120 minutes after falling asleep. Most children with BIGH syndrome had timely sexual development, precocious puberty was revealed in 19 children, the smallest was the group with delayed puberty (5 children). Gonadotropin-releasing hormone analogues were added to the GH treatment in case of unsatisfactory final growth. Conclusions. Normal/high levels of GH and reduced IGF-1 are characteristic of children with BIGH syndrome. In addition, these children have a significant increase in ghrelin in the first hours after falling asleep. The test for sensitivity to GH is a reliable diagnostic method. Thyroid and adrenal disorders were not found in patients with BIGH syndrome. Children with BIGH syndrome have normal sexual development with a tendency to precocious puberty. The simultaneous use of gonadotropin-releasing hormone analogues in combination with GH preparations significantly improves patients’ final growth.
біологічно неактивний гормон росту; діти; низькорослість; грелін; аденогіпофіз
biologically inactive growth hormone; children; short stature; ghrelin; adenohypophysis
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Gahete M.D., Durán-Prado M., Luque R.M., Martínez-Fuentes A.J., Quintero A., Gutiérrez-Pascual E., et al. Understanding the multifactorial control of growth hormone release by somatotropes: lessons from comparative endocrinology. Ann. N. Y. Acad. Sci. 2009 Apr. 1163. 137-53. doi: 10.1111/j.1749-6632.2008.03660.x.
- Ranke M.B., Wit J.M. Growth hormone — past, present and future. Nat. Rev. Endocrinol. 2018 May. 14(5). 285-300. doi: 10.1038/nrendo.2018.22.
- Loche S., Di Iorgi N., Patti G., Noli S., Giaccardi M., Oli–vieri I., et al. Growth hormone deficiency in the transition age. Endocr. Dev. 2018. 33. 46-56. doi: 10.1159/000487525.
- Takahashi Y., Kaji H., Okimura Y., Goji K., Abe H., Chihara K. Short stature caused by a mutant growth hormone with an antagonistic effect. Endocr. J. 1996 Oct. 43 Suppl. S27-32. doi: 10.1507/endocrj.43.suppl_s27.
- Ranke M.B., Price D.A., Reiter E.O. (eds). Growth Hormone Therapy in Pediatrics — 20 Years of KIGS. Basel, Karger, 2007. P. 29-37. doi.org/10.1159/000101520.
- Petkovic V., Miletta M.C., Boot A.M., Losekoot M., Flück C.E., Pandey A.V., et al. Short stature in two siblings heterozygous for a novel bioinactive GH mutant (GH-P59S) suggesting that the mutant also affects secretion of the wild-type GH. Eur. J. Endocrinol. 2013 Feb 15. 168(3). K35-43. doi: 10.1530/EJE-12-0847.
- Mullis P., Ranke M.B. Diagnostics of endocrine function in children and adolescents (4th revised and extended edition). Basel: Karger Publishers, 2011. Doi: https://doi.org/10.1159/isbn.978-3-8055-9455-8.
- Petkovic V., Eblé A., Pandey A.V., Betta M., Mella P., Flück C.E., et al. A novel GH-1 gene mutation (GH-P59L) causes partial GH deficiency type II combined with bioinactive GH syndrome. Growth Horm. IGF Res. 2011 Jun. 21(3). 160-6. doi: 10.1016/j.ghir.2011.04.002.
- Khatib N., Gaidhane S., Gaidhane A.M., Khatib M., Simkhada P., Gode D., Zahiruddin Q.S. Ghrelin: ghrelin as a regulatory Peptide in growth hormone secretion. J. Clin. Diagn. Res. 2014 Aug. 8(8). MC13-7. doi: 10.7860/JCDR/2014/9863.4767.
- Carreira M.C., Crujeiras A.B., Andrade S., Monteiro M.P., Casanueva F.F. Ghrelin as a GH-releasing factor. Endocr. Dev. 2013. 25. 49-58. doi: 10.1159/000346052.
- Farajallah A., Shanable S. Ghrelin structure and it’s receptors: a review. J. Research in Pharmaceutical Science. 2017. 3(5). 8-13.
- Poher A.L., Tschöp M.H., Müller T.D. Ghrelin regulation of glucose metabolism. Peptides. 2018 Feb. 100. 236-242. doi: 10.1016/j.peptides.2017.12.015.
- Perchard R., Clayton P.E. Ghrelin and growth. Endocr. Dev. 2017. 32. 74-86. http://dx.doi.org/10.1159/000475732.
- Mazziotti G., Giustina A. Glucocorticoids and the regulation of growth hormone secretion. Nat. Rev. Endocrinol. 2013 May. 9(5). 265-76. doi: 10.1038/nrendo.2013.5.
- Gutch M., Kumar S., Razi S.M., Gupta A., Kumar S., Gupta K.K., Singh M.M. Prevalence of short stature in juvenile hypothyroidism and the impact of treatment on various skeletal manifestation and growth velocity in a teritary care center. Chrismed J. Health Res. 2015. 2. 251-6. DOI: 10.4103/2348-3334.158704.
- Rohayem J., Drechsel H., Tittel B., Hahn G., Pfaeffle R., Huebner A. Long-term outcomes, genetics, and pituitary morphology in patients with isolated growth hormone deficiency and multiple pituitary hormone deficiencies: A single-centre experience of four decades of growth hormone replacement. Horm. Res. Paediatr. 2016. 86(2). 106-16. doi: 10.1159/000448098.
- Acerini C.L., Wac K., Bang P., Lehwalder D. Optimizing patient management and adherence for children receiving growth hormone. Front. Endocrinol. (Lausanne). 2017 Nov 20. 8. 313. doi: 10.3389/fendo.2017.00313.
- Blum W.F., Alherbish A., Alsagheir A., El Awwa A., Kaplan W., Koledova E., Savage M.O. The growth hormone-insulin-like growth factor-I axis in the diagnosis and treatment of growth disorders. Endocr. Connect. 2018 Jun. 7(6). R212-22. doi: 10.1530/EC-18-0099.
- Bhat N., Dulmovits E., Lane A., Messina C., Wilson T. Combined simultaneous arginine clonidine stimulation test: Timing of peak growth hormone (GH) concentration and correlation with clinical indices of GH status. Growth Horm. IGF Res. 2018 Jun. 40. 28-31. doi: 10.1016/j.ghir.2018.04.002.
- Kim H.-S. Clinical application of gonadotropin-releasing hormone analogs in children and adolescents. Korean J. Pediatr. 2010 Mar. 53(3). 294-9. doi: 10.3345/kjp.2010.53.3.294.
- Smuel K., Kauli R., Lilos P., Laron Z. Growth, development, puberty and adult height before and during treatment in children with congenital isolated growth hormone deficiency. Growth Horm. IGF Res. 2015 Aug. 25(4). 182-8. doi: 10.1016/j.ghir.2015.05.001.
- Toumba M., Kokotsis V., Savva S.C., Skordis N. Expensive therapies in children: benefit versus cost of combined treatment of recombinant human growth hormone and gonadotropin-releasing hormone analogue in girls with poor height potential. J. Pediatr. Endocrinol. Metab. 2014 Mar. 27(3-4). 311-6. doi: 10.1515/jpem-2013-0210.
- Reh C.S., Geffner M.E. Somatotropin in the treatment of growth hormone deficiency and Turner syndrome in pediatric patients: a review. Clin. Pharmacol. 2010. 2. 111-22. doi: 10.2147/CPAA.S6525. Epub 2010 Jun 1. PMID: 22291494; PMCID: PMC3262362.
- Vyshnevs'ka O.A., Bol'shova O.V. Influence of replacement growth hormone therapy (hGH) on pituitary-thyroid and pituitary-adrenal systems in prepubertal children with GH deficiency. Lik. Sprava. 2013 Jun. (4). 81-7. Ukrainian. PMID: 25095691.
- Parretti H., Okosieme O., Vanderpump M. Current recommendations in the management of hypothyroidism: developed from a statement by the British Thyroid Association Executive. Br. J. Gen. Pract. 2016 Oct. 66(651). 538-40. doi: 10.3399/bjgp16X687493.
- Sprynchuk N., Bolshova O. Influence of recombinant growth hormone treatment on the state of pituitary-thyroid and pituitary-adrenal systems in children with syndrome of biologically inactive growth hormone. ScienceRise: Medical Science. 2019. 2(29). 19-22. https://doi.org/10.15587/2519-4798.2019.161763.
- Bolshova O., Malinovska T. The content of ghrelin and leptin in the blood plasma of children and adolescents with hypothalamic dysfunction. International Journal оf Endocrinology (Ukraine). 2018. 14(8). 719-724. https://doi.org/10.22141/2224-0721.14.8.2018.154849.
- Soliman A., De Sanctis V., Elalaily R., Bedair S. Advances in pubertal growth and factors influencing it: Can we increase pubertal growth? Indian J. Endocrinol. Metab. 2014 Nov. 18(Suppl. 1). S53-62. doi: 10.4103/2230-8210.145075.
- Sprinchuk N. The psychological state of children with syndrome of biologically inactive growth hormone. International Journal оf Endocrinology (Ukraine). 2018. 14(8). 725-729. https://doi.org/10.22141/2224-0721.14.8.2018.154850.
- Sprynchuk N., Bolshova O. Syndrome of biologically inactive growth hormone — features of diagnosis and treatment. Endokrynologia | Endocrinology. 2023. 28(1). 82-89. Retrieved from https://endokrynologia.com.ua/index.php/journal/article/view/694.
- Bolshova O., Sprynchuk N., Kvacheniuk D., Muz N., Ryznychuk M., Lukashuk I., et al. An interaction between growth hormone/insulin-like growth factor-1 and vitamin D in children with short sta–ture. Reproductive Endocrinology. 2022. 63-64. 34-38. https://doi.org/10.18370/2309-4117.2022.63.34-38.