Международный эндокринологический журнал Том 19, №7, 2023
Вернуться к номеру
Рівень гомоцистеїну та поліморфізм генів фолатного циклу у жінок із синдромом полікістозних яєчників
Авторы: Архипкіна Т.Л., Бондаренко В.О., Любимова Л.П., Місюра К.В.
ДУ «Інститут проблем ендокринної патології ім. В.Я. Данилевського НАМН України», м. Харків, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
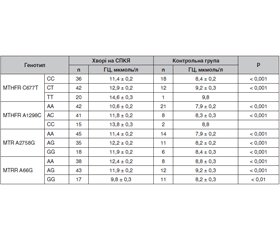
Актуальність. Синдром полікістозних яєчників (СПКЯ) — багатофакторне захворювання, у розвитку якого важливе значення має поліморфізм генів. Останніми роками з’являються дані щодо ролі гомоцистеїну (ГЦ) у формуванні СПКЯ, а гіпергомоцистеїнемія навіть вважається однією з основних ознак цього захворювання. Причини, які призводять до порушень обміну ГЦ, дуже різноманітні та в більшості залежать від стану генів фолатного циклу. Водночас існуючі дані щодо впливу поліморфізму генів 5,10-метилентетрагідро-фолат-редуктази (MTHFR), метіонін-синтази (MTR), метіонін-синтази-редуктази (MTRR) на розвиток гіпергомоцистеїнемії та ризик виникнення СПКЯ нечисленні та суперечливі. Мета: дослідити поліморфізм генів, що кодують ферменти фолатного циклу MTHFR, MTR, MTRR, та встановити їх зв’язок з рівнем ГЦ у хворих на СПКЯ. Матеріали та методи. Обстежено 129 жінок віком 20–28 років: основна група — 98 хворих із СПКЯ, контрольна — 31 здорова жінка. Визначено вміст ГЦ у сироватці крові та проведено молекулярно-генетичне дослідження з ідентифікацією генів MTHFR, MTR, MTRR. Результати. Поліморфні варіанти генів ферментів фолатного циклу мали місце як у хворих на СПКЯ, так і у здорових жінок, однак за умов СПКЯ спостерігалась істотно вища концентрація ГЦ у сироватці крові. Аналіз поліморфізму гена MTHFR С677Т показав, що наявність мутаційного алеля Т супроводжувалась підвищенням рівня ГЦ (12,9 ± 0,2 мкмоль/л) та ризиком виникнення СПКЯ (OR = 1,19; 95% CI 0,52–2,71). При наявності двох алелів Т рівень ГЦ (14,6 ± 0,3 мкмоль/л) та шанс виникнення СПКЯ (OR = 7,69; 95% CI 0,98–59,87) зростали ще більше відносно функціонально «нормального» генотипу C677C. Між поліморфізмом гена MTHFR у локусі 1298 та СПКЯ також існувала асоціація, сила якої залежала від кількості патологічних алелів С та була опосередкована рівнем ГЦ, хоча ця мутація супроводжувалась менш істотним зростанням рівня ГЦ, ніж мутація в локусі 677. Порівняно з носіями гомозиготного генотипу А1298А у хворих, які мали один алель С, ризик розвитку СПКЯ був у 5,7 раза вищим, а за наявності двох алелів С зростав у 7,3 раза. Генотипи MTRR А66А та A66G супроводжувались істотним підвищенням рівня ГЦ при порівнянні з показником контрольної групи та поєднувались зі збільшенням ризику виникнення СПКЯ. Мутантний гомозиготний генотип G66G частіше зустрічався в контрольній групі та не мав значного впливу на рівень ГЦ. Не доведено, що ген MTR є геном-кандидатом розвитку СПКЯ, а його поліморфні варіанти мають негативний вплив на рівень ГЦ. Поєднання мутаційних варіантів генів MTHFR С677Т та А1298С, MTHFR С677Т та MTR А2756G, MTR А2756G та MTRR А66G асоціюються з більш високими показниками ГЦ та шансу розвитку СПКЯ порівняно з будь-якою окремою мономутацією. Висновки. Поліморфізм гена MTHFR та синергічний ефект мутацій генів MTHFR, MTR, MTRR можуть бути важливими генетичними детермінантами рівня ГЦ та ризику виникнення СПКЯ.
Background. Polycystic ovary syndrome (PCOS) is a multifactorial disease in the development of which gene polymorphism plays an important role. In recent years, data on the role of homocysteine (Hcy) in the formation of PCOS have appeared, and hyperhomocysteinemia is even considered one of the main symptoms of this disease. The causes of an impaired Hcy metabolism are varied and mainly depend on the condition of the genes encoding enzymes of the folate cycle. At the same time, available data on the effect of the 5,10-methylenetetrahydrofolate reductase (MTHFR), methionine synthase (MTR), and methionine synthase reductase (MTRR) gene polymorphisms on the development of hyperhomocysteinemia and the risk of PCOS are few and contradictory. The purpose of the study was to investigate the polymorphisms of the main genes encoding enzymes of the folate cycle (MTHFR, MTR, MTRR) and to reveal their relationship with the level of Hcy in PCOS. Material and methods. One hundred and twenty-nine women aged 20–28 years were examined: the main group — 98 patients with PCOS, the control group — 31 healthy women. The serum content of Hcy was evaluated and a molecular genetic study was conducted to identify the MTHFR, MTR, and MTRR genes. Results. Polymorphic variants of genes involved in folate metabolism were found in both patients with PCOS and in healthy women. However, serum concentration of Hcy was significantly higher in PCOS. Analysis of the MTHFR C677T polymorphism gene showed that the presence of the mutant T allele was associated with an increased Hcy level (12.9 ± 0.2 μmol/l) and the risk of PCOS (odds ratio (OR) = 1.19; 95% confidence interval (CI) 0.52–2.71). In the presence of two T alleles, the level of Hcy (14.6 ± 0.3 µmol/L) and the risk of developing PCOS (OR = 7.69; 95% CI 0.98–59.87) increased even further compared to the functionally “normal” C677C genotype. There was also an association between the MTHFR gene polymorphism at locus 1298 and PCOS whose strength depended on the number of pathological C alleles and was mediated by Hcy content, although this mutation was accompanied by a less significant increase in the level of Hcy than the mutation at locus 677. Compared to carriers of the homozygous A1298A genotype, the risk of developing PCOS was 5.7 times higher in patients with one C allele, and 7.3 times higher in the presence of two C alleles. The MTRR A66A and A66G genotypes were associated with a significant increase in the level of Hcy compared to that of the control group and were associated with an increased risk of PCOS. The mutant homozygous G66G genotype was more common in the control group and had no significant effect on Hcy concentration. It is not proved that the MTR gene is a candidate gene for the development of PCOS, and its polymorphic variants have a negative effect on the level of Hcy. The combination of MTHFR C677T and A1298C, MTHFR C677T and MTR A2756G, MTR A2756G and MTRR A66G gene mutations are associated with a greater increase in Hcy and the risk of developing PCOS compared to any individual monomutation. Conclusions. The MTHFR gene polymorphism and the synergistic effect of the MTHFR, MTR, MTRR gene mutations can be important genetic determinants for homocysteine levels and the risk of PCOS.
синдромом полікістозних яєчників; гомоцистеїн; гени MTHFR; MTR; MTRR
polycystic ovary syndrome; homocysteine; MTHFR genes; MTR; MTRR
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Aversa A., La Vignera S., Rago R., Gambineri A., Nappi R.E., Calogero A.E., Ferlin A. Fundamental Concepts and Novel Aspects of Polycystic Ovarian Syndrome: Expert Consensus Resolutions. Front. Endocrinol. (Lausanne). 2020 Aug 11. 11. 516. doi: 10.3389/fendo.2020.00516. PMID: 32849300; PMCID: PMC7431619.
- Zhu T., Goodarzi M.O. Causes and consequences of polycystic ovary syndrome: insights from Mendelian randomization. J. Clin. Endocrinol. Metab. 2021. 107(3). e899–e911. doi: 10.1210/clinem/dgab757.
- Hiam M.-A., Laven T. The genetics of polycystic ovary syndrome: an overview of candidate gene systematic reviews and genome-wide association studies. J. Clin. Med. 2019. 8(10). 1606. doi: 10.3390/jcm8101606.
- Maharjan P., Hong P. The Effects of Plasma Homocysteine in PCOS Women: A Review. Open Journal of Obstetrics and Gynecology. 2018. 8. 39-50. doi: 10.4236/ojog.2018.81005.
- Bhushan R., Sinha P. Correlation of Serum Homocysteine Levels and Hyperinsulinaemia with Body Mass Index in Polycystic Ovarian Syndrome. J. Hum. Reprod. Sci. 2022. 15(1). 34-41. doi: 10.4103/jhrs.jhrs_147_21.
- Kamyshna I., Pavlovych L., Pankiv I., Pankiv V., Maslyanko V., Bytsko N., Kamyshnyi A. The complex influence of the combination of the BDNF (rs6265), VDR (rs2228570), and NMDA (rs4880213) genotypes on the development of cognitive disorders in patients with autoimmune thyroiditis and hypothyroidism. International Journal of Endocrinology (Ukraine). 2023. 19(1). 9-15. https://doi.org/10.22141/2224-0721.19.1.2023.1235.
- Fouani F.Z., Fadaei R., Moradi N., et al. Circulating levels of Meteonin-like protein in polycystic ovary syndrome: a case-control study. PLоS One. 2020. 15(4). e231943. doi: 10.1371/journal.pone.0231943.
- Portillo F., Vázquez J., Pajares M.A. Protein-protein interactions involving enzymes of the mammalian methionine and homocysteine metabolism. Biochimie. 2020. 173. 33-47. doi: 10.1016/j.biochi.2020.02.015.
- Kako K., Kim J.D., Fukamizu A. Emerging impacts of biological methylation on genetic information. Journal of Biochemistry. 2019. 165(1). 9-18. doi.org/10.1093/jb/mvy075.
- Perła-Kaján J., Jakubowski H. Dysregulation of Epigenetic Mechanisms of Gene Expression in the Pathologies of Hyperhomocystei–nemia. Int. J. Mol. Sci. 2019. 20(13). 3140. doi: 10.3390/ijms20133140.
- Xiong Y., Bian C., Lin X., et al. Methylenetetrahydrofolate reductase gene polymorphisms in the risk of polycystic ovary syndrome and ovarian cancer. Biosci. Rep. 2020. 40(7). BSR20200995. doi: 10.1042/BSR20200995.
- Zhu X., Hong X., Chen L., et al. Association of methylenetetrahydrofolate reductase C677T and A1298C polymorphisms with genetic susceptibility to polycystic ovary syndrome: A PRISMA-compliant meta-–analysis. Gene. 2019. 719. 144079. doi: 10.1016/j.gene.2019.144079.
- Ożegowska K., Bogacz A., Bartkowiak-Wieczorek J., et al. Is there an association between the development of metabolic syndrome in PCOS patients and the C677T MTHFR gene polymorphism? Ginekol. Pol. 2016. 87(4). 246-53. doi: 10.17772/gp/61751.
- Feng W., Zhang Y., Pan Y., et al. Association of three missense mutations in the homocysteine-related MTHFR and MTRR gene with risk of polycystic ovary syndrome in Southern Chinese women. Reprod. Biol. Endocrinol. 2021. 19. 5. doi: 10.1186/s12958-020-00688-8.
- Jiao X., Chen W., Zhang J., et al. Variant alleles of the ESR1, PPARG, HMGA2, and MTHFR genes are associated with polycystic ovary syndrome risk in a Chinese population: a case-control study. Front. Endocrinol. 2018. 9. 504. doi.org/10.3389/fendo.2018.00504.
- Yuan X., Wang T., Gao J., et al. Associations of homocysteine status and homocysteine metabolism enzyme polymorphisms with hypertension and dyslipidemia in a Chinese hypertensive population. Clin. Exp. Hypertens. 2020. 42(1). 52-60. doi: 10.1080/10641963.2019.1571599.
- Talwar S., Prasad S., Kaur L., et al. MTR, MTRR and CBS Gene Polymorphisms in Recurrent Miscarriages: A Case Control Study from North India. J. Hum. Reprod. Sci. 2022. 15(2). 191-196. doi: 10.4103/jhrs.jhrs_186_21.
- Azzini E., Ruggeri S., Polito A. Homocysteine: Its possible emerging role in at-risk population groups. Int. J. Mol. Sciences. 2020. 21(4). 1421. doi: 10.3390/ijms21041421.
- The Rotterdam ESHRE/ASRM — sponsored PCOS consensus workshop group. Revised 2003 consensus on diagnostic criteriaand long-term health risks related to polycystic ovary syndrome (PCOS). Hum. Reprod. 2004. 19(1). 41-47.
- Santos Т.В., Paula Н.К., Spadotto Balarin M.A., et al. Can the genetic polymorphisms of the folate metabolism have an influence in the polycystic ovary syndrome? Arch. Endocrinol. Metab. 2019. 63(5). 501-508. doi: 10.20945/2359-3997000000167.
- Li Y., Zhu H., Liu M., et al. Significant association between methylenetetrahydrofolate reductase gene C677T polymorphism with polycystic ovary syndrome risk: A meta-analysis update. Medicine (Baltimore). 2020. 99(4). e18720. doi: 10.1097/MD.0000000000018720.
- Lei L., Ding L., Su J., Liu M., et al. Attenuated expression of MTR in both prenatally androgenized mice and women with the hyperandrogenic phenotype of PCOS. PLoS One. 2017. 12(12). e0187427. doi: 10.1371/journal.pone.0187427.
- Grechanina E., Lesovoy V., Myasoedov V., Grechanina Yu., Gusar V. Regular relationship between the development of some epigenetic diseases and impaired DNA methylation due to deficiency of folate cycle enzymes. Ultrasonic Perinatal Diagnostics. 2010. 29. 27-59. (in Russian).