Международный эндокринологический журнал Том 19, №7, 2023
Вернуться к номеру
Вплив інкретиноміметиків на рівень мікробіального метаболіта триметиламін-N-оксиду — маркера серцево-судинного ризику у хворих на цукровий діабет 2-го типу
Авторы: Шишкань-Шишова К.О., Зінич О.В., Кушнарьова Н.М., Ковальчук А.В., Прибила О.В.
ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
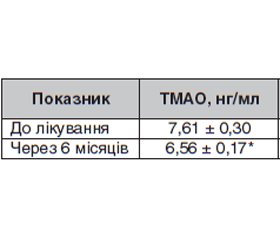
Мета: дослідити взаємозв’язок рівнів мікробіального метаболіта кишкового мікробіому триметиламін-N-оксиду (ТМАО) у сироватці крові з клініко-лабораторними показниками та параметрами композиції тіла у пацієнтів з цукровим діабетом типу 2 (ЦД2) під впливом інкретинотерапії, що призначалась додатково до попереднього лікування. Матеріали та методи. Обстежено 33 хворі на ЦД2 (17 жінок і 16 чоловіків), віком від 31 до 72 років, що мали незадовільний контроль вуглеводного обміну на тлі попередньої цукрознижувальної терапії (метформін, похідні сульфонілсечовини, інсулін, гліфлозини), яким призначали агоніст рецептора глюкагоноподібного пептиду-1 (арГПП-1). До початку лікування та через 6 місяців терапії визначали параметри антропометрії, композиції тіла (методом біоелектричного імпедансу за допомогою аналізатора Tanita); рівні в крові глюкози та глікованого гемоглобіну (HbA1c), концентрацію TMAO, показники ліпідного спектра крові. Результати. Обстежені пацієнти мали рівень HbA1c > 7,4 %; 91 % мали ожиріння (ІМТ 34,70 ± 6,60 кг/м2), 100 % — абдомінальне ожиріння (ОТ 118,00 ± 11,24 см, Med ± SD). У 72 % випадків пацієнти мали в анамнезі серцево-судинні ускладнення (інфаркт міокарда, інсульт, встановлений коронарний та периферичний атеросклероз, стеноз артерій). Під впливом терапії інкретиноміметиками спостерігалось зменшення ступеня загального та абдомінального ожиріння, вірогідне зменшення відсотка жиру та рівня вісцерального жиру (ВЖ), що супроводжувалось підвищенням гідратації, зниженням тригліцеридемії та концентрації холестерину ліпопротеїнів дуже низької щільності (ХС ЛПДНЩ). У пацієнтів зафіксовано вірогідне зниження концентрації мікробіального метаболіта ТМАО в сироватці крові, що може бути відображенням механізмів антиатерогенного ефекту арГПП-1, пов’язаних з контролем метаболізму холестерину і жовчних кислот, стимулюванням рецепторів ХС ЛПДНЩ та впливом на секрецію інсуліну, глюкагону, греліну, лептину, інкретинів. Висновки. Дослідження клінічних ефектів інкретиноміметика (арГПП-1) у пацієнтів з ЦД2 підтвердило його позитивний вплив на метаболізм глюкози та ліпідний спектр. При цьому при терапії арГПП-1 зафіксовано поліпшення деяких композиційних та ліпідних показників (ІМТ, ОТ, ВЖ, ТГ, ХС ЛПДНЩ) при одночасному зниженні концентрації токсичного метаболіта ТМАО.
Background. The purpose was to investigate the effect of therapy with glucagon-like peptide-1 receptor agonists (GLP-1ra) on the serum concentration of trimethylamine-N-oxide (TMAO), an intestinal microbiome metabolite, in patients with type 2 diabetes mellitus (T2DM) in relation to clinical and laboratory indicators and parameters of body composition. Materials and methods. Thirty-three T2DM patients (17 women and 16 men) were examined aged 31 to 72 years who had unsatisfactory control of carbohydrate metabolism (HbA1c > 7.4 %) against the background of previous glucose-lowering therapy (metformin, sulfonylurea derivatives, insulin, gliflozin) and were administered GLP-1ra. Before the start of treatment and after 6 months of therapy, parameters of anthropometry, body composition were measured (using the bioelectrical impedance analysis with the Tanita analyzer); blood glucose and glycated hemoglobin, TMAO concentration, blood lipids were assessed. Results. Patients diagnosed with Т2DM had HbA1c > 7.4 %; 91 % had general obesity (body mass index 34.7 ± 6.6 kg/m2), 100 % had abdominal obesity (waist circumference 118.00 ± 11.24 cm, Med ± SD). In 72 % of cases, there was a history of cardiovascular complications (myocardial infarction, stroke, coronary and peripheral atherosclerosis, arterial stenosis). Under the influence of a 6-month administration of GLP1ra, there was a decrease in the degree of total and abdominal obesity, a significant drop in the percentage of fat and the level of visceral fat, which was accompanied by an increase in hydration, a reduction in triglyceridemia and the concentration of very-low-density lipoprotein cholesterol (VLDL-C). A significant decrease in the level of TMAO microbial metabolite in the blood serum was recorded, which may reflect the antiatherogenic effect of GLP1ra, associated with the control of cholesterol and bile acid metabolism, the stimulation of VLDL-C receptors, and the effect on the secretion of insulin, glucagon, ghrelin, leptin, incretins. Conclusions. A study on the clinical effects of the incretin mimetic (GLP-1ra) in patients with T2DM confirmed its positive impact on glucose metabolism and blood lipids. At the same time, during GLP-1ra therapy, an improvement of some compositional and lipid indicators (visceral fat, triglycerides, VLDL-C) was recorded with a simultaneous decrease in the concentration of TMAO toxic metabolite.
агоніст рецептора глюкагоноподібного пептиду-1; триметиламін-N-оксид; композиція тіла; ліпідний спектр сироватки крові; цукровий діабет 2-го типу
glucagon-like peptide-1 receptor agonist; trimethylamine-N-oxide; body composition; blood lipids; type 2 diabetes mellitus
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Nauck M.A., Quast D.R., Wefers J., Meier J.J. GLP-1 receptor agonists in the treatment of type 2 diabetes — state-of-the-art. Molecular Metabolism. 2021. 46. 101102. doi: 10.1016/j.molmet.2020.101102.
- Drucker D.J. Mechanisms of Action and Therapeutic Application of Glucagon-Like Peptide-1. Cell Metab. 2018. 27(4). 740-756. doi: 10.1016/j.cmet.2018.03.001.
- Samson S.L., Vellanki P., Blonde L., Christofides E.A., Galindo R.J., Hirsch I.B., еt al. American Association of Clinical Endocrinology Consensus Statement: Comprehensive Type 2 Diabetes Management Algorithm — 2023 Update. Endocrine Рractice. 2023. 29(5). 305-340. doi: 10.1016/j.eprac.2023.02.001.
- Mata-Cases M., Franch-Nadal J., Ortega E., Real J., Grata–còs M., Vlacho B., Mauricio D. Glucagon-like peptide-1 receptor agonists in patients with type 2 diabetes: real-world evidence from a Mediterranean area. Current Medical Research аnd Opinion. 2019. 35(10). 1735-1744. doi: 10.1080/03007995.2019.1618806.
- Falalyeyeva T., Mamula Y., Scarpellini E., Leshchenko I., Humeniuk A., Pankiv I., Kobyliak N. Probiotics and obesity associated disease: an extended view beyond traditional strains. Minerva Gastroenterol (Torino). 2021 Dec. 67(4). 348-356. doi: 10.23736/S2724-5985.21.02909-0. PMID: 35040301.
- Elbere I., Silamikelis I., Dindune I.I., Kalnina I., Ustinova M., Zaharenko L., еt al. Baseline gut microbiome composition predicts metformin therapy short-term efficacy in newly diagnosed type 2 diabetes patients. PloS Оne. 2020. 15(10). e0241338. doi: 10.1371/journal.pone.0241338.
- Tsai C.Y., Lu H.C., Chou Y.H., Liu P.Y., Chen H.Y., Huang M.C., еt al. Gut Microbial Signatures for Glycemic Respon–ses of GLP-1 Receptor Agonists in Type 2 Diabetic Patients: A Pilot Study. Frontiers in Еndocrinology. 2022. 12. 814770. doi: 10.3389/fendo.2021.814770.
- Madsen M.S.A., Holm J.B., Pallejà A., Wismann P., Fabricius K., Rigbolt K., et al. Metabolic and gut microbiome changes following GLP-1 or dual GLP-1/GLP-2 receptor agonist treatment in diet-induced obese mice. Sci. Rep. 2019. 9(1). 15582. doi: 10.1038/s41598-019-52103-x.
- Martin-Gallausiaux C., Marinelli L., Hervé M. Blottière, Larraufie P., Lapaque N. SCFA: mechanisms and functional importance in the gut. Proc. Nutr. Soc. 2021. 80(1). 37-49. doi: 10.1017/S0029665120006916.
- Zhang X., Gérard P. Diet-gut microbiota interactions on cardiovascular disease. Comput. Struct. Biotechnol. J. 2022. 20. 1528-1540. doi: 10.1016/j.csbj.2022.03.028.
- Ma Q., Li Y., Li P., Wang M., Wang J., Tang Z., et al. Research progress in the relationship between type 2 diabetes mellitus and intestinal flora. Biomed. Рharmacother. 2019. 117. 109138. doi: 10.1016/j.biopha.2019.109138.
- Shyshkan-Shyshova K., Zinych O., Kushnareva N., Кoval–chuk A., Prybyla O. Effect of probiotics and incretine mimeticss on the levels of glucagon-like peptide-1 in blood serum of patients with type 2 diabetes mellitus. International Journal оf Endocrinology (Ukraine). 2021. 17(8). 604-612. https://doi.org/10.22141/2224-0721.17.8.2021.246792.
- Naghipour S., Cox A.J., Peart J.N., Du Toit E.F., Headrick J.P. Trimethylamine N-oxide: heart of the microbiota-CVD nexus? Nutr. Res. Rev. 2021. 34(1). 125-146. doi: 10.1017/S0954422420000177.
- He M., Tan C.P., Xu Y.J., Liu Y. Gut microbiota-derived trimethylamine-N-oxide: A bridge between dietary fatty acid and cardiovascular disease? Food Res. Int. 2020. 138(Pt B). 109812. doi: 10.1016/j.foodres.2020.109812.
- Chen H., Li J., Li N., Liu H., Tang J. Increased circulating trimethylamine N-oxide plays a contributory role in the development of endothelial dysfunction and hypertension in the RUPP rat model of preeclampsia. Hypertens. Pregnancy. 2019. 38(2). 96-104. doi: 10.1080/10641955.2019.1584630.
- Abbasian N. Vascular Calcification Mechanisms: Updates and Renewed Insight into Signaling Pathways Involved in High Phosphate-Mediated Vascular Smooth Muscle Cell Calcification. Biomedi–cines. 2021. 9(7). 804. doi: 10.3390/biomedicines9070804.
- Zhu W., Gregory J.C., Org E., Buffa J.A., Gupta N., Wang Z., еt al. Gut Microbial Metabolite TMAO Enhances Platelet Hyperreactivity and Thrombosis Risk. Cell. 2016. 165(1). 111-124. doi: 10.1016/j.cell.2016.02.011.
- Schiattarella G.G., Sannino A., Toscano E., Giugliano G., Gargiulo G., Franzone A., еt al. Gut microbe-generated metabolite trimethylamine-N-oxide as cardiovascular risk biomarker: a systematic review and dose-response meta-analysis. Eur. Heart J. 2017. 38(39). 2948-2956. doi: 10.1093/eurheartj/ehx342.
- Li S., Li S., Ding J., Zhou W. Visceral fat area and body fat percentage measured by bioelectrical impedance analysis correlate with glycometabolism. BMC Endocrine Disorders. 2022. 22(1). 231. https://doi.org/10.1186/s12902-022-01142-z.
- Pankiv V. Influence of ursodeoxycholic acid on insulin resistance in patients with metabolic syndrome. International Journal оf Endocrinology (Ukraine). 2018. 14(3). 263-267. https://doi.org/10.22141/2224-0721.14.3.2018.136424.
- Korpacheva-Zinych O., Kushnariova N., Kovalchuk A., Prybila O., Shyshkan-Shyshova K., Huryna N., Korpachev V. In Tune with the World Trends: Clinical Aspects of Liraglutide Use in Combination with Insulin in Patients with Diabetes Mellitus (Literature Review and Clinical Observations). International Journal оf Endocrinology (Ukraine). 2021. 7. 35-43. https://doi.org/10.22141/2224-0721.7.79.2016.86417.