Международный эндокринологический журнал Том 19, №7, 2023
Вернуться к номеру
Аналіз поліморфізму та експресії гена селенопротеїну Р SEPP1 (rs7579) у хворих на хронічний панкреатит, поєднаний із гіпотиреозом
Авторы: Раца В.В. (1), Федів О.І. (1), Сидорчук Л.П. (1), Россоха З.І. (2), Сидорчук О.І. (3), Степан В.Т. (4), Буздуган І.О. (1)
(1) — Буковинський державний медичний університет, м. Чернівці, Україна
(2) — Державний заклад «Референс-центр з молекулярної діагностики МОЗ України», м. Київ, Україна
(3) — Національний медичний університет ім. О.О. Богомольця, м. Київ, Україна
(4) — Чернівецький національний університет ім. Юрія Федьковича, м. Чернівці, Україна
Рубрики: Эндокринология
Разделы: Клинические исследования
Версия для печати
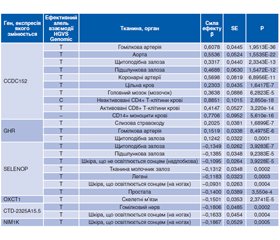
Актуальність. Натепер не з’ясовані конкретна роль і місце генетичних факторів у розвитку хронічного панкреатиту та гіпотиреозу, які визначають активність глутатіонового антиоксидантного захисту, взаємопов’язані зі змінами метаболізму жирів та вуглеводів, а також впливають на транспорт та сигнальні шляхи ключових поживних речовин для роботи імунної, ендокринної і нервової систем. Мета: вивчити поліморфізм та експресію гена селенопротеїну Р SEPP1 (rs7579) у хворих на хронічний панкреатит, поєднаний із гіпотиреозом. Матеріали та методи. Етап скринінгу пройшли 49 пацієнтів з хронічним панкреатитом у поєднанні з гіпотиреозом та 30 практично здорових осіб. Поліморфізм гена селенопротеїну Р SEPP1 (rs7579) визначали методом полімеразної ланцюгової реакції. Результати. Проведене дослідження показало, що із 98 виділених алелей у пацієнтів із хронічним панкреатитом у поєднанні з гіпотиреозом та 60 алелей групи контролю домінував G-алель гена SEPP1 (rs7579, 25191G/A) над A-алелем: у хворих — на 34,7 % (χ2 = 23,59; р < 0,001), у групі практично здорових — на 53,34 % (χ2 = 34,13; р < 0,001). При цьому відносна частота окремих генотипів, а також дикого і мутаційного алелей між дослідною і контрольною групами вірогідно не відрізнялась. А-алель гена SEPP1 (rs7579) незначно підвищує ризик появи хронічного панкреатиту в обстеженій популяції, однак невірогідно [RR = 1,43; RR 95% CI: 0,91–2,26; OR = 1,65; OR 95% CI: 0,88–3,08; p = 0,115]. Висновки. Мутація гена SEPP1 (rs7579, 25191G/A) у хворих на хронічний панкреатит, мешканців Північної Буковини, у гомозиготному стані трапляється з частотою 10,2 % за відсутності такої у практично здорових осіб. В обох групах домінує G-алель над A-алелем: у хворих — на 34,7 % (χ2 = 23,59; р < 0,001), у контролі — на 53,34 % (χ2 = 34,13; р < 0,001). Поліморфізм гена SEPP1 (rs7579, 25191G/A) не визначає ризик появи хронічного панкреатиту у популяції. Однак А-алель підвищує ймовірність гіпотиреозу у хворих на хронічний панкреатит удвічі [OR = 2,0; OR 95% CI: 1,09–3,66; р = 0,023], за найнижчих шансів на його появу у власників G-алеля [OR = 0,50; OR 95% CI: 0,27–0,91; р = 0,023]. Картографування локусів кількісних ознак експресії eQTL по обидва боки від сайту початку транскрипції гена SEPP1 (rs7579) засвідчує 152 статистично значимі цис-варіанти асоціацій rs7579 гена SEPP1 (SELENOP) із експресією 20 генів у 35 різних органах і тканинах та 22 фенотипові ознаки.
Background. The specific role and place of genetic factors in the development of chronic pancreatitis and hypothyroidism, which determine the activity of glutathione antioxidant protection, have not been clarified. They are interconnected with changes in the fat and carbohydrate metabolism, and also affect the transport and signaling pathways of key nutrients for the work of the immune, endocrine and nervous systems. The purpose of the study is to investigate the selenoprotein P (SEPP1) (rs7579) gene polymorphism and expression in patients with chronic pancreatitis combined with hypothyroidism. Materials and methods. Forty-nine patients with chronic pancreatitis and hypothyroidism and 30 practically healthy individuals passed the screening stage. The SEPP1 (rs7579) gene polymorphism was determined by the polymerase chain reaction. Results. The study showed that out of 98 isolated alleles in patients with chronic pancreatitis and hypothyroidism and 60 alleles of the control group, the G allele of the SEPP1 gene (rs7579, 25191G/A) dominated over the A allele: in the examined patients — by 34.7 % (χ2 = 23.59; p < 0.001), in the practically healthy group — by 53.34 % (χ2 = 34.13; p < 0.001). At the same time, the relative frequency of individual genotypes, as well as wild-type and mutant alleles, probably did not differ between the experimental and control groups. The A allele of the SEPP1 gene (rs7579) slightly increases the risk of chronic pancreatitis in the studied population, but non-significantly [risk ratio (RR) = 1.43; RR 95% CI (confidence interval): 0.91–2.26; odds ratio (OR) = 1.65; OR 95% CI: 0.88–3.08; p = 0.115]. Conclusions. In patients with chronic pancreatitis who are residents of Northern Bukovyna, mutation of the SEPP1 gene (rs7579, 25191G/A) in the homozygous state occurs with a frequency of 10.2 %, while it is absent in practically healthy people. In both groups, the G allele dominates over the A allele: in the examined patients — by 34.7 % (χ2 = 23.59; p < 0.001), in controls — by 53.34 % (χ2 = 34.13; p < 0.001). SEPP1 gene polymorphism (rs7579, 25191G/A) does not determine the risk of chronic pancreatitis in the population. However, the A allele increases the risk of hypothyroidism in chronic pancreatitis patients twice [OR = 2.0; OR 95% CI: 1.09–3.66; p = 0.023], with the lowest chances of its appearance in carriers of the G allele [OR = 0.50; OR 95% CI: 0.27–0.91; p = 0.023]. Mapping of the expression quantitative trait loci on both sides of the SEPP1 gene (rs7579) transcription start site evidenced 152 statistically significant cis-variants of rs7579 of the SEPP1 gene (SELENOP) associations with the expression of 20 genes in 35 different organs and tissues and 22 phenotypic traits.
хронічний панкреатит; гіпотиреоз; поліморфізм гена селенопротеїну P SEPP1 (rs7579); експресія гена селенопротеїну P SEPP1 (rs7579)
chronic pancreatitis; hypothyroidism; selenoprotein P (rs7579) gene polymorphism; selenoprotein P (rs7579) gene expression
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Szatmary P., Grammatikopoulos T., Cai W., Huang W., Mukherjee R., Halloran C., Beyer G., Sutton R. Acute Pancreatitis: Diagnosis and Treatment. Drugs. 2022 Aug. 82(12). 1251-1276. doi: 10.1007/s40265-022-01766-4. Epub 2022 Sep 8. PMID: 36074322; PMCID: PMC9454414.
- Löhr J.M., Dominguez-Munoz E., Rosendahl J., Besselink M., Mayerle J., Lerch M.M., Haas S. et al. UEG Working Group. United European Gastroenterology evidence-based guidelines for the diagnosis and therapy of chronic pancreatitis (HaPanEU). United European Gastroenterol. J. 2017. 5(2). 153-199. doi: 10.1177/2050640616684695.
- Kyriacou A., McLaughlin J., Syed A.A. Thyroid disorders and gastrointestinal and liver dysfunction: A state of the art review. Eur. J. Intern. Med. 2015 Oct. 26(8). 563-71. doi: 10.1016/j.ejim.2015.07.017. Epub 2015 Aug 8. PMID: 26260744.
- Xu Y.W., Li R., Xu S.C. Hypothyroidism with elevated pancreatic amylase and lipase without clinical symptoms: A case report. World J. Clin. Cases. 2020 Aug 6. 8(15). 3299-3304. doi: 10.12998/wjcc.v8.i15.3299. PMID: 32874985; PMCID: PMC7441259.
- Khomenko L., Dvoiashkina Y. Influence of thyroid hormones on motor-secretory function in patients with GERD and concomitant hypothyroidism. Terapevtyka. 2021. 2(2). 56-60. https://doi.org/10.31793/2709-7404.2021.2-2.56.
- Shimizu K., Ito T., Irisawa A., Ohtsuka T., Ohara H., Kanno A., Kida M., et al. Evidence-based clinical practice guidelines for chronic pancreatitis 2021. J. Gastroenterol. 2022 Oct. 57(10). 709-724. doi: 10.1007/s00535-022-01911-6. Epub 2022 Aug 22. PMID: 35994093; PMCID: PMC9522716.
- Pankiv I. The impact of vitamin D status and supplementation on thyroid autoimmunity. International Journal оf Endocrinology (Ukraine). 2020. 16(8). 681-685. https://doi.org/10.22141/2224-0721.16.8.2020.222889.
- Masamune A., Kikuta K., Kume K., Hamada S., Tsuji I., Takeyama Y., Shimosegawa T., Okazaki K.; Japan Pancreas Society. Nationwide epidemiological survey of chronic pancreatitis in Japan: introduction and validation of the new Japanese diagnostic criteria 2019. J. Gastroenterol. 2020 Nov. 55(11). 1062-1071. doi: 10.1007/s00535-020-01704-9. Epub 2020 Jul 16. PMID: 32676800.
- Ivashchuk S.I., Sydorchuk L.P. The parameters of liver functional state as a risk factor of edematous pancreatitis development providing of genetic determination of Il-4 production. Wiad Lek. 2019. 72(4). 639-644. PMID: 31055548.
- Midha S., Sreenivas V., Kabra M., Chattopadhyay T.K., Joshi Y.K., Garg P.K. Genetically Determined Chronic Pancreatitis but not Alcoholic Pancreatitis Is a Strong Risk Factor for Pancrea–tic Cancer. Pancreas. 2016 Nov. 45(10). 1478-1484. doi: 10.1097/MPA.0000000000000684. PMID: 27518468.
- Kandikattu H.K., Venkateshaiah S.U., Mishra A. Chro–nic Pancreatitis and the Development of Pancreatic Cancer. Endocr. Metab. Immune Disord. Drug Targets. 2020. 20(8). 1182-1210. doi: 10.2174/1871530320666200423095700. PMID: 32324526; PMCID: PMC7577953.
- Jia Y., Nima C., Yang L., Wang L., Wei B., Li Y., Li H. et al. Selenium and Zinc Intakes of Staple Grains and Their Correlation with Urine Selenium and Zinc in the Tibetan Rural Residents along the Yarlung Zangbo River. Nutrients. 2023 Apr 21. 15(8). 2010. doi: 10.3390/nu15082010. PMID: 37111228; PMCID: PMC10143032.
- Tangjaidee P., Swedlund P., Xiang J., Yin H., Quek S.Y. Selenium-enriched plant foods: Selenium accumulation, speciation, and health functionality. Front. Nutr. 2023 Feb 6. 9. 962312. doi: 10.3389/fnut.2022.962312. PMID: 36815133; PMCID: PMC9939470.
- Cooper M.L., Adami H.O., Grönberg H., Wiklund F., Green F.R., Rayman M.P. Interaction between single nucleotide polymorphisms in selenoprotein P and mitochondrial superoxide dismutase determines prostate cancer risk. Cancer Res. 2008 Dec 15. 68(24). 10171-7. doi: 10.1158/0008-5472.CAN-08-1827. PMID: 19074884; PMCID: PMC2800981.
- Steinbrecher A., Méplan C., Hesketh J., Schomburg L., Endermann T., Jansen E., Akesson B., et al. Effects of selenium status and polymorphisms in selenoprotein genes on prostate cancer risk in a prospective study of European men. Cancer Epidemiol. Biomarkers Prev. 2010 Nov. 19(11). 2958-68. doi: 10.1158/1055-9965.EPI-10-0364. Epub 2010 Sep 17. PMID: 20852007.
- Pankiv V. Problem of Combined Selenium and Iodine Deficiency in the Development of Thyroid Pathology. International Journal оf Endocrinology (Ukraine). 2014. 5(61). 75-80. https://doi.org/10.22141/2224-0721.5.61.2014.76859.
- Kravchenko V.I., Grossman A.B., Rakov O.V., Kovzun O.I., Pankiv V.I., Simurov O.V. Selenium supply and thyroid condition in Graves’ disease in the region of iodine deficiency. Problems of Endocrine Pathology. 2021. 75(1). 26-33. https://doi.org/10.21856/j-PEP.2021.1.04.
- Hill K.E., Zhou J., McMahan W.J., Motley A.K., Atkins J.F., Gesteland R.F., Burk R.F. Deletion of selenoprotein P alters distribution of selenium in the mouse. J. Biol. Chem. 2003 Apr 18. 278(16). 13640-6. doi: 10.1074/jbc.M300755200. Epub 2003 Feb 6. PMID: 12574155.
- Bosschaerts T., Guilliams M., Noel W., Hérin M., Burk R.F., Hill K.E., Brys L., et al. Alternatively activated myeloid cells limit pathogenicity associated with African trypanosomiasis through the IL-10 inducible gene selenoprotein P. J. Immunol. 2008 May 1. 180(9). 6168-75. doi: 10.4049/jimmunol.180.9.6168. PMID: 18424738.
- Brown K.M., Arthur J.R. Selenium, selenoproteins and human health: a review. Public Health Nutr. 2001 Apr. 4(2B). 593-9. doi: 10.1079/phn2001143. PMID: 11683552.
- Xiong Y.M., Mo X.Y., Zou X.Z., Song R.X., Sun W.Y., Lu W., Chen Q., Yu Y.X., Zang W.J. Association study between polymorphisms in selenoprotein genes and susceptibility to Kashin-Beck di–sease. Osteoarthritis Cartilage. 2010 Jun. 18(6). 817-24. doi: 10.1016/j.joca.2010.02.004. Epub 2010 Feb 21. PMID: 20178852.
- Amini G., Salehi R., Moshtaghi A.A., Kazemi M., Behjati M., Khosravi S. Evaluation of SEPP1 and Selenoprotein S Gene Polymorphisms (rs7579 and rs34713741) in Relation to Colorectal Cancer Susceptibility in Subset of Iranian Population: A Case-control Study. Adv. Biomed. Res. 2019. 8. 47. doi: 10.4103/abr.abr_249_18.
- Simonian M., Mosallayi M., Miraghajani M., Feizi A., Khosravi S., Salehi A.R., Mortazavi D., et al. Single nucleotide polymorphism rs696 in miR449a binding site of NFKBIA gene is correlated with risk of colorectal cancer. Gastroenterol. Hepatol. Bed. Bench. 2018. 11(1). 48-53. PMID: 29564065; PMCID: PMC5849118.