Журнал «Здоровье ребенка» Том 18, №5, 2023
Вернуться к номеру
Роль мікроРНК у розвитку холангіопатій. Частина 2
Авторы: Абатуров О.Є., Бабич В.Л.
Дніпровський державний медичний університет, м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
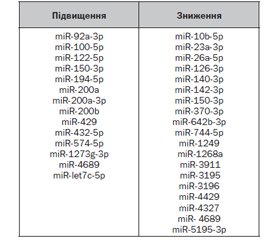
У науковому огляді висвітлено роль мікроРНК у розвитку холангіопатій. У цій статті розглянуто роль мікроРНК при атрезії жовчних шляхів, полікістозній хворобі печінки, холангіокарциномі. Для написання статті здійснювався пошук інформації з використанням баз даних Scopus, Web of Science, MedLine, PubMed, Google Scholar, EMBASE, Global Health, The Cochrane Library. Результати експериментальних досліджень свідчать про те, що вплив мікроРНК зумовлює розвиток атрезії жовчних шляхів. Показано, що, згідно з результатами профілювання експресії мікроРНК позапечінкових жовчних проток і жовчного міхура, miR-133a/b, miR-30b/c, miR-200a, miR-195, miR-365 і miR-320 беруть участь у патогенезі атрезії жовчних шляхів. У статті зазначено, що науковці продемонстрували, що в тканині печінки хворих з атрезією жовчних шляхів спостерігається високий рівень експресії мРНК ADD3. Надекспресія ADD3 сприяє адгезії і акумуляції епітеліальних клітин у жовчних шляхах, що може призвести до обструкції жовчних проток і розвитку холестазу. У свою чергу, надлишок жовчних кислот стимулює проліферацію холангіоцитів і викликає розвиток фіброзу печінки. З огляду на те, що гіперпроліферація епітеліальних клітин жовчних проток унаслідок порушення клітинного циклу є ключовою особливістю цистогенезу при полікістозній хворобі печінки, дослідники припустили, що мікроРНК, змінюючи клітинний цикл, можуть сприяти розвитку печінкового цистогенезу. Автори показали, що полікістозна хвороба печінки супроводжується зменшенням експресії miR-15a, мішенню якої є мРНК регулятора клітинного циклу 25A (cell division cycle 25A — CDC25A). У розвитку холангіокарциноми беруть участь численні мікроРНК, зміни експресії і вмісту в сироватці крові яких було відзначено у хворих із цією формою неоплазм. Отже, у результаті всебічного огляду з використанням новітніх інформаційних пошукових баз даних встановлено, що в сучасній науковій літературі автори визначають асоціацію активності генерації мікроРНК і розвитку холангіопатій, а саме: атрезії жовчних шляхів, полікістозної хвороби печінки, холангіокарциноми.
The role of miRNA in the development of cholangiopathies is considered in the scientific review. This article discusses the role of miRNA in biliary atresia, polycystic liver disease, and cholangiocarcinoma. To write the article, information was searched using Scopus, Web of Science, MedLine, PubMed, Google Scholar, EMBASE, Global Health, The Cochrane Library databases. The results of experimental studies indicate that the influence of miRNA causes the development of biliary atresia. It is found that, according to the results of miRNA expression profiling of extrahepatic bile ducts and gallbladder, miR-133a/b, miR-30b/c, miR-200a, miR-195, miR-365 and miR-320 are involved in the pathogenesis of biliary atresia. The article states that the scientists demonstrated a high level of ADD3 mRNA expression in the liver tissue of patients with biliary atresia. ADD3 overexpression promotes the adhesion and accumulation of epithelial cells in the bile ducts, which can lead to obstruction of the bile ducts and cholestasis. In turn, an excess of bile acids stimulates the proliferation of cholangiocytes and causes the development of liver fibrosis. Given that hyperproliferation of epithelial cells of the bile ducts due to an impaired cell cycle is a key feature of cystogenesis in polycystic liver disease, researchers hypothesized that miRNAs, changing the cell cycle, may contribute to hepatic cystogenesis. The authors showed that polycystic liver disease is accompanied by a decrease in the expression of miR-15a, whose target is the mRNA of the cell division cycle 25A regulator. Numerous miRNAs are involved in the development of cholangiocarcinoma, changes in the expression and content of which in blood serum were noted in patients with this form of neoplasms. Thus, after a comprehensive review using the latest information search databases, it was found that in the modern scientific literature, the authors determine the association of micro-RNA generation activity and the development of cholangiopathies, namely: biliary atresia, polycystic liver disease, cholangiocarcinoma.
мікроРНК; холангіопатії; атрезія жовчних шляхів; полікістозна хвороба печінки; холангіокарцинома; огляд
microRNA; miRNA; miR; cholangiopathy; biliary atresia; polycystic liver disease; cholangiocarcinoma; review
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Абатуров О.Є., Бабич В.Л. Роль мікро-РНК при захворюваннях біліарної системи. Здоров’я дитини. 2017. 7(12). 155-161. DOI: 10.22141/2224-0551.12.7.2017.116191.
- Абатуров О.Є., Бабич В.Л. Світ мікроРНК гепатобіліарної системи. Здоров’я дитини. 2021. 1(16). 122-131. DOI: 10.22141/2224-0551.16.1.2021.226462.
- Abdel-Rahman W.M., Kalinina J., Shoman S. et al. Somatic FGF9 mutations in colorectal and endometrial carcinomas associated with membranous beta-catenin. Hum. Mutat. 2008 Mar. 29(3). 390-7. doi: 10.1002/humu.20653.
- Bessho K., Shanmukhappa K., Sheridan R. et al. Integrative genomics identifies candidate microRNAs for pathogenesis of experimental biliary atresia. BMC Syst. Biol. 2013 Oct 20. 7. 104. doi: 10.1186/1752-0509-7-104.
- Calvopina D.A., Coleman M.A., Lewindon P.J., Ramm G.A. Function and Regulation of MicroRNAs and Their Potential as Biomar–kers in Paediatric Liver Disease. Int. J. Mol. Sci. 2016 Oct 27. 17(11). pii: E1795. doi: 10.3390/ijms17111795.
- Chen C., Jiang J., Fang M. et al. MicroRNA-129-2-3p directly targets Wip1 to suppress the proliferation and invasion of intrahepatic cholangiocarcinoma. J. Cancer. 2020. 11(11). 3216-24. doi: 10.7150/jca.41492.
- Demarez C., Hubert C., Sempoux C., Lemaigre F.P. Expression of Molecular Differentiation Markers Does Not Correlate with Histological Differentiation Grade in Intrahepatic Cholangiocarcinoma. PLoS ONE. 2016. 11(6). e0157140. doi: 10.1371/journal.pone.0157140.
- Dong R., Shen Z., Zheng C. et al. Serum microRNA microarray analysis identifies miR-4429 and miR-4689 are potential diagnostic biomarkers for biliary atresia. Sci. Rep. 2016 Feb 16. 6. 21084. doi: 10.1038/srep21084.
- Esparza-Baquer A., Labiano I., Bujanda L., Perugorria M.J., Banales J.M. MicroRNAs in cholangiopathies: Potential diagnostic and therapeutic tools. Clinics and Research in Hepatology and Gastroentero–logy. 2016. 40(1). 15-27. doi: 10.1016/j.clinre.2015.10.001.
- Feldman A.G., Mack C.L. Biliary Atresia: Clinical Lessons Learned. J. Pediatr. Gastroenterol. Nutr. 2015 Aug. 61(2). 167-75. doi: 10.1097/MPG.0000000000000755.
- Hsu Y.A., Lin C.H., Lin H.J. et al. Effect of microRNA-155 on the interferon-gamma signaling pathway in biliary atresia. Chin. J. Physiol. 2016 Dec 31. 59(6). 315-322. doi: 10.4077/CJP.2016.BAE419.
- Jiang X.P., Ai W.B., Wan L.Y. et al. The roles of microRNA families in hepatic fibrosis. Cell. Biosci. 2017 Jul 4. 7. 34. doi: 10.1186/s13578-017-0161-7.
- Kennedy I., Francis H., Meng F. et al. Diagnostic and therapeutic potentials of microRNAs in cholangiopathies. Liver Res. 2017 Jun. 1(1). 34-41. doi: 10.1016/j.livres.2017.03.003.
- Kiang K.M., Leung G.K. A Review on Adducin from Functional to Pathological Mechanisms: Future Direction in Cancer. Biomed. Res. Int. 2018 May 16. 2018. 3465929. doi: 10.1155/2018/3465929.
- Kopycinska J., Kempińska-Podhorodecka A., Haas T. et al. Activation of FoxO3a/Bim axis in patients with Primary Biliary Cirrhosis. Liver Int. 2013 Feb. 33(2). 231-8. doi: 10.1111/liv.12030.
- Krasinskas A.M. Cholangiocarcinoma. Surg. Pathol. Clin. 2018 Jun. 11(2). 403-429. doi: 10.1016/j.path.2018.02.005.
- Lazaridis K.N., LaRusso N.F. The Cholangiopathies. Mayo Clin. Proc. 2015 Jun. 90(6). 791-800. doi: 10.1016/j.mayocp.2015.03.017.
- Lee S.O., Masyuk T., Splinter P. et al. MicroRNA15a modulates expression of the cell-cycle regulator Cdc25A and affects hepatic cystogenesis in a rat model of polycystic kidney disease. J. Clin. Invest. 2008 Nov. 118(11). 3714-24. doi: 10.1172/JCI34922.
- Li L., Masica D., Ishida M. et al. Human bile contains –microRNA-laden extracellular vesicles that can be used for cholangiocarcinoma diagnosis. Hepatology. 2014 Sep. 60(3). 896-907. doi: 10.1002/hep.27050.
- Liau N.P.D., Laktyushin A., Lucet I.S. et al. The molecular basis of JAK/STAT inhibition by SOCS1. Nat. Commun. 2018 Apr 19. 9(1). 1558. doi: 10.1038/s41467-018-04013-1.
- Liddle R.A. Regulation of cholecystokinin synthesis and secretion in rat intestine. J. Nutr. 1994. 124(48). 1308S-14S. doi: 10.1093/jn/124.suppl_8.1308s.
- Makhmudi A., Kalim A.S., Gunadi І. microRNA-21 expressions impact on liver fibrosis in biliary atresia patients. BMC Res. Notes. 2019. 12. 189. doi: 10.1186/s13104-019-4227-y.
- Ningappa M., Min J., Higgs B.W. et al. Genome-wide association studies in biliary atresia. Wiley Interdiscip. Rev. Syst. Biol. Med. 2015 Sep-Oct. 7(5). 267-73. doi: 10.1002/wsbm.1303.
- Nizery L., Chardot C., Sissaoui S. et al. Biliary atresia: Clinical advances and perspectives. Clin. Res. Hepatol. Gastroenterol. 2016 Jun. 40(3). 281-287. doi: 10.1016/j.clinre.2015.11.010.
- O’Hara S.P., Gradilone S.A., Masyuk T.V. et al. MicroRNAs in Cholangiopathies. Curr. Pathobiol. Rep. 2014. 2. 133. doi: 10.1007/s40139-014-0048-9.
- Peng X., Yang L., Liu H. et al. Identification of Circulating MicroRNAs in Biliary Atresia by Next-Generation Sequencing. J. Pediatr. Gastroenterol. Nutr. 2016 Nov. 63(5). 518-523. doi: 10.1097/MPG.0000000000001194.
- Puik J.R., Meijer L.L., Le Large T.Y. at al. Circulating biliary tract microRNA signature discriminates cholangiocarcinoma from pancreatic cancer [abstract]. In: Proceedings of the American Association for Cancer Research Annual Meeting. 2018. 2018 Apr 14-18. Chicago, IL. Philadelphia (PA): AACR; Cancer Res. 2018. 78 (13 Suppl.). Abstract nr 493. DOI: 10.1158/1538-7445.AM2018-493.
- Razumilava N., Gores G.J. Cholangiocarcinoma. Lancet. 2014 Jun 21. 383(9935). 2168-79. doi: 10.1016/S0140-6736(13)61903-0.
- Reich M., Deutschmann K., Sommerfeld A. et al. TGR5 is essential for bile acid-dependent cholangiocyte proliferation in vivo and in vitro. Gut. 2016 Mar. 65(3). 487-501. doi: 10.1136/gutjnl-2015-309458.
- Sun X., He Y., Ma T.T. et al. Participation of miR-200a in –TGF-β1-mediated hepatic stellate cell activation. Mol. Cell. Biochem. 2014 Mar. 388(1–2). 11-23. doi: 10.1007/s11010-013-1895-0.
- van Aerts R.M.M., van de Laarschot L.F.M., Banales J.M., Drenth J.P.H. Clinical management of polycystic liver disease. J. Hepatol. 2017 Nov 24. pii: S0168-8278(17)32449-2. doi: 10.1016/j.jhep.2017.11.024.
- Wang Z., Xie X., Zhao J. et al. The intragenic epistatic association of ADD3 with biliary atresia in Southern Han Chinese population. Biosci. Rep. 2018 Jun 12. 38(3). pii: BSR20171688. doi: 10.1042/BSR20171688.
- Wangyang Z., Daolin J., Yi X. et al. NcRNAs and Cholangiocarcinoma. J. Cancer. 2018 Jan 1. 9(1). 100-107. doi: 10.7150/jca.21785.
- Wen J., Zhou Y., Wang J. et al. Interactions between Th1 cells and Tregs affect regulation of hepatic fibrosis in biliary atresia through the IFN-γ/STAT1 pathway. Cell. Death Differ. 2017 Jun. 24(6). 997-1006. doi: 10.1038/cdd.2017.31.
- Wong M.Y., McCaughan G.W., Strasser S.I. An update on the pathophysiology and management of polycystic liver disease. Expert Rev. Gastroenterol. Hepatol. 2017 Jun. 11(6). 569-581. doi: 10.1080/17474124.2017.1309280.
- Xiao Y., Wang J., Yan W. et al. Dysregulated miR-124 and –miR-200 expression contribute to cholangiocyte proliferation in the cholestatic liver by targeting IL-6/STAT3 signalling. J. Hepatol. 2015 Apr. 62(4). 889-96. doi: 10.1016/j.jhep.2014.10.033.
- Xiao Y., Wang J., Chen Y. et al. Up-regulation of miR-200b in biliary atresia patients accelerates proliferation and migration of hepatic stellate cells by activating PI3K/Akt signaling. Cell. Signal. 2014 May. 26(5). 925-32. doi: 10.1016/j.cellsig.2014.01.003.
- Yamaura Yu., Naoyuki T., Shingo T., Shinsaku T. еt al. Serum microRNA profiles in patients with chronic hepatitis B, chronic hepatitis C, primary biliary cirrhosis, autoimmune hepatitis, nonalcoholic steatohepatitis, or drug-induced liver injury. Clinical Biochemistry. 2017. 18(50). 1034-39. DOI: 10.1016/j.clinbiochem.2017.08.010.
- Yang Y., Jin Z., Dong R. et al. MicroRNA-29b/142-5p contribute to the pathogenesis of biliary atresia by regulating the IFN-γ gene. Cell. Death Dis. 2018 May 1. 9(5). 545. doi: 10.1038/s41419-018-0605-y.
- Ye Y., Li Z., Feng Q. et al. Downregulation of microRNA-145 may contribute to liver fibrosis in biliary atresia by targeting ADD3. PLoS One. 2017 Sep 13. 12(9). e0180896. doi: 10.1371/journal.pone.0180896.
- Yin X., Chai Z., Sun X., Chen J., Wu X., Yang L., Zhou X., Liu F. Overexpression of microRNA‑96 is associated with poor prognosis and promotes proliferation, migration and invasion in cholangiocarcinoma cells via MTSS1. Experimental and Therapeutic Medicine. 2020. 4(19). 2757-65. https://doi.org/10.3892/etm.2020.8502.
- Zahm A.M., Hand N.J., Boateng L.A., Friedman J.R. Circula–ting microRNA is a biomarker of biliary atresia. J. Pediatr. Gastroenterol. Nutr. 2012 Oct. 55(4). 366-9. doi: 10.1097/MPG.0b013e318264e648.
- Zhao Y., Cong L., Lukiw W.J. Plant and Animal microRNAs (miRNAs) and Their Potential for Inter-kingdom Communication. Cell. Mol. Neurobiol. 2018 Jan. 38(1). 133-140. doi: 10.1007/s10571-017-0547-4.