Журнал «Здоровье ребенка» Том 18, №5, 2023
Вернуться к номеру
Персоналізована генотип-асоційована діагностика прогресування атопічного маршу в дітей
Авторы: Дитятковський В.О.
Дніпровський державний медичний університет, м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
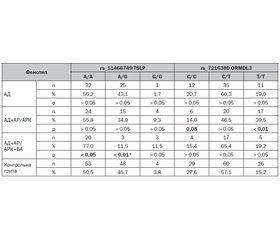
Актуальність. Атопічний марш (АМ) — це прогресування атопічних хвороб (АХ) від моноорганних фенотипів (МОФ), зазвичай атопічного дерматиту (АД), до поєднання з алергічним ринітом/ринокон’юктивітом (АР/АРК) і бронхіальною астмою (БА) у повний поліорганний фенотип (ПОФ) АД+АР/АРК+БА. При цьому стартовим і базовим МОФ АМ є АД. Підґрунтям АХ і АМ є генотип людини, зокрема однонуклеотидні варіанти (SNV — single nucleotide variants (англ.)) генів, які зумовлюють схильність до розвитку фенотипів АХ. Зокрема, це SNV тимічного стромального лімфопоетину (TSLP) і орозомукоїд-1-подібного білка 3 (ORMDL3): SNV rs_11466749 TSLP і rs_7216389 ORMDL3. Метою даного дослідження було визначити асоціації та ризики розвитку ПОФ АМ АД+АР/АРК і АД+АР/АРК+БА відносно базового МОФ АД і один щодо одного в дітей при різних генотипах SNV rs_11466749 TSLP і rs_7216389 ORMDL3. Матеріали та методи. У дослідженні взяли участь 232 дитини віком від 3 до 18 років — 127 осіб основної групи та 105 — контрольної групи. Основну групу становили 127 дітей трьох досліджуваних фенотипів АМ: 1 МОФ АД (n = 58) і 2 ПОФ: АД+АР/АРК (n = 43) і АД+АР/АРК+БА (n = 26). Контрольну групу становили 105 дітей без АХ, хворих на патологію шлунково-кишкового тракту. Усім дітям груп дослідження був проведений букальний зскрібок матеріалу ДНК, з яким була проведена полімеразна ланцюгова реакція в реальному часі з рестриктивною довжиною фрагменту поліморфізму для визначення генотипів SNV-кандидатів: A/A, A/G, G/G rs_11466749 TSLP і C/C, C/T, T/T rs_7216389 ORMDL3. Для статистичної обробки отриманих результатів були використані критерії χ2 Пірсона і точний критерій Фішера, коефіцієнт контингенції Бравайса — Пірсона (r), логістичний регресійний аналіз з визначенням показника співвідношення шансів (OR) з 95% довірчим інтервалом (95% СІ), ROC-аналіз з розрахунком площі під ROC-кривою (AUC) з 95% довірчим інтервалом і операційних характеристик — чутливості й специфічності. За критичний рівень статистичної значущості результатів під час перевірки усіх гіпотез прийнято p < 0,05, тенденцію до вірогідності визначали при p = 0,05–0,1. Результати. Були зафіксовані такі статистично значимі відмінності в зустрічальності генотипів відносно контрольної групи: для ПОФ АД+АР/АРК: SNV rs_7216389 ORMDL3: C/С — 14,0 %, Т/Т — 39,5 % до 27,6 і 15,2 % відповідно (p = 0,08 і p < 0,01); для ПОФ АД+АР/АРК+БА: SNV rs_11466749 TSLP: A/A — 77,0 %, A/G — 11,5 % до 50,5 і 45,7 % відповідно (p < 0,05 і p < 0,01). Між фенотипами основної групи були зафіксовані такі статистично значимі відмінності в зустрічальності генотипів: АД+АР/АРК і АД: G/G rs_11466749 TSLP — 9,3 і 1,7 % (p = 0,08), T/T rs_7216389 ORMDL3 — 39,5 і 19,0 % (p < 0,05); АД+АР/АРК+БА і АД: SNV rs_11466749 TSLP: A/A — 77,0 і 55,2 % (p = 0,06), A/G — 11,5 і 43,1 % (p < 0,01), G/G — 11,5 і 1,7 % (p = 0,09). Були встановлені такі асоціації між ПОФ АМ і МОФ АД: АД+АР/АРК відносно АД: G/G rs_11466749 TSLP — r = 0,173 (p = 0,08), T/T rs_7216389 ORMDL3 — r = 0,227 (p < 0,05); АД+АР/АРК+БА відносно АД: SNV rs_11466749 TSLP: А/А — r = 0,207 (p = 0,06), A/G — r = –0,310 (p < 0,01), G/G — r = 0,213 (p = 0,09). Були визначені такі значимі ризики розвитку ПОФ АМ відносно МОФ АД: АД+АР/АРК відносно АД: G/G rs_11466749 TSLP — OR = 5,85 (95% СІ 0,63–54,31, p = 0,08), T/T rs_7216389 ORMDL3 — OR = 2,79 (95% СІ 1,14–6,85, p < 0,05); АД+АР/АРК+БА відносно АД: SNV rs_11466749 TSLP: A/A — OR = 2,71 (95% СІ 0,95–7,73, p = 0,06), A/G — OR = 0,17 (95% СІ 0,05–0,64, p < 0,01), G/G — OR = 7,43 (95% СІ 0,73–75,23, p = 0,09). Висновки. Носії генотипу G/G rs_11466749 TSLP з тенденцією до вірогідності мають пряму асоціацію і підвищений до 5,85 раза ризик розвитку ПОФ АД+АР/АРК відносно МОФ АД. Носії генотипу T/T rs_7216389 ORMDL3 мають вірогідну пряму асоціацію та підвищений до 2,79 раза ризик розвитку ПОФ АД+АР/АРК відносно МОФ АД. Ризик розвитку повного ПОФ АД+АР/АРК+БА відносно базового МОФ АД визначається різними варіантами SNV rs_11466749 TSLP: А/А і G/G з тенденцією до вірогідності мають прямі слабкі асоціації та підвищують даний ризик до 2,71 і 7,43 раза відповідно, а A/G має вірогідно пряму негативну слабку асоціацію і знижує цей ризик до 0,17 раза.
Background. Atopic march (AM) is the progression of atopic lesions (AL) from monoorganic phenotypes (MOPh), usually atopic dermatitis (AD), to a combination with allergic rhinitis/rhinoconjunctivitis (AR/ARC) and bronchial asthma (BA) in the full-scope polyorganic phenotype (POPh) AD + AR/ARC + BA. At the same time, AD is the initial and basic AM MOPh. The basis of AL and AM is the human genotype, in particular, single nucleotide variants (SNV) of genes that predispose to the development of AL phenotypes. Namely, these are SNV of thymic stromal lymphopoietin (TSLP) and orоsomucoid-1-like protein 3 (ORMDL3): SNV rs_11466749 TSLP and rs_7216389 ORMDL3. The purpose of this study was to detect the associations and risks of developing AM POPh AD + AR/ARC and AD + AR/ARC + BA related to baseline MOPh AD and to each other in children with different SNV rs_11466749 TSLP and rs_7216389 ORMDL3 genotypes. Materials and methods. Two hundred and thirty-two children aged 3 to 18 years took part in the study. The main group consisted of 127 patients with 3 studied AM phenotypes: one MOPh AD (n = 58) and two POPh: AD + AR/ARC (n = 43) and AD + AR/ARC + BA (n = 26). The control group included 105 children without AL, suffering from gastrointestinal diseases. All children in the study groups underwent a buccal swab of the DNA material, which then was studied using the real-time polymerase chain reaction with restriction fragment length polymorphism to determine the genotypes of SNV candidates: A/A, A/G, G/G rs_11466749 TSLP and C/C, C/T, T/T rs_7216389 ORMDL3. Pearson’s χ2 criterion and Fisher’s exact test, Bravais-Pearson contingency coefficient (r), logistic regression analysis with determination of odds ratio (OR) with 95% confidence interval (95% CI), receiver operating characteristic (ROC) analysis with calculation of the area under the ROC curve with a 95% CI and operating characteristics — sensitivity and specificity were used for statistical processing. The critical level of statistical significance of the results during testing of all hypotheses was p < 0.05, the tendency to probability was determined at p = 0.05–0.1. Results. The following statistically significant differences were detected in the occurrence of genotypes related to the control group: for POPh AD + AR/ARC: SNV rs_7216389 ORMDL3: C/C — 14.0 %, T/T — 39.5 to 27.6 and 15.2 %, respectively (p = 0.08 and p < 0.05); for POPh AD + AR/ARC + BA: SNV rs_11466749 TSLP: A/A — 77.0 %, A/G — 11.5 to 50.5 and 45.7 %, respectively (p < 0.05 and p < 0.01). Among the phenotypes of the main group, the following statistically significant differences in the genotypes incidence had been detected: AD + AR/ARC related to AD: G/G rs_11466749 TSLP — 9.3 to 1.7 % (p = 0.08), T/T rs_7216389 ORMDL3 — 39.5 to 19.0 % (p < 0.05); AD + AR/ARC + BA related to AD: SNV rs_11466749 TSLP: A/A — 77.0 to 55.2 % (p = 0.06), A/G — 11.5 to 43.1 % (p < 0.01), G/G — 11.5 to 1.7 % (p = 0.09). The following associations were found between POPh AM and MOPh AD: AD + AR/ARC related to AD: G/G rs_11466749 TSLP, r = 0.173 (p = 0.08), T/T rs_7216389 ORMDL3, r = 0.227 (p < 0.05); AD + AR/ARC + BA related to AD: SNV rs_11466749 TSLP: A/A, r = 0.207 (p = 0.06), A/G, r = –0.310 (p < 0.01), G/G, r = 0.213 (p = 0.09). The following statistically significant risks of developing POPh AM were determined related to MOPh AD: AD + AR/ARC: G/G rs_11466749 TSLP, OR = 5.85 (95% CI 0.63–54.31, p = 0.08), T/T rs_7216389 ORMDL3, OR = 2.79 (95% CI 1.14–6.85, p < 0.05); AD + AR/ARC + BA related to AD: SNV rs_11466749 TSLP: A/A, OR = 2.71 (95% CI 0.95–7.73, p = 0.06), A/G, OR = 0.17 (95% CI 0.05–0.64, p < 0.01), G/G, OR = 7.43 (95% CI 0.73–75.23, p = 0.09). Conclusions. Carriers of the G/G rs_11466749 TSLP genotype with a tendency toward probability have a direct association and a 5.85-fold increased risk of developing POPh AD + AR/ARC relative to MOPh AD. Carriers of the T/T rs_7216389 ORMDL3 genotype have a significant direct association and an increased risk (by up to 2.79 times) of developing POPh AD + AR/ARC related to MOPh AD. The risk of developing the complete POPh of AD + AR/ARC + BA related to the basic MOPh AD is determined by different types of SNV rs_11466749 TSLP: A/A and G/G with a trend to significance have direct low associations and increase this risk by up to 2.71 and 7.43 times, respectively, and A/G has significant direct low association and reduces this risk to up to 0.17 times.
атопічний марш; діти; фенотипи; однонуклеотидні варіанти; тимічний стромальний лімфопоетин; орозомукоїд-1-подібний білок 3
atopic march; children; phenotypes; single nucleotide variants; thymic stromal lymphopoietin; orosomucoid-like-1 protein 3
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Hill D.A., Grundmeier R.W., Ram G., Spergel J.M. The epidemiologic characteristics of healthcare provider-diagnosed eczema, asthma, allergic rhinitis, and food allergy in children: a retrospective cohort study. BMC Pediatr. 2016. 16. 133-016-5540673-z.
- Tsakok T., Marrs T., Mohsin M., Baron S., du Toit G., Till S. et al. Does atopic dermatitis cause food allergy? A systematic review. The Journal of Allergy and Clinical Immunology. 2016. 137(4). 1071-8.
- Dharmage S.C., Lowe A.J., Matheson M.C., Burgess J.A., Allen K.J., Abramson M.J. Atopic dermatitis and the atopic march revisited. Allergy. 2014 Jan. 69(1). 17-27. doi: 10.1111/all.12268.
- Дитятковський В.О. Генотип-асоційовані клінічні маркери розвитку атопічного фенотипу в дітей. Перинатологія і педіатрія. 2023. № 1(93). С. 45-50; doi 10.15574/PP.2023.93.45.
- Bieber T., D’Erme A.M., Akdis C.A., Traidl-Hoffmann C., Lauener R., Schäppi G., Schmid-Grendelmeier P. Clinical phenotypes and endophenotypes of atopic dermatitis: Where are we, and where should we go? J. Allergy Clin. Immunol. 2017 Apr. 139(4S). S58-S64. doi: 10.1016/j.jaci.2017.01.008.
- Busse W.W. The atopic march: Fact or folklore? Annals of Allergy, Asthma & Immunology. 2018. 120(2). 116-8.
- Bawany F., Beck L.A., Järvinen K.M. Halting the March: Primary Prevention of Atopic Dermatitis and Food Allergies. J. Allergy Clin. Immunol. Pract. 2020 Mar. 8(3). 860-875. doi: 10.1016/j.jaip.2019.12.005.1111111.
- Weidinger S., Novak N. Atopic dermatitis. Lancet. 2016 Mar 12. 387(10023). 1109-1122. doi: 10.1016/S0140-6736(15)00149-X.
- Czarnowicki T., Krueger J.G., Guttman-Yassky E. Novel concepts of prevention and treatment of atopic dermatitis through barrier and immune manipulations with implications for the atopic march. J. Allergy Clin. Immunol. 2017 Jun. 139(6). 1723-1734. doi: 10.1016/j.jaci.2017.04.004.
- Dytiatkovskyi V., Drevytska T., Lapikova-Bryhinska T., Dosenko V., Abaturov O. Genotype Associations with the Different Phenotypes of Atopic Dermatitis in Children. Acta Medica (Hradec Kralove). 2021. 64(2). 96-100. doi: 10.14712/18059694.2021.17.
- Heo Won, Park Kui, Lee Mi-Kyung, Moon Nam, Seo Seong. TSLP Polymorphisms in Atopic Dermatitis and Atopic March in Koreans. Annals of Dermatology. 2018. 30. 529. 10.5021/ad.2018.30.5.529.
- Birben E., Sahiner U.M., Karaaslan C., Yavuz T.S., Cosgun E., Kalayci O., Sackesen C. The genetic variants of thymic stromal lymphopoietin protein in children with asthma and allergic rhinitis. Int. Arch. Allergy Immunol. 2014. 163(3). 185-92. doi: 10.1159/000358488. Epub 2014 Feb 13. PMID: 24525665.
- Kitajima M., Ziegler S.F. Cutting edge: identification of the thymic stromal lymphopoietin-responsive dendritic cell subset critical for initiation of type 2 contact hypersensitivity. J. Immunol. 2013 Nov 15. 191(10). 4903-7. doi: 10.4049/jimmunol.
- Liang Y., Chang C., Lu Q. The Genetics and Epigenetics of Atopic Dermatitis-Filaggrin and Other Polymorphisms. Clin. Rev. Allergy Immunol. 2016 Dec. 51(3). 315-328. doi: 10.1007/s12016-015-8508-5.
- Miyake Y., Hitsumoto S., Tanaka K., Arakawa M. Association Between TSLP Polymorphisms and Eczema in Japanese Women: the Kyushu Okinawa Maternal and Child Health Study. Inflammation. 2015 Aug. 38(4). 1663-8. doi: 10.1007/s10753-015-0143-z.
- Дитятковський В.О. Роль однонуклеотидних варіантів гена тимічного стромального лімфопоетину у прогнозуванні моно- та поліорганного ураження в дітей, хворих на атопічні захворювання. Сучасна педіатрія. Україна. 2022. 8(120). 23-29. doi 10.15574/SP.2021.120.23.
- Andiappan A.K., Sio Y.Y., Lee B., Suri B.K., Matta S.A., Lum J., Foo S., Koh G., Liu J., Zolezzi F., Poidinger M., Wang de Y., Rotzschke O., Chew F.T. Functional variants of 17q12-21 are associated with allergic asthma but not allergic rhinitis. J. Allergy Clin. Immunol. 2016 Mar. 137(3). 758-66.e3. doi: 10.1016/j.jaci.2015.08.038.
- Stein M.M., Thompson E.E., Schoettler N., Helling B.A., Magnaye K.M., Stanhope C. et al. A decade of research on the 17q12-21 asthma locus: Piecing together the puzzle. J. Allergy Clin. Immunol. 2018 Sep. 142(3). 749-764.e3. doi: 10.1016/j.jaci.2017.12.974.
- Дитятковський В.О. Варіанти однонуклеотидних поліморфізмів тимічного стромального лимфопоетину та орсомукоїд-1-подібного білка 3 як предиктори розвитку моно- або поліорганних клінічних фенотипів атопічних хвороб у дітей. Здоров’я дитини. 2022. Т. 17. № 6. С. 19-25. doi: https://doi.org/10.22141/2224-0551.16.2.2021.229876.
- Shi H., Cheng D., Yi L., Huo X., Zhang K., Zhen G. Association between ORMDL3 polymorphism and susceptibility to asthma: a meta-analysis. Int. J. Clin. Exp. Med. 2015 Mar 15. 8(3). 3173-83.
- Šimundić A.M. Measures of Diagnostic Accuracy: Basic Definitions. EJIFCC. 2009 Jan 20. 19(4). 203-11. PMID: 27683318