Журнал "Гастроэнтерология" Том 57, №1, 2023
Вернуться к номеру
Номенклатура та діагностика серонегативної целіакії і хронічних ентеропатій, не пов’язаних із целіакією, у дорослих
Авторы: Губська О.Ю., Денесюк О.Р.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
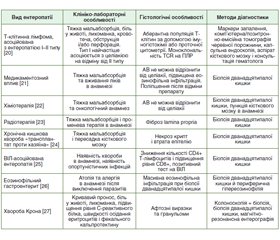
Атрофія ворсинок тонкої кишки — це один з головних гістопатологічних проявів хронічної ентеропатії. У більшості випадків цей стан обумовлений целіакією. Целіакія — це автоімунне захворювання, що виникає в генетично схильних осіб, характеризується ураженням слизової оболонки тонкої кишки (Т-клітинно-опосередкована ентеропатія) на тлі впливу глютену і лікується за допомогою довічної безглютенової дієти. Діагностика класичної целіакії не викликає труднощів. Діагностичні алгоритми відпрацьовані роками. Проблеми з встановленням діагнозу виникають тоді, коли атрофія ворсинок тонкої кишки виникає в пацієнтів із симптомами з боку шлунково-кишкового тракту, у яких специфічні для целіакії антитіла негативні. Диференціальна діагностика атрофії ворсинок тонкої кишки без серологічних маркерів целіакії в дорослих виконується між серонегативною целіакією і хронічними ентеропатіями, не пов’язаними із целіакією. Довгий час існувала діагностична й клінічна невизначеність щодо цих станів. Ця невизначеність призводила до помилкових діагнозів, а також збільшувала кількість людей, які дотримувались безглютенової дієти без нагальної потреби. У період з вересня 2019 р. по липень 2021 р. міжнародна робоча група з 13 гастроентерологів із шести країн провела роботу над створенням консенсусу щодо номенклатури й діагностики серонегативної целіакії та хронічних ентеропатій, не пов’язаних із целіакією, у дорослих.
Small bowel villous atrophy is one of the main histopathological manifestations of chronic enteropathy. In most cases, this condition is caused by celiac disease. Celiac disease is an autoimmune disease that occurs in genetically predisposed individuals and is characterized by damage to the mucous membrane of the small intestine (T-cell-mediated enteropathy) due to the influence of gluten and is treated with the help of a lifelong gluten-free diet. Diagnosis of classic celiac disease does not cause difficulties. Diagnostic algorithms have been developed for years. Diagnostic problems arise when small bowel villous atrophy occurs in patients who have gastrointestinal symptoms but are negative for celiac disease-specific antibodies. Differential diagnosis of small bowel villous atrophy without serological markers for celiac disease in adults includes seronegative celiac disease and chronic non-celiac enteropathies. There has long been diagnostic and clinical uncertainty about these conditions. This uncertainty has led to misdiagnoses and increased the number of people following a gluten-free diet unnecessarily. Between September 2019 and July 2021, an international working group of 13 gastroenterologists from six countries worked to create a consensus on the nomenclature and diagnosis of seronegative celiac disease and non-celiac enteropathies in adults.
атрофія ворсинок слизової оболонки тонкої кишки; целіакія; серонегативна целіакія; хронічні ентеропатії, не пов’язані із целіакією; безглютенова дієта
small bowel villous atrophy; celiac disease; seronegative celiac disease; non-celiac enteropathies disease; gluten-free diet
Вступ
Результати
Висновки
- Leonard M.M., Lebwohl B., Rubio-Tapia A., Biagi F. Aga clinical practice update on the evaluation and management of Seronegative Enteropathies: Expert Review. Gastroenterology. 2021. 160(1). 437-44. doi.org/10.1053/j.gastro.2020.08.061.
- Ludvigsson J.F., Bai J.C., Biagi F., Card T.R, Ciacci C., Ciclitira P.J. et al. Diagnosis and management of Adult Coeliac Di–sease: Guidelines from the British Society of Gastroenterology. Gut. 2014. 63(8). 1210-28. doi.org/10.1136/gutjnl-2013-306578.
- Lebwohl B., Sanders D.S., Green P.H. Coeliac disease. The Lancet. 2018. 391(10115). 70-81. doi.org/10.1016/s0140-6736(17)31796-8.
- Schiepatti A., Sanders D.S., Zuffada M., Luinetti O., Iraqi A., Biagi F. Overview in the clinical management of patients with seronegative villous atrophy. European Journal of Gastroenterology & Hepatology. 2019. 31(4). 409-17. DOI: 10.1097/MEG.0000000000001340.
- Ludvigsson J.F., Leffler D.A., Bai J.C., Biagi F., Fasano A., Green P.H. et al. The Oslo definitions for coeliac disease and related terms. Gut. 2012. 62(1). 43-52. DOI: 10.1136/gutjnl-2011-301346.
- Jones J., Hunter D. Qualitative research: Consensus Methods for Medical and Health Services Research. BMJ. 1995. 311(7001). 376-80. DOI: 10.1136/bmj.311.7001.376.
- Schiepatti A., Biagi F., Fraternale G., Vattiato C., Balduzzi D., Agazzi S. et al. Short article. European Journal of Gastroenterology & Hepatology. 2017. 29(5). 572-6. DOI: 10.1097/meg.0000000000000836.
- Salmi T.T., Collin P., Korponay-Szabo I.R., Laurila K., Partanen J., Huhtala H. et al. Endomysial antibody-negative coeliac disease: Clinical characteristics and intestinal autoantibody deposits. Gut. 2006. 55(12). 1746-53. DOI: 10.1136/gut.2005.071514.
- Corazza G.R., Biagi F., Volta U., Andreani M.L., De Franceschi L., Gasbarrini G. Autoimmune enteropathy and villous atrophy in adults. The Lancet. 1997. 350(9071). 106-9. DOI: 10.1016/s0140-6736(97)01042-8.
- Akram S., Murray J.A., Pardi D.S., Alexander G.L., Schaffner J.A., Russo P.A. et al. Adult autoimmune enteropathy: Mayo Clinic rochester experience. Clinical Gastroenterology and Hepatology. 2007. 5(11). 1282-90. DOI: 10.1016/j.cgh.2007.05.013.
- Sharma A., Choung R.S., Wang X.J., Russo P.A., Wu T.-T., Nehra V. et al. Features of adult autoimmune enteropathy compared with refractory celiac disease. Clinical Gastroenterology and Hepato–logy. 2018. 16(6). DOI: 10.1016/j.cgh.2017.12.044.
- Jørgensen S.F., Reims H.M., Frydenlund D., Holm K., Paulsen V., Michelsen A.E. et al. A cross-sectional study of the prevalence of gastrointestinal symptoms and pathology in patients with common variable immunodeficiency. American Journal of Gastroenterology. 2016. 111(10). 1467-75. DOI: 10.1038/ajg.2016.329.
- Conley M.E., Notarangelo L.D., Etzioni A. Diagnostic criteria for primary immunodeficiencies. Clinical Immunology. 1999. 93(3). 190-7. DOI:10.1006/clim.1999.4799.
- Sharma P., Baloda V., Gahlot G.P.S., Singh A., Mehta R., Vishnubathla S. et al. Clinical, endoscopic, and histological differentiation between celiac disease and tropical sprue: A systematic review. Journal of Gastroenterology and Hepatology. 2018. 34(1). 74-83. DOI: 10.1111/jgh.14403.
- Leung A.K.C., Leung A.A.M., Wong A.H.C., Sergi C.M., Kam J.K.M.. Giardiasis: An overview. Recent Patents on Inflammation & Allergy Drug Discovery. 2019. 13(2). 134-43. DOI: 10.2174/1872213x13666190618124901.
- Malamut G., Meresse B., Kaltenbach S., Derrieux C., Verkarre V., Macintyre E. et al. Small intestinal CD4+ T-cell lymphoma is a heterogenous entity with common pathology features. Clinical Gastroenterology and Hepatology. 2014. 12(4). DOI: 10.1016/j.cgh.2013.11.028.
- Sharma A., Oishi N., Boddicker R.L., Hu G., Benson H.K., Ketterling R.P. et al. Recurrent STAT3-JAK2 fusions in indolent T-cell lymphoproliferative disorder of the gastrointestinal tract. Blood. 2018. 131(20). 2262-6. DOI: 10.1182/blood-2018-01-830968.
- Schiepatti A., Sanders D.S., Aziz I., De Silvestri A., Goodwin J., Key T. et al. Clinical phenotype and mortality in patients with idiopathic small bowel villous atrophy: A dual-centre international study. European Journal of Gastroenterology & Hepatology. 2020. 32(8). 938-49. DOI: 10.1097/meg.0000000000001726.
- Goldstein N.S. Non-gluten sensitivity-related small bowel villous flattening with increased intraepithelial lymphocytes. American Journal of Clinical Pathology. 2004. 121(4). 546-50. DOI: 10.1309/10fcnctc56nmn0ye.
- Rubio-Tapia A., Herman M.L., Ludvigsson J.F., Kelly D.G., Mangan T.F., Wu T.-T. et al. Severe spruelike enteropathy associated with Olmesartan. Mayo Clinic Proceedings. 2012. 87(8). 732-8. DOI: 10.1016/j.mayocp.2012.06.003.
- Costetti M., Schiepatti A., Fraticelli S., Costa S., Maimaris S., Lenti M.V. et al. Clinical and gastro-duodenal histopathological features of enteropathy due to angiotensin II receptor blockers. Digestive and Liver Disease. 2021. 53(10). 1262-7. DOI: 10.1016/j.dld.2021.07.002.
- Touchefeu Y., Montassier E., Nieman K., Gastinne T., Potel G., Bruley des Varannes S. et al. Systematic review: The role of the gut microbiota in chemotherapy- or radiation-induced gastrointestinal mucositis — current evidence and potential clinical applications. Alimentary Pharmacology & Therapeutics. 2014. DOI: 10.1111/apt.12878.
- Stacey R., Green J.T. Radiation-induced small bowel di–sease: Latest developments and clinical guidance. Therapeutic Advances in Chronic Disease. 2013. 5(1). 15-29. DOI: 10.1177/–2040622313510730.
- Patey-Mariaud de Serre N., Reijasse D., Verkarre V., Canio–ni D., Colomb V., Haddad E. et al. Chronic intestinal graft-versus-host disease: Clinical, histological and immunohistochemical analysis of 17 children. Bone Marrow Transplantation. 2002. 29(3). 223-30. DOI: 10.1038/sj.bmt.1703329.
- Kapembwa M. HIV Enteropathy. The Lancet. 1989. 334 (8678–8679). 1521-2. DOI: 10.1016/s0140-6736(89)92961-9.
- Walker M.M., Potter M., Talley N.J. Eosinophilic gastroenteritis and other eosinophilic gut diseases distal to the oesophagus. The Lancet Gastroenterology & Hepatology. 2018. 3(4). 271-80. DOI: 10.1016/s2468-1253(18)30005-0.
- Culliford A., Markowitz D., Rotterdam H., Green P.H. Scallo–ping of duodenal mucosa in crohn’s disease. Inflammatory Bowel Di–seases. 2004. 10(3). 270-3. DOI: 10.1097/00054725-200405000-00015.
- Reunala T., Hervonen K., Salmi T. Dermatitis herpetiformis: An update on diagnosis and management. American Journal of Clinical Dermatology. 2021. 22(3). 329-38. DOI: 10.1007/s40257-020-00584-2.
- Schiepatti A., Sanders D.S., Biagi F. Seronegative coeliac disease. Current Opinion in Gastroenterology. 2018. 34(3). 154-8. DOI: 10.1097/mog.0000000000000436.
- Salmi T.T., Collin P., Korponay-Szabo I.R., Laurila K., Partanen J., Huhtala H. et al. Endomysial antibody-negative coeliac disease: Clinical characteristics and intestinal autoantibody deposits. Gut. 2006. 55(12). 1746-53. DOI: 10.1136/gut.2005.071514.
- Villalta D., Tonutti E., Prause C., Koletzko S., Uhlig H.H., Vermeersch P. et al. IGG antibodies against deamidated gliadin peptides for diagnosis of celiac disease in patients with IGA deficiency. Clinical Chemistry. 2010. 56(3). 464-8. DOI:10.1373/clinchem.2009.128132.

/57.jpg)
/58.jpg)