Журнал «Здоровье ребенка» Том 18, №1, 2023
Вернуться к номеру
Рівень антитіл до адалімумабу в дітей з ювенільним ідіопатичним артритом на різних етапах лікування
Авторы: Марушко Т.В. (1), Онуфреїв О.Є. (1), Марушко Ю.В. (2), Герман О.Б. (1)
(1) — Національний університет охорони здоров’я України ім. П.Л. Шупика, м. Київ, Україна
(2) — Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Клинические исследования
Версия для печати
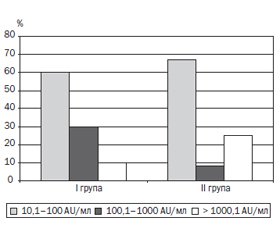
Актуальність. Ювенільний ідіопатичний артрит (ЮІА) — одне з найпоширеніших дитячих ревматологічних захворювань. Центральне місце щодо проблеми ЮІА посідають питання лікування, від своєчасності й адекватності якого залежить прогноз захворювання і фактично вся подальша доля дитини. Імунобіологічна терапія здатна індукувати стійку клініко-лабораторну ремісію, а також переривати подальше прогресування структурних змін, діючи на патогенетичну ланку розвитку ідіопатичного артриту. Але відсутність відповіді на терапію або зниження її ефективності залишається досить поширеною проблемою, і в багатьох випадках це може бути спричинено імуногенністю імунобіологічних препаратів, особливо у випадку застосування інгібіторів фактора некрозу пухлини. Мета: вивчити рівень антитіл до адалімумабу (АДА) в дітей з ювенільним ідіопатичним артритом на різних етапах лікування для аналізу імуногенності. Матеріали та методи. Було вивчено й оцінено концентрацію антитіл до адалімумабу у 80 зразках сироватки крові хворих з ЮІА, проаналізовано ефективність лікування й несприятливі події в 56 пацієнтів з ЮІА на різних етапах терапії. У процесі проведення дослідження було сформовано дві групи. У першу групу увійшли 24 хворі, які в процесі лікування з немедикаментозних причин мали мінімум 6-місячну перерву у введенні АДА, під час якої лікування продовжувалось метотрексатом з періодичним введенням глюкокортикоїдів внутрішньосуглобово. Визначення рівня антитіл до АДА проводилося перед перервою і через 1 місяць після відновлення введення препарату. Друга група, у яку увійшли 32 дитини, — це хворі, які в процесі лікування продовжували введення АДА без перерви. Активність хвороби вимірювали за допомогою JADAS-27. Наявність антитіл до АДА визначали методом імуноферментного аналізу. Результати. У процесі обстеження нами було виявлено, що в І групі до немедикаментозної відміни препарату у 10 із 24 зразків сироваток (42 %) був підвищений рівень антитіл до АДА. При аналізі результатів рівня антитіл до АДА у хворих ІІ групи підвищений рівень був виявлений у 12 зразках, що становило 38 %. Провівши кореляційний аналіз, виявили прямі статистично значимі взаємозв’язки помірної сили між рівнем антитіл до АДА і показником запальної активності JADAS-27 (r Спірмена = 0,39; р < 0,05), а також між рівнем антитіл і тривалістю захворювання (r Спірмена = 0,32; р < 0,05). Висновки. Моніторинг рівня антитіл до АДА в сироватці крові є інформативним для правильної інтерпретації ефективності лікування й перебігу захворювання на фоні лікування даним імунобіологічним препаратом, оскільки може поліпшити розуміння доцільності продовження такого лікування, допомогти в аналізі розвитку імуногенності до АДА, розробці стратегії подальшої терапії і, як наслідок, вплинути на довгостроковий результат лікування ЮІА.
Background. Juvenile idiopathic arthritis (JIA) is one of the most common rheumatological diseases of childhood. The central place in the problem of JIA belongs to the question of treatment the timeliness and adequacy of which determine the disease prognosis and, in fact, the entire future of the child. Immunobiological therapy can cause stable clinical and laboratory remission, as well as stop the further progression of structural changes, affecting the pathogenetic link of idiopathic arthritis. But the lack of response to therapy or a decrease in its effectiveness remains a fairly common problem and, in many cases, can be caused by the immunogenicity of immunobiological drugs, especially in case of treatment with tumor necrosis factor inhibitors. Aim of the work: to study the level of antibodies to adalimumab in children with juvenile idiopathic arthritis at different stages of treatment for analysis of immunogenicity. Materials and methods. The concentration of antibodies to adalimumab in 80 serum samples from patients with JIA was studied and evaluated, treatment effectiveness and adverse events were analyzed in 56 patients with JIA at different stages of therapy. Two groups were identified. The first one included 24 patients who had at least a 6-month break in adalimumab administration for non-medical reasons during which treatment was continued with methotrexate with periodic intra-articular injection of glucocorticoids. The level of antibodies to adalimumab was evaluated before the break and 1 month after the reinitiation of adalimumab administration. The second group consisted of 32 children who continued adalimumab without a break during treatment. Disease activity was measured using JADAS-27. Antibodies to adalimumab were detected by enzyme-linked immunosorbent assay. Results. During the examination, an elevated level of antibodies to adalimumab was detected in 10 of 24 serum samples (42 %) before non-medical withdrawal in group I. Among the results of group II, elevated levels of antibodies to adalimumab were found in 12 samples, which was 38 %. The correlation analysis revealed direct statistically significant relationships of moderate strength between the level of antibodies to adalimumab and the indicator of inflammatory activity on JADAS-27 (Spearman’s r = 0.39, p < 0.05), as well as between the level of antibodies and disease duration (Spearman’s r = 0.32, p < 0.05). Conclusions. Monitoring serum antibodies to adalimumab is informative for the correct interpretation of treatment effectiveness and the course of the disease with immunobiological treatment, as it may improve understanding of the clinical consequences of continued therapy, help prevent adalimumab immunogenicity, develop follow-up strategies and, as a result, can affect a long-term outcome of treatment for JIA.
ювенільний ідіопатичний артрит; адалімумаб; антитіла до адалімумабу; імуногенність; інгібітори TNF-α
juvenile idiopathic arthritis; adalimumab; antibodies to adalimumab; immunogenicity; TNF-α inhibitors
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Thatayatikom A., Modica R., De Leucio A. Juvenile Idiopathic Arthritis. StatPearls. Treasure Island (FL): StatPearls Publishing; 2022. PMID: 32119492.
- Martini A., Lovell D.J., Albani S. et al. Juvenile idiopathic arthritis. Nat. Rev. Dis. Primers. 2022. 8(1). http://doi.org/10.1038/s41572-021-00332-8.
- Deslandre C. Arthrite juvénile idiopathique: définition et classification. Arch. Pediatr. 2016. 23(4). 437-41. http://doi.org/10.1016/j.arcped.2016.01.005.
- Bukovac L.T., Perica M. Juvenile idiopathic arthritis. Reumatizam. 2016. 63(1). 53-8. PMID: 29624302.
- Golhen K., Winskill C., Yeh C., Zhang N., Welzel T., Pfister M. Value of literature review to inform development and use of biologics in juvenile idiopathic arthritis. Front. Pediatr. 2022. 10. http://doi.org/10.3389/fped.2022.909118.
- Kearsley-Fleet L., Heaf E., Davies R. et al. Frequency of biologic switching and the outcomes of switching in children and young people with juvenile idiopathic arthritis: a national cohort study. Lancet Rheumatol. 2020. 2(4). e217-26. http://doi.org/10.1016/S2665-9913(20)30025-4.
- Atiqi S., Hooijberg F., Loeff F.C., Rispens T., Wolbink G.J. Immunogenicity of TNF-inhibitors. Front Immunol. 2020. 11(312). http://doi.org/10.3389/fimmu.2020.00312.
- Bendtzen K. Immunogenicity of anti-TNF-α biotherapies: II. Clinical relevance of methods used for anti-drug antibody detection. Front. Immunol. 2015. 6(109). http://doi.org/10.3389/fimmu.2015.00109.
- Doeleman M.J.H, van Maarseveen E.M., Swart J.F. Immunogenicity of biologic agents in juvenile idiopathic arthritis: a systematic review and meta-analysis. Rheumatology (Oxford). 2019. 58(10). 1839-49. http://doi.org/10.1093/rheumatology/kez030.
- Marino A., Real-Fernández F., Rovero P. et al. Anti-adalimu–mab antibodies in a cohort of patients with juvenile idiopathic arthritis: incidence and clinical correlations. Clin. Rheumatol. 2018. 37(5). 1407-11. http://doi.org/10.1007/s10067-018-4057-7.
- Brunelli J.B., Silva C.A., Pasoto S.G. et al. Anti-adalimumab antibodies kinetics: an early guide for juvenile idiopathic arthritis (JIA) switching. Clin. Rheumatol. 2020. 39(2). 515-21. http://doi.org/10.1007/s10067-019-04798-6.
- Murdaca G., Spanò F., Contatore M. et al. Immunogenicity of infliximab and adalimumab: what is its role in hypersensitivity and modulation of therapeutic efficacy and safety? Expert Opin. Drug Saf. 2016. 15(1). 43-52. http://doi.org/10.1517/14740338.2016.1112375.
- Real-Fernández F., Cimaz R., Rossi G. et al. Surface plasmon resonance-based methodology for anti-adalimumab antibody identification and kinetic characterization. Anal. Bioanal. Chem. 2015. 407(24). 7477-85. http://doi.org/10.1007/s00216-015-8915-8.
- Bartelds G.M., Krieckaert C.L.M., Nurmohamed M.T. et al. Development of antidrug antibodies against adalimumab and association with disease activity and treatment failure during long-term follow-up. JAMA. 2011. 305(14). 1460-68. http://doi.org/10.1001/jama.2011.406.
- Quistrebert J., Hässler S., Bachelet D. et al. Incidence and risk factors for adalimumab and infliximab anti-drug antibodies in rheumatoid arthritis: A European retrospective multicohort analysis. Semin. Arthritis Rheum. 2019. 48(6). 967-75. http://doi.org/10.1016/j.semarthrit.2018.10.006.
- Moots R.J., Xavier R.M., Mok C.C., et al. The impact of anti-drug antibodies on drug concentrations and clinical outcomes in rheumatoid arthritis patients treated with adalimumab, etanercept, or infliximab: Results from a multinational, real-world clinical practice, non-interventional study. PLoS One. 2017. 12(4). e0175207. http://doi.org/10.1371/journal.pone.0175207
- Chen D.-Y., Chen Y.-M., Tsai W.-C. et al. Significant associations of antidrug antibody levels with serum drug trough levels and therapeutic response of adalimumab and etanercept treatment in rheumatoid arthritis. Ann. Rheum. Dis. 2015. 74(3). e16. http://doi.org/10.1136/annrheumdis-2013-203893.
- NHS England. Clinical commissioning policy statement: biologic therapies for the treatment of juvenile idiopathic arthritis. https://www.england.nhs.uk/commissioning/wp-content/uploads/sites/12/2015/10/e03pd-bio-therapies-jia-oct15.pdf (accessed February 10, 2022).
- Ringold S., Angeles-Han S.T., Beukelman T. et al. 2019 American college of rheumatology/arthritis foundation guideline for the treatment of juvenile idiopathic arthritis: Therapeutic approaches for non-systemic polyarthritis, sacroiliitis, and enthesitis. Arthritis Care Res. (Hoboken). 2019. 71(6). 717-34. http://doi.org/10.1002/acr.23870.
- Murdaca G., Negrini S., Greco M. et al. Immunogenicity of infliximab and adalimumab. Expert Opin. Drug Saf. 2019. 18(5). 343-5. http://doi.org/10.1080/14740338.2019.1602117.
- Schmalzing M., Behrens F., Schwaneck E.C. et al. Does concomitant methotrexate confer clinical benefits in patients treated with prior biologic therapy? Analysis of data from a noninterventional study of rheumatoid arthritis patients initiating treatment with adalimumab. Medicine (Baltimore). 2020. 99(19). e20201. http://doi.org/10.1097/MD.0000000000020201.
- Bodio C., Grossi C., Pregnolato F. et al. Personalized medicine in rheumatoid arthritis: How immunogenicity impacts use of TNF inhibitors. Autoimmun. Rev. 2020. 19(5). 102509. http://doi.org/10.1016/j.autrev.2020.102509.