Журнал "Гастроэнтерология" Том 56, №4, 2022
Вернуться к номеру
Показники циклу арахідонової кислоти в пацієнтів з ерозивно-виразковими НПЗП-асоційованими ушкодженнями гастродуоденальної зони на фоні лікування препаратом Гастротек®
Авторы: Степанов Ю.М. (1), Косинська С.В. (2), Кленіна І.А. (1), Татарчук О.М. (1), Бочаров Г.І. (1), Горбунцова В.І. (1), Пролом Н.В. (1), Петішко О.П. (1)
(1) — ДУ «Інститут гастроентерології НАМН України», м. Дніпро, Україна
(2) — Дніпровський державний медичний університет, м. Дніпро, Україна
Рубрики: Гастроэнтерология
Разделы: Клинические исследования
Версия для печати
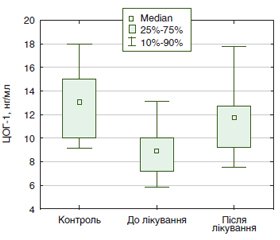
Мета дослідження: вивчення особливостей змін показників метаболізму арахідонового циклу в пацієнтів з ерозивно-виразковими пошкодженнями шлунка й дванадцятипалої кишки, спричиненими прийомом нестероїдних протизапальних препаратів, до і після лікування препаратом Гастротек® шляхом визначення вмісту ненасичених жирних кислот, простагландину Е1 (ПГЕ-1) та активності циклооксигенази-1 (ЦОГ-1) у сироватці крові. Матеріали та методи. Дослідження проведено в 30 пацієнтів, які перебували на амбулаторному лікуванні в поліклініці ДУ «Інститут гастроентерології НАМН України», з ерозивно-виразковими пошкодженнями шлунка й дванадцятипалої кишки, спричиненими НПЗП, без виразкової хвороби в анамнезі і без прийому інших препаратів, що пошкоджують слизову оболонку шлунка. Серед обстежених пацієнтів були 12 жінок (40,0 %) і 18 чоловіків (60,0 %), середній вік яких становив (52,5 ± 2,4) року. У сироватці крові пацієнтів визначали вміст ПГЕ-1, активність ЦОГ-1 за допомогою імуноферментного аналізу (ELISA); метилових ефірів ненасичених жирних кислот — за допомогою газової хроматографії на хроматографі Chromatek-Crystal 5000. Результати. Встановлене зниження вмісту арахідонової кислоти до лікування супроводжувалося зниженням активності ЦОГ-1 і рівня ПГЕ-1 у сироватці крові пацієнтів. Виявлено зниження вмісту медіани арахідонової кислоти в 3 рази у 80 % пацієнтів (24 із 30) у сироватці крові порівняно з групою контролю. Встановлено вірогідне підвищення медіани вмісту лінолевої кислоти в 4,5 раза (р < 0,05) порівняно з контрольною групою до лікування. Виявлена тенденція до зниження в 1,5 раза порівняно з контролем медіани рівня α-ліноленової кислоти (18:3, ω-3) як джерела для синтезу арахідонової кислоти з попередників класу ω-3. Після лікування препаратом Гастротек® реєструвалося вірогідне збільшення медіани вмісту арахідонової кислоти в сироватці крові в 4,3 раза (р < 0,05) порівняно з рівнем до лікування. Такі зміни були виявлені в 73,3 % (22 із 30) пацієнтів проти 80,0 % (24 із 30) пацієнтів зі зниженим вмістом арахідонової кислоти до лікування. У 76,7 % хворих лікування препаратом Гастротек® сприяло підвищенню активності ЦОГ-1, у 83,3 % хворих — вмісту ПГЕ-1, і в 73,3 % хворих реєструвалося відновлення синтезу арахідонової кислоти. Висновки. Застосування препарату Гастротек® приводило до відновлення синтезу арахідонової кислоти за рахунок використання попередників її синтезу — лінолевої та α-ліноленової жирних кислот у сироватці крові у хворих з ерозивно-виразковими ураженнями шлунка й дванадцятипалої кишки, які спричинені НПЗП. Гастротек® позитивно впливав на більшість показників циклооксигеназного шляху метаболізму арахідонової кислоти у хворих з ерозивно-виразковими ураженнями шлунка й дванадцятипалої кишки, які спричинені НПЗП.
Background. The purpose was to study characteristics of changes in the arachidonic acid cycle metabolism in patients with erosive-ulcerative lesions of the stomach and duodenum caused by nonsteroidal anti-inflammatory drugs (NSAIDs) before and after treatment with Gastrotec® by determining the content of unsaturated fatty acids, prostaglandin Е1 (PGE-1) and cyclooxygenase-1 (COX-1) activity in the blood serum. Materials and methods. The study was conducted in 30 patients with erosive-ulcerative lesions of the stomach and duodenum caused by NSAIDs, who were on outpatient treatment in the outpatient clinic of the State Institution “Institute of Gastroenterology of the National Academy of Medical Sciences of Ukraine”, had no history of peptic ulcer disease and did not take other drugs that damage gastric mucosa. Among them, there were 12 women (40.0 %), 18 men (60.0 %) whose average age was (52.5 ± 2.4) years. Serum content of PGE-1 was determined, as well as activity of COX-1 by enzyme-linked immunosorbent assay, unsaturated fatty acid methyl esters by gas chromatography on a Chromatec Crystal 5000 chromatograph. Results. A decrease in the level of arachidonic acid before treatment was accompanied by reduced COX-1 activity and PGE-1 content in the blood serum. It was found a 3-fold decrease in the median level of arachidonic acid in the blood serum of 80 % of patients (24 of 30) compared to the controls. A significant increase in the median content of linoleic acid (by 4.5 times; p < 0.05) was found compared to the control group before treatment. There was a tendency to decrease by 1.5 times compared to the controls in the median level of α-linolenic acid (18:3, ω-3) as a source for the synthesis of arachidonic acid from ω-3 precursors. After treatment with Gastrotec®, a significant increase (by 4.3 times; p < 0.05) was found in the median serum level of arachidonic acid compared to the baseline. Such changes were detected in 73.3 % (22 of 30) of patients against 80.0 % (24 of 30) of those with reduced arachidonic acid content before treatment. In 76.7 % of patients, treatment with Gastrotec® increased the activity of COX-1, in 83.3 %, the content of PGE-1, and in 73.3 % of patients, the restoration of arachidonic acid synthesis was recorded. Conclusions. Therapy with Gastrotec® led to the restoration of arachidonic acid synthesis due to the use of precursors of its synthesis — linoleic and α-linolenic fatty acids in the blood serum of patients with erosive-ulcerative lesions of the stomach and duodenum caused by NSAIDs. Gastrotec® had a positive effect on most indicators of cyclooxygenase pathway of arachidonic acid metabolism in patients with erosive-ulcerative lesions of the stomach and duodenum caused by NSAIDs.
ерозивно-виразкові НПЗП-асоційовані ушкодження гастродуоденальної зони; ненасичені жирні кислоти; арахідонова кислота; циклооксигеназа; простагландин; Гастротек®
erosive-ulcerative NSAID-associated damage to the gastroduodenal area; unsaturated fatty acids; arachidonic acid; cyclooxygenase; prostaglandin; Gastrotec®
Вступ
Матеріали та методи
Результати
Обговорення
Висновки
- McEvoy L., Carr D.F., Pirmohamed M. Pharmacogenomics of NSAID-induced upper gastrointestinal toxicity. Front Pharmacol. 2021. № 12. P. 684162.
- Bjarnason I., Scarpignato C., Holmgren E., Olszewski M., Rainsford K.D., Lanas A. Mechanisms of damage to the gastrointestinal tract from nonsteroidal anti-inflammatory drugs. Gastroenterology. 2018. Vol. 154(3). P. 500-514.
- Wongrakpanich S., Wongrakpanich A., Melhado K., Rangaswami J. A comprehensive review of non-steroidal anti-inflammatory drug use in the elderly. AandD. 2018. Vol. 9(1). P. 143-150.
- Serhan C.N. Pro-resolving lipid mediators are leads for resolution physiology. Nature. 2014. Vol. 510(7503). P. 92-101.
- Sala A., Proschak E., Steinhilber D., Rovati G.E. Two-pronged approach to anti-inflammatory therapy through the modulation of the arachidonic acid cascade. Biochem Pharmacol. 2018. № 158. P. 161-173.
- Choque B., Catheline D., Rioux V., Legrand P. Linoleic acid: between doubts and certainties. Biochimie. 2014. № 96. P. 14-21.
- Taha A.S., Mccloskey C., Mcskimming P., Mcconnachie A. Misoprostol for small bowel ulcers in patients with obscure bleeding taking aspirin and non-steroidal anti-inflammatory drugs (masters): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Gastroenterol Hepatol. 2018. Vol. 3(7). P. 469-476.
- Kyaw M.H., Otani K., Ching J.Y.L., Higashimori A., Kee K.M., Watanabe T. et al. Misoprostol heals small bowel ulcers in aspirin users with small bowel bleeding. Gastroenterology. 2018. Vol. 155(4). P. 1090-1097.e1.
- Satoh H., Amagase K., Ebara S., Akiba Y., Takeuchi K. Cyclooxygenase (COX)-1 and COX-2 both play an important role in the protection of the duodenal mucosa in cats. J Pharmacol Ther. 2013. Vol. 344(1). P. 189-195.
- Тимощук О.В., Лембрик І.С., Кочерга З.Р. Простагландини — універсальні біорегулятори в організмі людини (огляд літератури). Запорізький медичний журнал. 2018. Т. 20. № 1(106). С. 121-127.
- Фадеенко Г.Д. Современные представления о гастропротекции: роль и место антацидных препаратов. Здоров’я України. 2015. № 2(36). С. 10-11.

/10.jpg)
/10_2.jpg)