Архив офтальмологии Украины Том 10, №3, 2022
Вернуться к номеру
Особливості розвитку діабетичного макулярного набряку і різних стадій діабетичної ретинопатії при цукровому діабеті 2-го типу
Авторы: Чугаєв Д.І.
Національний університет охорони здоров’я України імені П.Л. Шупика, м. Київ, Україна
Рубрики: Офтальмология
Разделы: Клинические исследования
Версия для печати
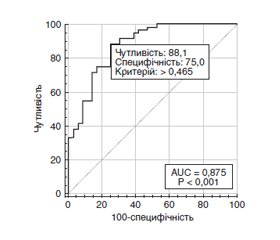
Актуальність. При початковому діагнозі цукрового діабету (ЦД) понад 25 % хворих уже мають ранню стадію діабетичної ретинопатії (ДР), а 60–80 % хворих із тривалістю ЦД 2-го типу понад 20 років мають ДР різного ступеня тяжкості. Близько половини пацієнтів з ДР з високою імовірністю матимуть сліпоту протягом 5 років захворювання, що обумовлено високим ризиком розвитку діабетичного макулярного набряку (ДМН). Мета дослідження: встановити особливості розвитку діабетичного макулярного набряку і різних стадій діабетичної ретинопатії при цукровому діабеті 2-го типу. Матеріали та методи. Дослідження включало 124 пацієнтів (124 ока) із ЦД 2-го типу, у яких за класифікацією ETDRS виявлена легка (29 очей, 1-ша група), помірна або тяжка (35 очей, 2-га група) непроліферативна ДР і проліферативна ДР (31 око, 3-тя група); контрольну групу становили 29 хворих без ЦД. Усім пацієнтам були виконані загальноприйняті офтальмологічні дослідження, спектрально-доменна оптична когерентна томографія (ОКТ) з визначенням центральної товщини сітківки (ЦТС, мкм). ДМН встановлювали, якщо при виконанні спектрально-доменної ОКT за протоколом ETDRS показники ЦТС перевищували значення нормативної бази даних. Для статистичних досліджень використано програмні пакети MedStat і MedCalc v.15.1 (MedCalc Software bvba). Результати. За віком наймолодшими були пацієнти з проліферативною ДР (на 6,2–6,4 року; p = 0,002). При цьому тривалість діабету була найбільшою саме в цих пацієнтів (12 років; p < 0,001). Частота ДМН серед пацієнтів з ДР становила 62,1 %. Вірогідної різниці щодо його частоти по групах пацієнтів із ДР виявлено не було (p > 0,2). Однофакторний регресійний аналіз виявив зниження (р < 0,001) ризику виникнення ДМН зі зростанням гостроти зору (СШ = 0,05; 95% ДІ 0,01–0,22) і зростання (р < 0,001) ризику ДМН із зростанням ЦТС (СШ = 1,02; 95% ДІ 1,01–1,03). Багатофакторний регресійний аналіз відібрав 3 значущих фактори ризику ДМН: тривалість діабету, гострота зору і ЦТС. Модель, що була побудована на виділених ознаках, адекватна (χ2 = 45,4; р < 0,001) при чутливості 88,1 % (95% ДІ 77,1–95,1 %) і специфічності 75,0 % (95% ДІ 57,8–87,9 %). Висновки. Наше дослідження показало відсутність прямої залежності ДМН від стадій ДР і дозволило визначити прогностичні ознаки його розвитку.
Background. At the initial diagnosis of diabetes mellitus (DM), more than 25 % of patients already have an early stage of diabetic retinopathy (DR), and 60–80 % of people with type 2 diabetes lasting more than 20 years have DR of various degrees of severity. About half of patients with DR are highly likely to be blind within 5 years of the disease, due to the high risk of diabetic macular edema (DME). The purpose is to determine the features of DME development and different stages of DR in type 2 DM. Materials and methods. The study included 124 patients (124 eyes) with type 2 DM who had mild (29 eyes, group 1), moderate or severe (35 eyes, group 2) non-proliferative DR and proliferative DR (31 eyes, group 3) according to the Early Treatment Diabetic Retinopathy Study (ETDRS) classification; the control group consisted of 29 eyes without diabetes. All patients underwent standard ophthalmological examinations, spectral-domain optical coherence tomography with determination of the central retinal thickness (CRT, μm). DMN was detected if, when performing a spectral-domain optical coherence tomography according to the ETDRS protocol, the CRT indicators exceeded the values of the normative database. MedStat and MedCalc v.15.1 software packages (MedCalc Software bvba) were used for statistical research. Results. By age, patients with proliferative DR were the youngest (by 6.2–6.4 years; p = 0.002). At the same time, the duration of diabetes was the longest in these patients (12 years; p < 0.001). The frequency of DME among patients with DR was 62.1 %. There was no significant difference in its frequency between groups of patients with DR (p > 0.2). Univariate regression analysis revealed a decrease (p < 0.001) in the risk of DME with the growth of visual acuity (odds ratio (OR) = 0.05; 95% confidence interval (CI) 0.01–0.22) and an increase (p < 0.001) in the risk of DME with the growth of CRT (OR = 1.02; 95% CI 1.01–1.03). Multivariate regression analysis selected 3 significant DME risk factors: duration of diabetes, visual acuity, and CRT. The model built on the selected features is adequate (χ2 = 45.4; p < 0.001), with a sensitivity of 88.1 % (95% CI 77.1–95.1 %) and a specificity of 75.0 % (95% CI 57.8–87.9 %). Conclusions. Our study showed the absence of direct dependence between DME and stages of DR, and made it possible to determine prognostic signs of its development.
діабетична ретинопатія; діабетичний макулярний набряк; цукровий діабет 2-го типу; особливості
diabetic retinopathy; diabetic macular edema; type 2 diabetes; features
Для ознакомления с полным содержанием статьи необходимо оформить подписку на журнал.
- Saeedi P., Petersohn I., Salpea P., Malanda B., Karuranga S., Unwin N. et al.; IDF Diabetes Atlas Committee. Global and regional diabetes prevalence estimates for 2019 and projections for 2030 and 2045: Results from the International Diabetes Federation Diabetes Atlas. 9th edition. Diabetes Res. Clin. Pract. 2019 Nov. 157. 107843. doi: 10.1016/j.diabres.2019.107843.
- Wong T.Y., Sabanayagam C. Strategies to tackle the glo–bal burden of diabetic retinopathy: from epidemiology to artificial intelligence. Ophthalmologica. 2020. 243(1). 9-20. doi: 10.1159/ 000502387.
- Teo Z.L., Tham Y.C., Yu M., Chee M.L., Rim T.H., Cheung N. et al. Global prevalence of diabetic retinopathy and Projection of Burden through 2045: systematic review and meta-analysis. Ophthalmology. 2021 Nov. 128(11). 1580-1591. doi: 10.1016/j.ophtha.2021.04.027.
- Sun H., Saeedi P., Karuranga S., Pinkepank M., Ogurtsova K., Duncan B.B. et al. IDF Diabetes Atlas: Global, regional and country-level diabetes prevalence estimates for 2021 and projections for 2045. Diabetes Res. Clin. Pract. 2022 Jan. 183. 109119. doi: 10.1016/j.diabres.2021.109119.
- Leasher J.L., Bourne R.R., Flaxman S.R., Jonas J.B., Keeffe J., Naidoo K. et al. Vision Loss Expert Group of the global burden of disease study. Global estimates on the number of people blind or visually impaired by diabetic retinopathy: a meta-analysis from 1990 to 2010. Diabetes Care. 2016 Sep. 39(9). 1643-9. doi: 10.2337/dc15-2171.
- GBD 2019 blindness and vision impairment collaborators; Vision Loss Expert Group of the Global Burden of Disease Study. Causes of blindness and vision impairment in 2020 and trends over 30 years, and prevalence of avoidable blindness in relation to VISION 2020: the Right to Sight: an analysis for the Global Burden of Disease Study. Lancet Glob. Health. 2021 Feb. 9(2). e144-e160. doi: 10.1016/S2214-109X(20)30489-7.
- Zhu Y., Hu J., Du X., Fang Q., Zhou Y., Chen K. Correlation of serum delta-like ligand-4 level with the severity of diabetic retino–pathy. BMC Endocr. Disord. 2021 Aug 6. 21(1). 157. doi: 10.1186/s12902-021-00814-6.
- Rossino M.G., Dal Monte M., Casini G. Relationships bet–ween neurodegeneration and vascular damage in diabetic retinopathy. Front. Neurosci. 2019 Nov 8. 13. 1172. doi: 10.3389/fnins.2019.01172.
- Могилевский С.Ю., Панченко Ю.А. Особенности диабетической макулопатии у больных сахарным диабетом 2-го типа. Архів офтальмології України. 2018. 6(2). 28-32.
- Могілевський С.Ю., Панченко Ю.О., Зябліцев С.В. Прогнозування ризику діабетичного діабетичного макулярного набряку при діабетичній ретинопатії у хворих на цукровий діабет 2 типу. Офтальмологічний журнал. 2019. 3. 3-8.
- Early Treatment Diabetic Retinopathy Study Research Group. Grading diabetic retinopathy from stereoscopic color fundus photographs — an extension of the modified Airlie house classification: ETDRS report № 10. Ophthalmology. 2020 Apr. 127(4S). 99-119. doi: 10.1016/j.ophtha.2020.01.030.
- Гур’янов В.Г., Лях Ю.Є., Парій В.Д., Короткий О.В., Чалий О.В., Чалий К.О., Цехмістер Я.В. Посібник з біостатистики. Аналіз результатів медичних досліджень у пакеті EZR (R-statistics). Київ: Вістка, 2018. 208 с.
- Наказ МОЗ України від 21.12.2012 № 1118 «Про затвердження та впровадження медико-технологічних документів зі стандартизації медичної допомоги при цукровому діабеті 2 типу». Уніфікований клінічний протокол первинної та вторинної (спеціалізованої) медичної допомоги «Цукровий діабет тип 2». Київ, 2012. 118 с.
- Harding J.L., Pavkov M.E., Magliano D.J., Shaw J.E., Gregg E.W. Global trends in diabetes complications: a review of current evidence. Diabetologia. 2019. 62(1). 3-16. doi: 10.1007/s00125-018-4711-2
- Browning D.J., Stewart M.W., Lee C. Diabetic macular edema: Evidence-based management. Indian J. Ophthalmol. 2018 Dec. 66(12). 1736-1750. doi: 10.4103/ijo.IJO_1240_18. PMID: 30451174; PMCID: PMC6256891.
- Le N.T., Kroeger Z.A., Lin W.V., Khanani A.M., Weng C.Y. Novel treatments for diabetic macular edema and proliferative diabe–tic retinopathy. Curr. Diab. Rep. 2021 Nov 1. 21(10). 43. doi: 10.1007/s11892-021-01412-5. PMID: 34719742.
- Romero-Aroca P., Baget-Bernaldiz M., Pareja-Rios A., Lopez-Galvez M., Navarro-Gil R., Verges R. Diabetic macular edema pathophysiology: vasogenic versus inflammatory. J. Diabetes Res. 2016. 2016. 2156273. doi: 10.1155/2016/2156273. Epub 2016 Sep 28. PMID: 27761468; PMCID: PMC5059543.
- Bandello F., Battaglia Parodi M., Lanzetta P., Loewenstein A., Massin P., Menchini F., Veritti D. Diabetic Macular Edema. Dev. Ophthalmol. 2017. 58. 102-138. doi: 10.1159/000455277. Epub 2017 Mar 28. PMID: 28351052.
- Suciu C.I., Suciu V.I., Nicoara S.D. Optical coherence tomography (angiography) biomarkers in the assessment and monitoring of diabetic macular edema. J. Diabetes Res. 2020 Dec 31. 2020. 6655021. doi: 10.1155/2020/6655021. PMID: 33490283; PMCID: PMC7790580.
- Hui V.W.K., Szeto S.K.H., Tang F., Yang D., Chen H., Lai T.Y.Y. et al. Optical coherence tomography classification systems for diabetic macular edema and their associations with visual outcome and treatment responses — an updated review. Asia Pac. J. Ophthalmol. (Phila). 2022 Jun 1. 11(3). 247-257. doi: 10.1097/APO.0000000000000468. PMID: 34923521.
- Turkseven Kumral E., Ercalık N.Y., Alpogan O., Yene–rel N.M., Ozcelik Kose A., Ozturk Y., Acar Z.A. OCT biomarkers of treatment-naive diabetic macular edema in patients with non-proliferative and proliferative diabetic retinopathy. Eur. J. Ophthalmol. 2022 Sep 21. 11206721221128674. doi: 10.1177/11206721221128674. Epub ahead of print. PMID: 36131383.
- Busch C., Katzmann J.L., Jochmann C., Unterlauft J.D., Vollhardt D., Wiedemann P., Laufs U., Rehak M. General health of patients with diabetic macular edema-The LIPSIA study. PLoS One. 2021 Jun 11. 16(6). e0252321. doi: 10.1371/journal.pone.0252321. PMID: 34115786; PMCID: PMC8195383.
- Li Z., Deng X., Zhou L., Lu T., Lan Y., Jin C. Nomogram-based prediction of clinically significant macular edema in diabetes mellitus patients. Acta Diabetol. 2022 Sep. 59(9). 1179-1188. doi: 10.1007/s00592-022-01901-3. Epub 2022 Jun 24. PMID: 35739321.
- Ozsaygili C., Duru Z., Cicek A., Ulusoy D.M., Demirtas A.A., Duru N. The effect of age on Aflibercept (Eylea) response in diabetic macular edema. Retina. 2020 Jun. 40(6). 1038-1043. doi: 10.1097/IAE.0000000000002504. PMID: 30897067.