Журнал «Здоровье ребенка» Том 16, №8, 2021
Вернуться к номеру
Етіопатогенетичні особливості гіперпролактинемії в дитячому віці
Авторы: Абатуров О.Є., Нікуліна А.О., Русакова О.О.
Дніпровський державний медичний університет, м. Дніпро, Україна
Рубрики: Педиатрия/Неонатология
Разделы: Справочник специалиста
Версия для печати
Останніми роками проблема гіперпролактинемії в дитячому віці залишається актуальною, тому що остання належить до найбільш поширеної патології гіпоталамо-гіпофізарної системи, спричинюючи порушення фертильності та репродуктивної функції в дорослому віці. За даними популяційних досліджень, її зустрічальність становить 0,5 % у представниць жіночої статі, перевищуючи цей показник в 10 разів порівняно з особами чоловічої статі. Пролактин надає імуномодулюючий ефект, посилюючи проліферацію лімфоцитів, фагоцитарну здатність макрофагів, синтез імуноглобуліну A, знеболюючий ефект; сприяє постнатальному росту тіла, індукуючи активність генів, асоційованих зі зростанням; активує проліферацію кератиноцитів, епітеліальних клітин передміхурової залози; бере участь у регуляції обміну речовин, водно-електролітного балансу, інгібуючи екскрецію іонів калію і натрію нирками; впливає на поведінку людини, прискорюючи нейрогенез, запам’ятовування, навчання та забезпечуючи нейропротекцію; індукує продукцію сурфактанта; стимулює ліпогенез. Рівень пролактину підвищується внаслідок фізіологічної гіперестрогенемії, що блокує інгібуючий вплив дофаміну на секрецію пролактину та відбувається при лактації, вагітності й деяких інших фізіологічних станах. Патологічна гіперпролактинемія трапляється у дітей із вторинним гіпогонадотропним гіпогонадизмом, органічними ураженнями супраселярної ділянки головного мозку та може мати вторинний (симптоматичний) характер. В етіологічній структурі синдрому гіперпролактинемії найбільша питома вага в дітей та підлітків (у 60 % випадків) належить пролактиномам (аденомам гіпофіза, що секретують пролактин), ідіопатичній гіперпролактинемії (у 22,7 %) та ятрогенній гіперпролактинемії, що індукована прийомом лікарських засобів (у 6,4 % випадків). З огляду на те, що левова частка гіперпролактинемій у дитячому віці пов’язана з наявністю пролактином гіпофіза, що характеризуються латентним поступовим прогресуванням репродуктивних порушень, процесів зростання та неврологічної симптоматики, метою даної статті є зосередження уваги практикуючих лікарів на плейотропності дії пролактину в організмі, що контролює понад 300 біологічних функцій, епідеміологічних, етіологічних і патогенетичних механізмах, особливостях клінічної класифікації гіперпролактинемій для формування сучасного уявлення стосовно зазначеної проблеми.
In recent years, the problem of hyperprolactinemia in children remains relevant because it is one of the most common pathologies of the hypothalamic-pituitary system, causing impaired fertility and reproductive function in adulthood. According to population studies, its incidence is 0.5 % in females, exceeding this figure in males by 10 times. Prolactin has: immunomodulatory effect, enhancing lymphocyte proliferation, phagocytic capacity of macrophages, IgA synthesis; analgesic effect; promotes postnatal growth of the body by inducing the activity of genes associated with growth; activates the proliferation of keratinocytes, epithelial cells of the prostate; participates in the regulation of metabolism, water-electrolyte balance, inhibiting the excretion of potassium and sodium ions by the kidneys; influences human behavior by accelerating neurogenesis, memory, learning and providing neuroprotection; induces surfactant production; stimulates lipogenesis. Prolactin levels increase due to physiological hyperestrogenemia, which blocks the inhibitory effect of dopamine on prolactin secretion and occurs during lactation, pregnancy and some other physiological states. Pathological hyperprolactinemia occurs in children with secondary hypogonadotropic hypogonadism, organic lesions of the suprasellar area of the brain and may be secondary (symptomatic). In the etiological structure of hyperprolactinemia syndrome, the largest proportion (60 %) in children and adolescents belongs to prolactinomas (pituitary adenomas that secrete prolactin), idiopathic hyperprolactinemia (22.7 %) and iatrogenic hyperprolactinemia induced by 6 drugs (4 % of cases). Given that the lion’s share of hyperprolactinemia in childhood is associated with the presence of pituitary prolactinoma, characterized by latent gradual progression of reproductive disorders, growth processes and neurological symptoms, the objective of this article is to focus on the pleiotropic effects of prolactin in the body, which controls more than 300 biological functions, epidemiological, etiological and pathogenetic mechanisms, on the features of the clinical classification of hyperprolactinemia to form a modern understanding of this problem.
пролактин; гіперпролактинемія; пролактиноми; гіпогонадизм; діти
prolactin; hyperprolactinemia; prolactinomas; hypogonadism; children
Вступ
Епідеміологія
Етіологія та класифікація синдрому гіперпролактинемії
Ген, хімічна будова, функції пролактину та контроль його секреції
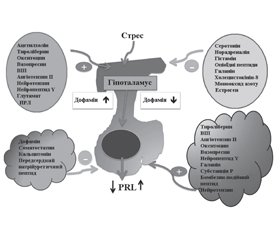
Патогенез
- Абатуров О.Є., Нікуліна А.О., Петренко Л.Л. Акромегалія та гіпофізарний гігантизм у дітей. К.: Логос, 2020. 98 с.
- Воротникова С.Ю., Дзеранова Л.К., Пигарова Е.А. и др. Эндокринные нарушения при наличии кисты кармана Ратке: представление клинического случая. Ожирение и метаболизм. 2016. 13(4). 45-48. doi: 10.14341/OMET2016445-48.
- Дедов И.И., Мельниченко Г.А., Романцова Т.И. и др. Гиперпролактинемия. Современные подходы и старые проблемы. 2009. 2. 2-8.
- Тронько М.Д., Антипкін Ю.Г., Камінський В.В. та ін. Національний консенсус щодо ведення пацієнтів із гіперпролактинемією 2016. Медичні аспекти здоров’я жінки. 2017. 1(106). 32-42.
- Bolyakov A., Paduch D.A. Prolactin in men's health and disease. Curr. Opin. Urol. 2011 Nov. 21(6). 527-34. doi: 10.1097/MOU.0b013e32834bdf01].
- Cabrera-Reyes E.A., Limón-Morales O., Rivero-Segura N.A., Camacho-Arroyo I., Cerbón M. Prolactin function and putative expression in the brain. Endocrine. 2017 Aug. 57(2). 199-213. doi: 10.1007/s12020-017-1346-x.
- Chaurasia P.K., Singh D., Meher S., Saran R.K., Singh H. Epistaxis as first clinical presentation in a child with giant prolactinoma: Case report and review of literature. J. Pediatr. Neurosci. 2011 Jul. 6(2). 134-7. doi: 10.4103/1817-1745.92840.
- Colao A., Loche S. Prolactinomas in children and adolescents. Endocr. Dev. 2010. 17. 146-159. doi: 10.1159/000262536.
- Cookson J., Hodgson R., Wildgust H.J. Prolactin, hyperprolactinaemia and antipsychotic treatment: a review and lessons for treatment of early psychosis. J. Psychopharmacol. 2012 May. 26 (5 Suppl). 42-51. doi: 10.1177/0269881112442016.
- Donato J. Jr., Frazão R. Interactions between prolactin and kisspeptin to control reproduction. Arch. Endocrinol. Metab. 2016 Nov-Dec. 60(6). 587-595. doi: 10.1590/2359-3997000000230.
- Eren E., Törel Ergür A., İşgüven Ş.P. et al. Clinical and Laboratory Characteristics of Hyperprolactinemia in Children and Adolescents: National Survey. J. Clin. Res. Pediatr. Endocrinol. 2019. 11(2). 149-156. doi: 10.4274/jcrpe.galenos.2018.2018.0206.
- Eren E., Yapıcı Ş., Çakır E.D., Ceylan L.A., Sağlam H., Tarım Ö. Clinical course of hyperprolactinemia in children and adolescents: a review of 21 cases. J. Clin. Res. Pediatr. Endocrinol. 2011. 3(2). 65-9. doi: 10.4274/jcrpe.v3i2.14.
- Fideleff H.L., Boquete H.R., Suárez M.G., Azaretzky M. Prolactinoma in children and adolescents. Horm. Res. 2009. 72(4). 197-205.
- Freeman M.E., Kanyicska B., Lerant A., Nagy G. Prolactin: structure, function, and regulation of secretion. Physiol. Rev. 2000 Oct. 80(4). 1523-631. doi: 10.1152/physrev.2000.80.4.1523.
- Gass S., Harris J., Ormandy C., Brisken C. Using gene expression arrays to elucidate transcriptional profiles underlying prolactin function. J. Mammary Gland Biol. Neoplasia. 2003 Jul. 8(3). 269-85. doi: 10.1023/b:jomg.0000010029.85796.63.
- Hargreaves A., Harleman J. Preclinical risk assessment of drug-induced hypo- and hyperprolactinemia. J. Appl. Toxicol. 2011 Oct. 31(7). 599-607. doi: 10.1002/jat.1723.
- Inder W.J., Castle D. Antipsychotic-induced hyperprolactinaemia. Aust. N. Z. J. Psychiatry. 2011 Oct. 45(10). 830-7. doi: 10.3109/00048674.2011.589044.
- Katavetin P., Cheunsuchon P., Swearingen B., Hedley-Whyte E.T., Misra M., Levitsky L.L. Review: Pituitary adenomas in children and adolescents. J. Pediatr. Endocrinol. Metab. 2010 May. 23(5). 427-31. doi: 10.1515/jpem.2010.072.
- Keskin M.Z., Budak S., Aksoy E.E., Yücel C., Karamazak S., Ilbey Y.O., Kozacıoğlu Z. Investigation of the effect of body mass index (BMI) on semen parameters and male reproductive system hormones. Arch. Ital. Urol. Androl. 2017 Oct 3. 89(3). 219-221. doi: 10.4081/aiua.2017.3.219.
- Koch L. New Endocrine Society guidelines for hyperprolactinemia-piecing together the pituitary puzzle. Nat. Rev. Endocrinol. 2011 May. 7(5). 247. doi: 10.1038/nrendo.2011.43.
- Langan E.A., Ramot Y., Hanning A., Poeggeler B., Bíró T., Gaspar E., Funk W., Griffiths C.E., Paus R. Thyrotropin-releasing hormone and oestrogen differentially regulate prolactin and prolactin receptor expression in female human skin and hair follicles in vitro. Br. J. Dermatol. 2010 May. 162(5). 1127-31. doi: 10.1111/j.1365-2133.2010.09676.x.
- Lkhider M., Seddiki T., Ollivier-Bousquet M. La prolactine et son fragment 16 kDa dans les tissus de mammifères [Prolactin and its cleaved 16 kDa fragment]. Med. Sci. (Paris). 2010 Dec. 26(12). 1049-55. French. doi: 10.1051/medsci/201026121049.
- Mancini T., Casanueva F.F., Giustina A. Hyperprolactinemia and prolactinomas. Endocrinol. Metab. Clin. North Am. 2008 Mar. 37(1). 67-99, viii. doi: 10.1016/j.ecl.2007.10.013.
- McNamara A.V., Awais R., Momiji H., Dunham L. et al. Transcription Factor Pit-1 Affects Transcriptional Timing in the Dual-Promoter Human Prolactin Gene. Endocrinology. 2021 Apr 1. 162(4). bqaa249. doi: 10.1210/endocr/bqaa249].
- Melmed S., Casanueva F.F., Hoffman A.R., Kleinberg D.L., Montori V.M., Schlechte J.A., Wass J.A. Endocrine Society. Diagnosis and treatment of hyperprolactinemia: an Endocrine Society clinical practice guideline. J. Clin. Endocrinol. Metab. 2011 Feb. 96(2). 273-88. doi: 10.1210/jc.2010-1692.
- Owerbach D., Rutter W.J., Cooke N.E., Martial J.A., Shows T.B. The prolactin gene is located on chromosome 6 in humans. Science. 1981 May 15. 212(4496). 815-6. doi: 10.1126/science.7221563. PMID: 7221563
- Prabhakar V.K., Davis J.R. Hyperprolactinaemia. Best Pract. Res. Clin. Obstet. Gynaecol. 2008 Apr. 22(2). 341-53. doi: 10.1016/j.bpobgyn.2007.08.002.
- Ramírez-de-Arellano A., Villegas-Pineda J.C., Hernández-Silva C.D., Pereira-Suárez A.L. The Relevant Participation of Prolactin in the Genesis and Progression of Gynecological Cancers. Front Endocrinol. (Lausanne). 2021 Oct 21. 12. 747810. doi: 10.3389/fendo.2021.747810.
- Robin P., Boulven I., Bôle-Feysot C., Tanfin Z., Leiber D. Contribution of PKC-dependent and -independent processes in temporal ERK regulation by ET-1, PDGF, and EGF in rat myometrial cells. Am. J. Physiol. Cell Physiol. 2004 Apr. 286(4). C798-806. doi: 10.1152/ajpcell.00465.2003.
- Rybakowski J.K., Dmitrzak-Weglarz M., Kapelski P., Hauser J. Functional 1149 g/t polymorphism of the prolactin gene in schizophrenia. Neuropsychobiology. 2012. 65(1). 41-4. doi: 10.1159/000329028.
- Seida J.C., Schouten J.R., Boylan K., Newton A.S., Mousavi S.S., Beaith A., Vandermeer B., Dryden D.M., Carrey N. Antipsychotics for children and young adults: a comparative effectiveness review. Pediatrics. 2012 Mar. 129(3). e771-84. doi: 10.1542/peds.2011-2158. Epub 2012 Feb 20. PMID: 22351885
- Serri O., Chik C.L., Ur E., Ezzat S. Diagnosis and management of hyperprolactinemia. CMAJ. 2003. 6(169). 575-581.
- Triebel J., Bertsch T., Bollheimer C., Rios-Barrera D., Pearce C.F., Hüfner M., Martínez de la Escalera G., Clapp C. Principles of the prolactin/vasoinhibin axis. Am. J. Physiol. Regul. Integr. Comp. Physiol. 2015 Nov 15. 309(10). R1193-203. doi: 10.1152/ajpregu.00256.2015.
- Trifanescu R., Stavrinides V., Plaha P. et al. Outcome in surgically treated Rathke's cleft cysts: long-term monitoring needed. European Journal of Endocrinology. 2011. 165(1). 33-37. doi: 10.1530/eje-11-0142].
- Trott J.F., Schennink A., Petrie W.K., Manjarin R., van Klompenberg M.K., Hovey R.C. Triennial Lactation Symposium: Prolactin: The multifaceted potentiator of mammary growth and function. J. Anim. Sci. 2012 May. 90(5). 1674-86. doi: 10.2527/jas.2011-4682.
- Vilar L., Vilar C.F., Lyra R., Freitas M.D.C. Pitfalls in the Diagnostic Evaluation of Hyperprolactinemia. Neuroendocrinology. 2019. 109(1). 7-19. doi: 10.1159/000499694.

/41.jpg)
/42.jpg)
/43.jpg)