Вступ
Діти, що часто хворіють (ДЧХ), втомлені від постійних відвідувань поліклініки і кабінетів лікаря, від постійного лікування — пігулок, мікстур, нескінченних процедур, ще гірше — від болючих уколів, інколи навіть операцій. Втомлені їх батьки, що прикладають чимало зусиль, сумлінно виконуючи всі рекомендації лікарів. Втомлені і самі лікарі, в яких вичерпується запас задумок і ліків, а матір з дитиною знову стоять на порозі лікарського кабінету із соплями і кашлем та німим докором у погляді. Нерідко педіатр сумно каже: «Я вже навіть не знаю, що з вами робити. Може зачекаємо, дитина виросте, і воно саме пройде». Але нерідко само не проходить. На жаль, такий спосіб існування з тривалими поневіряннями у поліклініках та лікарнях часто зберігається потім у людини, що виросла, на все доросле життя.
Проблемі діагностики та лікування ДЧХ присвячено багато думок і рекомендацій досвідчених лікарів-педіатрів, фахівців профільних кафедр медуніверситетів, імунологів, алергологів, реабілітологів. Чимало сайтів відомих і не дуже клінік дають пояснення і поради батькам з приводу «що відбувається» та «що робити». Але проблема залишається: нові покоління дітей знову і знову йдуть по тому самому сумному колу постійних хвороб та постійного лікування, сякаючись та відкашлюючись на ходу майже без зупинки. Подивимось, що сьогодні пишуть у спеціальній медичній літературі та в мережі Інтернет щодо ДЧХ про те, чому це з ними відбувається і як можна змінити їхню нелегку долю.
Термін «дитина, що часто хворіє» досить широко відомий серед учених і практиків. Однак, незважаючи на масштабні дослідження з цієї проблеми, дотепері існує низка розбіжностей у питаннях термінології, нозологічного складу, етіопатогенезу, лікування, профілактики та диспансерного спостереження цієї категорії пацієнтів. За сучасною термінологією, замість терміна «ДЧХ» наразі використовують назву «рекурентні респіраторні захворювання (Recurrent Respiratory Diseases, RRD) дитини», які розглядають як головну причину частих захворювань, занепокоєння батьків, звернення до лікаря, пропусків дитячого садка і школи, госпіталізації [1]. Однією з основних причин повторних респіраторних симптомів вважають алергію, для лікування якої розроблена відповідна специфічна терапія. Тільки у 1,5 % дітей з RRD знаходять серйозні, але не імунні порушення, а більшість таких дітей, що часто хворіють на гострі респіраторні інфекції, вважають взагалі здоровими. Однак чому вони постійно хворіють? Вважають, що 6–10 епізодів гострої респіраторної вірусної інфекції (ГРВІ) на рік деяким дітям необхідні, щоб у них сформувався імунітет проти різних респіраторних вірусів. До тригерних факторів RRD належать відвідування організованих дошкільних колективів, пасивне тютюнопаління, забруднення повітря в містах.
Кого вважають дитиною, що часто хворіє? У вітчизняній медицині такими дітьми вважаються діти, в яких випадки гострих респіраторних захворювань (ГРЗ) та/або ГРВІ, між якими важко провести чітку діагностичну межу, реєструють 4–6 і більше разів на рік. Частота випадків таких захворювань зазвичай має сезонний характер, суттєво збільшуючись у перехідні періоди: навесні та з настанням осінніх погодних негараздів. Але нерідко дитина постійно хворіє навіть серед жаркого літа, коли, здавалося б, і приводів для цього немає. У багатьох випадках батьки майже не бачать свою дитину здоровою, оскільки наступна «застуда» майже без перерви змінює попередню. Змінюється навіть характер батьківських скарг, коли на запитання лікаря, що їх турбує, вони відповідають: «Дитина часто хворіє». До категорії ДЧХ зараховують також дітей, що хворіють не тільки часто, але і тривалий час (понад 10–14 днів один епізод ГРЗ). Якщо гострі та рекурентні респіраторні захворювання вірусного походження в епідеміологічному плані більше пов’язані з новим чи додатковим зараженням зовні, переважно в організованих дитячих колективах, то гнійно-запальні захворювання, що рецидивують, зазвичай розвиваються як загострення хронічної ендогенної інфекції бактеріального походження.
Останніми роками поняття «діти, що часто хворіють» змінюється: наприклад, за статистикою ВООЗ, якщо дитина віком до 5 років застуджується навіть 6–8 разів на рік, то це можна вважати нормою. Нову статистику ВООЗ наразі підтримує і відомий педіатр доктор Комаровський, який в одному із своїх виступів заявив, що «звичайна, нормальна дитина, яка відвідує дитячий садок або школу, повинна хворіти на ГРВІ від 6 до 12 разів на рік. Це говорить про те, що вона не тільки часто хворіє, а й часто одужує». Та існує певне «але». По-перше, треба відзначити, що в дітей, які так часто хворіють, на жаль, клінічна межа між одужанням і наступним захворюванням зазвичай мало помітна або взагалі відсутня. А по-друге, хворіти 6–12 разів на рік не є обов’язком кожної дитини, яка відвідує дитячий колектив. Не становлять винятку діти, які, на радість своїм батькам, хворіють на ГРВІ не більше 3–4 разів на рік.
У дітей, що часто хворіють, спостерігають характерні ознаки респіраторної вірусної інфекції: виділення з носа, підвищена температура, нежить, почервоніння та біль у горлі, кашель, слабкість і млявість, втрата апетиту. Інколи в таких дітей у клінічній картині захворювання може домінувати якийсь один, але довготривалий симптом, наприклад, постійний кашель або навіть частіше — підкашлювання, кольорові виділення з носа, при цьому температура може залишатися нормальною. Окремо наголошують, що коли в дитини постійно субфебрильно підвищена температура, але при цьому немає симптомів ГРЗ, це здебільшого є ознакою хронічних інфекцій різної локалізації і вимагає детального додаткового медичного обстеження. Зазвичай згадують: про хронічний тонзиліт, часто рекомендуючи батькам з метою позбутися стійкої субфебрильної температури видалення мигдаликів; про запалення у жовчному міхурі та жовчовивідних протоках, насамперед лямбліозного походження, призначаючи неодноразові курси антипротозойного лікування; про вірус Епштейна — Барр, довгий час тримаючи дитину на противірусних препаратах та призначаючи повторні введення різних імуноглобулінів, нерідко закордонного виробництва і дуже дорогих тощо.
Переважна більшість фахівців вважають, що у ДЧХ формується своєрідне порочне коло: на тлі ослабленого імунітету дитина хворіє на ГРЗ, які, так само, ще більше послаблюють імунітет. Через підвищену чутливість організму до різних інфекційних агентів і зниження захисних механізмів є велика ймовірність розвитку хронічних, уповільнених інфекційних і неінфекційних захворювань: гастриту, виразкової хвороби шлунка та дванадцятипалої кишки, бронхіальної астми, хронічних гайморитів, етмоїдитів, пансинуситів тощо. Наявність хронічних інфекцій може призвести до відставання у фізичному розвитку, додаткової алергізації дитячого організму, що може залишитися на все життя.
Найважливішими вважають вогнища хронічної інфекції у носоглотці. Наголошують, що найчастіше хворіють на повторні застуди та грип діти з недолікованими ринітами, фарингітами, хронічним тонзилітом із постійно збільшеними мигдаликами та гнійними пробками. Як причину постійних простудних захворювань, а також джерело виникнення частих отитів, гайморитів, гнійних ринофарингітів, хронічних ангін, бронхітів, порушень слуху розглядають аденоїди. Хоча зрозуміло, що при такому погляді порушується причинно-наслідковий зв’язок: аденоїди є одним із наслідків та проявів частих захворювань дитини, а не їх причиною. Справедливо наголошують, що такі повільно тліючі інфекції призводять до отруєння організму, його хронічної інтоксикації. Токсичні речовини послаблюють імунну систему дитини і не дають їй ефективно чинити опір хворобі. Але, на жаль, про етіологічну складову цього хронічного вогнища бактеріальної інфекції у носоглотці майже не йдеться і це не обговорюється.
Головне запитання, на яке намагаються відповідати зневіреним батькам педіатри, просте і дуже складне одночасно: чому дитина часто хворіє? І тут головною та майже стандартною відповіддю є саме згадування про імунітет: якщо дитина часто або тривало хворіє, це, за словами лікаря, означає, що її імунітет ослаблений (варіанти — поганий, пригнічений, дефіцитний, відсутній, нульовий тощо). Справедливо розглядають наступні основні фактори, що призводять до ослаблення імунітету дитини.
Оскільки функції імунної системи починають формуватися ще під час внутрішньоутробного розвитку плода, то зараження TORCH-інфекціями під час вагітності, недоношеність або морфофункціональна незрілість малюка можуть сприяти тому, що дитина після народження стане часто хворіти. Наступним важливим фактором для формування імунітету є материнське молоко, тому діти, які знаходяться на грудному вигодовуванні, рідше хворіють на ГРЗ, і, навпаки, ранній перехід на штучні суміші може призвести до того, що вже на першому році життя дитина почне хворіти на застудні захворювання. Встановлено, що у віці 1,5 місяця за умови грудного вигодовування у складі мікробіоценозу верхніх дихальних шляхів (ВДШ) дитини домінують роди Dolosigranulum і Corynebacterium, а при штучному вигодовуванні значно збільшується представництво S. aureus [2]. Хоча ця відома істина не завжди відповідає клінічному досвіду: серед ДЧХ немало малюків, які через сліпу материнську любов упродовж 2–3 років продовжують отримувати вже не потрібне їм грудне молоко.
На першому році життя або в більш старшому віці у малюка через різні несприятливі фактори можуть розвинутися фонові стани, що ослабляють імунітет. Це — дисбактеріоз кишечника, гіповітаміноз, рахіт, непереносимість лактози або глютену тощо. Дуже рідко, але трапляються вроджені імунодефіцитні стани (генетичні або ембріопатії), зокрема вибіркові імунодефіцити, коли у дитини порушена якась одна ланка імунної системи: гуморальна, клітинна, комбінована, недостатність системи комплементу, дефекти фагоцитозу. Одним із найбільш вірогідних клінічних проявів вроджених імунодефіцитних станів є рецидивуючі та хронічні інфекції верхніх дихальних шляхів, придаткових пазух носа, шкіри, слизових оболонок, шлунково-кишкового тракту внаслідок наявності опортуністичних бактерій, найпростіших, грибів. Такі захворювання на тлі імунодефіцитного стану мають тенденцію до генералізації, септицемії та торпідні до звичайної терапії. Тому якщо дитина постійно хворіє на однотипні захворювання, наприклад на рецидивуючу молочницю, хронічну інфекцію ЛОР-органів та інше, рекомендація обстежити її щодо існування вродженої імунопатії не буде зайвою.
Серед причин погіршення нормального функціонування імунітету дитини та його послаблення сьогодні наголошують на великому значенні правильного збалансованого харчування і режимі. На думку багатьох педіатрів, дитина може часто і тривало хворіти, якщо в її раціоні не вистачає вітамінів або харчування незбалансоване, наприклад відсутні продукти тваринного походження або їжа містить велику кількість вуглеводів, але мало білків і жирів. Якщо дитина рідко перебуває на свіжому повітрі, веде малорухливий спосіб життя, вдихає тютюновий дим від курців-дорослих, це може призвести до ослаблення її імунітету.
Тобто більшість фахівців вважають, що існує пряма залежність між частими захворюваннями дитини та ослабленням її імунітету внаслідок дії вроджених або набутих причин, умов та режиму життя, харчування, закалювання. Загальнодомінуючою думкою серед лікарів різних спеціальностей є твердження, що часті ГРЗ у переважній більшості випадків слід розглядати як наслідок вторинного імунодефіциту: тобто дитина народилася нормальною, але під впливом певних зовнішніх чинників її імунітет або не розвивається, або чимось пригнічується. Наголошують: якщо дитина часто хворіє, потрібно регулярно використовувати загальнозміцнюючі та профілактичні заходи (вітамінотерапія, збалансоване харчування, спортивні вправи, прогулянки на свіжому повітрі тощо). Для лікування ДЧХ рекомендують призначати медикаментозні препарати неспецифічного впливу (адаптогени, біогенні стимулятори та ін.), а також проводити імунокорекцію специфічними препаратами, спрямованими на певні ланки імунної системи, — імуноглобулінами, інтерферонами, імуномодуляторами. Дітей, що часто хворіють через ослаблений імунітет, лікарі рекомендують додатково вакцинувати від грипу, вітряної віспи, пневмококової, гемофільної та менінгококової інфекцій.
Колонізаційну резистентність слизових оболонок носоглотки та верхніх дихальних шляхів проти респіраторних вірусів забезпечує бактеріальна мікрофлора, яка формує відповідну мікробіоту. На ранніх етапах життя практично всі компоненти імунної системи людини формуються під впливом мікробіому верхніх дихальних шляхів, зокрема для боротьби з патогенами. Мікроорганізми, що спочатку колонізують, а потім вегетують у порожнині носа, глотці, навколоносових пазухах (ННП) та ВДШ, формують різні окремі мікробіоми, склад яких суттєво відрізняється між собою [3]. Мікробіом порожнини носа і носоглотки переважно тільки у новонароджених дітей включає бактерії роду Lactobacillus, що фактично копіює склад мікрофлори піхви й шкіри матері та зазвичай представлений обмеженим набором фірмікутів, що включає род бактерій Lactobacillus. Після періоду новонародженості у дітей іншого віку та дорослих лактобактерії не належать до типової флори синоназального мікробіому та носоглотки, не говорячи вже про мікробіом ВДШ, а біфідумбактерії взагалі не згадують у складі цих мікробіомів. Хоча останнім часом і не виключають певної ролі молочнокислих бактерій при формуванні мікробних угруповань інших систем організму, включаючи ВДШ. Відоме навіть твердження про те, що використання пероральних пробіотиків з певними штамами біфідум- та лактобактерій призводить не тільки до зменшення частоти і тривалості RRD, але також може змінювати мікробну мікробіоту носоглотки дітей, що часто хворіють [1].
У нормі в синоназальному мікробіомі переважають коринебактерії, становлячи 36 %, тоді як стафілококи (S. aureus, S. haemolyticus, S. epidermidis) — тільки 26 %. Мікробний склад порожнини носа здорових людей, які не є постійними носіями стафілокока, представлений в основному типом Actinobacteria (Propionibacterium spp. і Corynebacterium spp.) при відносно низькому представництві типів Firmicutes (Staphylococcus spp.) та Proteobacteria (Enterobacter spp.). Відсоткове представництво стафілококів (S. aureus) у порожнині носа та у середньому носовому ході в його носіїв збільшується якраз внаслідок зменшення загальної кількості Actinobacteria, зокрема Propionibacterium acnes [4]. Загалом у носоглотці знаходиться більше потенційних патогенів, ніж у порожнині носа [5].
Етіологічними факторами розвитку бактеріального інфекційно-запального процесу в респіраторному тракті вважають такі патогени: пневмококи, гемолітичні стрептококи групи А, гемофільна паличка, Mycoplasma pneumoniae, Chlamydia pneumoniae, Branhamella catarrhalis (Moraxella catarrhalis) та ін. При захворюваннях дихальних шляхів стафілококи та грамнегативні бактерії (кишкова паличка, клебсієла, протей та ін.), які розвинулися в домашніх умовах, на думку автора, трапляються досить рідко — не більше 2–5 % [6].
Діти, що часто хворіють, — проблема не тільки медична, але певною мірою і соціальна. У таких дітей зазвичай порушений календар профілактичних щеплень, вони дуже обмежено відвідують дитячі садки, більший час вимушено залишаючись вдома. У шкільному віці вони змушені пропускати заняття в школі, створюючи проблеми собі, вчителям і батькам, яким доводиться дуже часто залишатися вдома з хворою дитиною і пропускати роботу. У дітей більш старшого віку, що часто хворіють, можуть виникати й різні психологічні проблеми або навіть комплекси: комплекс неповноцінності, відчуття невпевненості в собі. Неможливість через часті хвороби жити повноцінним для свого віку життям може призвести до соціальної дезадаптації (дитина може уникати однолітків, бути замкненою, грубою, дратівливою).
Матеріали та методи
Під наглядом авторів у 2010–2020 роках перебували 3547 дітей, що часто хворіли (6–12 епізодів на рік та нерідко навіть більше: 1–2 захворювання на місяць), а період кожного епізоду їхньої недуги тривав понад 5–7 діб. За сучасною термінологією ми мали б замість терміна «ДЧХ» використовувати термін «RRD», але не будемо цього робити, а в подальшому стане зрозумілим, чому. Дітей віком до 3 років було 862/3547 (24,3 %), від 3 до 7 років — 1295/3547 (36,5 %) та від 7 до 14 років — 1390/3547 (39,2 %). З урахуванням клінічно домінуючих симптомів, які дуже часто спліталися між собою в одну цілісну картину цих частих захворювань, зазвичай було важко дійти завершальної думки та розподілити дітей на дві великі групи спостережень.
До I групи, яку умовно називали «Клінічний образ ДЧХ із гнійно-запальними захворюваннями» увійшли 1595/3547 дітей (45 %), зокрема віком до 3 років — 414/1595 (26 %), від 3 до 7 років — 626/1595 (39,2 %) та від 7 до 14 років — 555/1595 (34,8 %). Інші 1952/3547 (55 %) дітей, про спостереження за якими попередньо ми вже повідомляли [7], були включені до II групи за умовною назвою «Клінічний образ ДЧХ із домінуючими токсичними проявами». До цієї групи дітей, що часто хворіють, увійшли діти з підвищеною температурою, не пов’язаною з гострими гнійно-запальними станами чи їх рецидивами. У цій групі під наглядом перебували 1952/3547 (55 %) дітей від грудного віку до 14 років із порушеннями температурного режиму, зокрема із затяжним субфебрилітетом — 1206/1952 (61,8 %) та з фебрильними атаками (ФА) [8] — 721/1952 (36,9 %). Дітей віком до 3 років із затяжним субфебрилітетом було 243/1952 (12,4 %), із ФА — 205/1952 (10,5 %), від 3 до 7 років — відповідно 398/1952 (20,4 %) та 263/1952 (13,5 %), від 7 до 14 років — відповідно 565/1952 (28,9 %) і 253/1952 (12,96%). Ще 25/1952 (1,3 %) дітей переважно шкільного віку (17/25, або 68 %) страждали на тривалу (від декількох місяців до 4 років) фебрильну лихоманку (38–40 °С і вище). Майже у чверті випадків (450/1952, або 23,0 %) у дітей були одночасно наявні і ФА, і затяжний субфебрилітет. Незважаючи на різний термін захворювання (від декількох місяців до 10–12 років у деяких випадках затяжного субфебрилітету), етіологічний діагноз цих патологічних станів у всіх 1952/1952 (100 %) дітей до звернення в клініку залишався невизначеним. Дітей, що часто хворіли, з клінічно домінуючими та підтвердженими лабораторно специфічними інфекціями (клінічно маніфестне внутрішньоутробне інфікування CMV, ураження дихальної системи легеневими мікоплазмами та хламідіями, хронічні вірусні гепатити В і С та ін.) до групи спостереження не включали.
Всі пацієнти були обстежені бактеріологічно культуральним методом з використанням відповідних поживних середовищ (завідувачка бактеріологічного відділу лабораторії Клініки Маркова — Л.П. Вустич). У всіх випадках робили баквисіви мазків з носа і горла та сечі, за клінічними показаннями додатково — слизу з носа, харкотиння, виділень із вуха, зі шкіри, кон’юнктиви, ясен, із рота, язика, вогнищ стоматиту на слизових оболонках, виділень з рани та з фурункулів. Бактеріологічне підтвердження діагнозів нефродисбактеріозу та синдрому хронічної бактеріальної інтоксикації [8] у плановому порядку здійснювали шляхом посіву ранкової теплої сечі тричі (три дні поспіль), що зазвичай проводили у домашніх умовах з використанням відповідних приладів Diaslide® DS-101 та DS-105 (Novamed, Ізраїль) з нанесеними на них поживними середовищами агару CLED, агару Мак-Конкі та хромогенного агару UriSelect. У разі появи росту культур мікроорганізмів їх пересівали на чашки Петрі з такими поживними середовищами, як м’ясопептонний агар з додаванням 5 % крові, середовище Ендо, агар Сабуро, агар Мюллера — Хінтон (для ідентифікації бактерій роду Pseudomonas) і деякі інші, та продовжували стандартну процедуру ідентифікації виділених культур. Сечу для бактеріологічного обстеження отримували природним шляхом без використання інвазивного методу катетеризації сечового міхура.
Контрольні групи бактеріологічного обстеження мазків із носа та горла, а також теплої сечі (тричі, 3 дні поспіль) становили 205 клінічно здорових малюків грудного віку (від 3 до 12 місяців), яких принесли у клініку на планове профілактичне щеплення (група 1), 70 здорових дорослих (жінок — 30, або 42,9 %, чоловіків — 40, або 57,1 %) віком від 20 до 65 років (група 2) та 27 здорових немовлят у період новонародженості (перші 2–4 тижні життя), у яких робили баквисіви з носа та горла (група 3).
Токсикологічне дослідження крові проводили методом комплексної токсикометрії з використанням діагностичної системи «Токсикон» [9] на базі Міського опікового центру (Київська міська клінічна лікарня № 2, Україна) та дитячої лікарні «Охматдит» (м. Київ, Україна). Упродовж 2012–2020 рр. токсикологічне обстеження було проведене 96 дітям, що часто хворіли, віком від 3 до 14 років із відповідною статистичною обробкою результатів. Вивчали параметри токсемії з визначенням характеристик токсичних протеомів. Окремо розглядали цитолітичну та автоімунну активність токсичних протеомів, а також залежно від клінічно домінуючого токсичного впливу на органи і системи та залежно від домінуючого етіологічного збудника, а саме ентерококів, кишкової палички, стафілококів та клебсієл [10].
Для описової статистики кількісних показників використовували середню арифметичну (М) і стандартне відхилення (SD). Розподіл якісних ознак представлено у відсотках (%). Для порівняння показників між групами використовували T-test і дисперсійний аналіз (ANOVA). Для порівняння розподілів якісних ознак використовували критерій хі-квадрат. Програмний продукт для статистичного аналізу — Stata 12. Консультативна допомога з формування первинної бази даних і статистичного аналізу отримана на кафедрі медичної статистики Національної медичної академії післядипломної освіти ім. П.Л. Шупика (м. Київ, Україна, доцент О.Б. Тонковід).
Також робили загальноклінічні обстеження, що включали загальні аналізи крові, сечі, калу та ін., за клінічними показаннями — біохімічне обстеження (біохімічний аналізатор AU480 виробництва Beckman Coulter, США) печінкових та ниркових проб, білкових фракцій і ревмопроб, глюкози та глікованого гемоглобіну, обміну ліпідів, вітамінів, мікроелементів та ін. Майже всім дітям у плані диференціального діагнозу проводили імуноферментний аналіз (ІФА) та полімеразну ланцюгову реакцію (ПЛР) (у режимі real-time) на віруси герпесу (HSV 1/2, VZV, EBV, CMV, HHV-6, HHV-7, HHV-8), за клінічними та епідеміологічними показаннями — на Mycoplasma pneumoniae, Chlamydia pneumoniae, борелії, ВІЛ, інші вірусні та бактеріальні інфекції. Обстеження імунного статусу було проведено у 2160 ДЧХ від грудного віку до 14 років обох груп спостереження з визначенням: клітинної ланки методом проточної цитометрії з імунофенотипуванням клітин периферійної крові (проточний цитофлуориметр CytoFLEX, Beckman Coulter, США), імуноглобулінів IgA, IgM, IgG, систем комплементу С3 та С4, фагоцитозу та циркулюючих імунних комплексів. Додатково у 890/1595 (55,8 %) дітей I групи та у 732/1952 (37,5 %) дітей II групи визначали рівень секреторного IgA в слині. За клінічними показниками додатково досліджували маркери автоімунних захворювань, автоімунних гепатитів, алергії (загальний та специфічні IgE), гормонів (насамперед щитоподібної залози), проводили мікроскопічне дослідження харкотиння, виділень з носа. За клінічними показниками пацієнти проходили інструментальне обстеження: ультразвукове, рентгенологічне дослідження, МРТ та/або КТ, ЕКГ, ЕЕГ тощо.
Результати та обговорення
Клініка. Десь близько 30 років тому (1990–1993) старший за віком співавтор цієї статті завідував відділенням СНІДу в Інституті інфекційних хвороб, яке тоді розташовувалось на території Києво-Печерської лаври. Був завідувачем та єдиним палатним лікарем в одному лиці, бо хворих тоді на всю Україну налічувалось спочатку 11 чоловік, наступного ріку — 15. І майже всі вони тоді, на початку епідемії, були MSM. Пам’ятаю, як один із наших постійних пацієнтів, Костя, говорив: «Я на вулиці наших дівчат упізнаю здалеку». Минуло 30 років, але щоразу, коли я на вулиці чи в іншому місці бачу дитину з темними півколами під очима, мимоволі згадую Костю. Він тоді був першим у світі хворим на СНІД, якого ми разом із доктором Олександром Смікодубом, директором клініки клітинної терапії «Emcell», пролікували стовбуровими клітинами і на багато років подовжили йому життя: антиретровірусних препаратів тоді в Україні ще не було.
Зовнішній вигляд дітей, що часто хворіють, достатньо типовий, щоб їх впізнати будь-де: на вулиці, в метро, у кабінеті лікаря. Бліде обличчя, темні півкола під очима, часто — погане дихання носом («аденоїдний» вигляд), висипка на шкірі, у більш дорослих дітей — якась невпевненість у погляді, швидка втомлюваність. Вже набагато пізніше стало зрозумілим, що такий вигляд має дитина з хронічною ендогенною інтоксикацією бактеріального походження — синдромом хронічної бактеріальної інтоксикації, що розвинувся на тлі нефродисбактеріозу [8]. Перші повідомлення про цей патологічний стан у дітей та дорослих, за яким ми спостерігали упродовж 12 років (2009–2020) перед тим, як оприлюднити відомості про клінічний діагноз «синдром хронічної бактеріальної інтоксикації» (СХБІ), були зроблені у лютому 2021 року [11]. Під діагностичним терміном «СХБІ» мали на увазі патологічний стан, обумовлений ендотоксикозом, що розвивається на тлі вогнища хронічної бактеріальної інфекції у нирках (нефродисбактеріоз або пієлонефрит) та викликає клінічно різновекторні прояви токсичного ураження окремих органів та систем організму, а саме: загальнотоксичні, а також переважно нейротропні, психотропні, дерматотропні, артроміотропні, офтальмотропні та можливо інші. Діагностичний термін «нефродисбактеріоз» означає локально безсимптомне (без ознак запального процесу) довготривале вогнище хронічної бактеріальної інфекції в нирках, що зазвичай формується висхідним шляхом та спочатку призводить до розвитку віддалених від нирок ознак синдрому хронічної бактеріальної інтоксикації та майже завжди передує дебюту клінічно маніфестного пієлонефриту.
Серед дітей, що часто хворіють, виділяли симптоми, які непевно відокремлювали три клінічних образи. До першого клінічного образу зараховували дітей із симптомами гострих, часто рецидивуючих рекурентних респіраторних захворювань (RRD). Найбільш типовими клінічними ознаками ГРВІ у дітей були добре відомі: помірне підвищення температури (частіше — до 38 °С), катаральні явища та нежить із посиленим виділенням прозорого слизу з носа, почервоніння задньої стінки глотки та піднебінних дужок, почервоніння склери, сльозоточивість, інколи — світлобоязнь, сухий кашель. У випадках чистої ГРВІ, без приєднання вторинної бактеріальної інфекції, ці катаральні явища, так само, як і невисока температура, протримавшись 3–4 дні, самостійно зникали без усякого специфічного лікування або з мінімальним призначенням противірусних препаратів (наприклад, інтерферону). Випадки, коли температура тримається довше, виділення з носа стають кольоровими та набувають жовтуватого або навіть зеленуватого відтінку, а сухий кашель перетворюється у продуктивний із відхаркуванням такого ж кольорового мокротиння, зазвичай помилково відносять до клінічних проявів вірусного походження, тобто до ГРВІ. Але насправді у таких дітей, які не одужують упродовж 3–4 діб від початку захворювання, вже треба говорити про бактеріальні ускладнення, які були викликані бактеріальною флорою назофарингеального мікробіому, спровокованою респіраторним вірусом.
Розмовляючи про тривалість клінічних симптомів ГРВІ або, на сьогоднішній манер, частих RRD, на згадку приходить таке. Старший за віком співавтор цього повідомлення добре пам’ятає, як корифеї вітчизняної інфектології, наприклад, професор Олена Кирилівна Тринус, завідувачка відділу грипу та ГРВІ Інституту інфекційних хвороб (м. Київ), та професор Петро Степанович Мощич, завідувач кафедри дитячих інфекційних хвороб Київського медичного інституту, полюбляли наставляти молодих інфекціоністів ще 50 років тому. Вони наголошували, що тривалість клінічних симптомів таких гострих вірусних респіраторних захворювань, як грип та інші ГРВІ, чітко визначена патогенетичними особливостями цих інфекцій: «Грип та ГРВІ без лікування тривають 3 доби, а з лікуванням — 72 години. Усе, що триває довше, — ускладнення цих гострих вірусних інфекцій. То ж шукайте їх».
У клінічній практиці дітей з класичними RRD вірусного походження, незважаючи на численні повідомлення про те, що саме такі діти є головною проблемою усіх педіатрів, насправді не дуже багато. Через те, що, по-перше, таких дітей у природних умовах майже не існує взагалі: практично в усіх дітей, що хворіють на ГРВІ 6–12 разів та більше на рік, після вірусного початку респіраторного захворювання до нього зазвичай приєднуються симптоми вторинних бактеріальних ускладнень, викликаних патогенними та умовно-патогенними бактеріями, що колонізують слизові оболонки та формують мікробіом носоглотки. А, по-друге, батьків дітей більше непокоять довготривалі, а тому виснажливі і для дитини, і для сім’ї випадки захворювань, які настають часто майже без перерви на відпочинок. Коли ж дитина одужує раніше, ніж батьки встигають налякатися, та не потребує навіть медикаментозного, а поготів стаціонарного лікування, незважаючи на 5–6 та навіть 10–12 випадків захворювання на рік, це їх бентежить значно менше. У таких випадках вони зазвичай рідко звертаються за лікарняною допомогою. До того ж серед лікарів та батьків останнім часом поширюється правильна, з нашої точки зору, думка про те, що часті ГРВІ незалежно від їх кількості, є варіантом норми. Кожній дитині необхідно набрати свій «мінімум» цих «льотних вірусних годин», щоб сформувати імунітет проти гострих респіраторних вірусів і потім, подорослішавши, вже не хворіти.
На клінічних особливостях перебігу ГРВІ (RRD) не будемо зупинятися додатково, адже вони добре відомі, й до цього ми не маємо що додати. Дітей із ГРВІ (RRD) було реально обмаль, і до груп спостережень їх не включали.
До пацієнтів із другим клінічним образом та умовною назвою «ДЧХ із гнійно-запальними захворюваннями» зараховували дітей I групи з домінуючими хронічними та часто рецидивуючими гнійно-запальними захворюваннями носоротоглотки та бронхолегеневої системи, а саме з хронічними риносинуситами (1324/1595, або 83,0 %) — рецидивуючими гайморитами, етмоїдитами, сфеноїдитами, фронтитами, що супроводжувалися постійною затяжною нежитю, виділеннями з носа та по задній стінці глотки кольорового (жовто-зелено-сірого) гнійного слизу, закладеністю носа та навіть повною відсутністю дихання через ніс; хронічними тонзилітами (1048/1595, або 65,7 %) зазвичай із рецидивуючими ангінами, у дітей старшого віку від 7 до 14 років — постійним болем у горлі, пов’язаним із хронічним рецидивуючим фарингітом (503/1390, або 36,2 %). Гнійно-запальні процеси у роті в більше ніж 1/3 дітей усіх вікових груп супроводжувалися болючими, майже постійно рецидивуючими стоматитами (554/1595, або 34,7 %) із вогнищевим чи майже тотальним ураженням слизових оболонок, значно рідше виникали глосити та гінгівіти. На хронічні, часто рецидивуючі (до 5–9 разів на рік) одно- чи двосторонні отити страждали майже чверть дітей — 373/1595 (23,4 %). Гнійні, зазвичай двосторонні кон’юнктивіти з торпідним млявим перебігом мучили 276/1595 (17,3 %) дітей. Майже в усіх дітей із гнійно-запальними захворюваннями носоглотки (1570/1595, або 98,4 %) збільшувалися лімфатичні вузли носоглоткового кільця, а у більше ніж 1/3 випадків взагалі, але переважно у дітей віком від 3 до 7 років, формувалися аденоїди — 595/1595 (37,3 %). Також майже у 1/3 дітей (494/1595, або 31 %) цієї групи з гнійно-запальними захворюваннями носоглотки формувалася вторинна бактеріально-асоційована алергія зазвичай із множинними кофакторними алергенами, які помилково сприймали як головний чинник алергії та роками лікували стандартними протиалергійними засобами з незначною клінічною ефективністю або взагалі без такої.
Не рідше запальних процесів у носоротоглотці в ДЧХ виникали і запалення у дихальних шляхах. Так, трахеїти з постійним або часто рецидивуючим кашлем виникали у 1153/1595 (72,3 %) дітей, при цьому у 308/1595 (19,3 %) дітей спостерігали симптоми ларинготрахеїту з грубим гавкаючим кашлем. Більше третини дітей (545/1595, або 34,2 %) страждали на затяжні та рецидивуючі трахеобронхіти та бронхіти, що траплялися по декілька разів на рік. Слід зауважити, що зазвичай одна дитина страждала на декілька гнійно-запальних захворювань одночасно: отит і риносинусит, ангіна та ларинготрахеїт, стоматит і фарингіт, гайморит і трахеобронхіт й інші. Зазвичай одна дитина мала 3–4 відповідних діагнози одночасно.
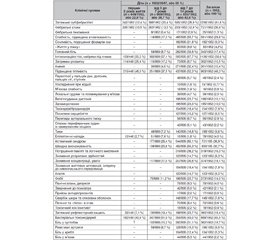
До пацієнтів із третім клінічним образом та умовною назвою «ДЧХ із домінуючими токсичними проявами» зараховували 1952/3547 (55 %) дітей із домінуючими порушеннями температурного режиму токсичного походження, не пов’язаними з гострими гнійно-запальними станами чи їх рецидивами, а також з іншими клінічними проявами синдрому хронічної бактеріальної інтоксикації (СХБІ). Тобто підвищення температури у вигляді затяжного субфебрилітету, фебрильних атак чи затяжної фебрильної лихоманки відбувалося у ДЧХ, які на момент підвищення температури зазвичай не мали клінічних ознак чергового гострого стану або рецидиву гнійно-запальних захворювань носоротоглотки та бронхолегеневої системи. Клінічні прояви СХБІ з порушеннями температурного режиму у ДЧХ із третім клінічним образом відображені у табл. 1.
/35.jpg)
Незважаючи на десятки діагнозів та захворювань, з якими можна було б пов’язати виникнення у 1206/1952 (61,8 %) дітей, зокрема віком до 3 років — 243/1952 (12,4 %), від 3 до 7 років — 398/1952 (20,4 %) та від 7 до 14 років — 565/1952 (28,9 %), затяжного субфебрилітету, що чергувався зазвичай з періодами тимчасової нормалізації температури (частіше перед сном та зранку), дійсне етіологічне походження та діагноз цього патологічного стану залишалися невизначеними. При цьому тільки 145/1206 (12,0 %) дітей звернулися до нашої клініки вперше з домінуючою скаргою на затяжний субфебрилітет. Інші 1061/1206 (88 %) дітей тривалий час неодноразово зверталися на амбулаторний прийом у поліклініку та деякі навіть проходили обстеження в умовах стаціонару.
Клінічні спостереження 2009–2020 рр. за пацієнтами, яких високо та часто повторно лихоманить, дозволили нам сформулювати ще один новий, раніше невідомий клінічний термін «фебрильна атака» [8, 11]. Під фебрильною атакою розуміли раптову короткочасну лихоманку токсичного походження з несподіваним швидким і зазвичай нетривалим (від декількох годин до 5–7 днів) підвищенням температури від 38 до 40 °С і вище у зовні клінічно здорової дитини або дорослого, що залишалася майже моносимптомною (без розвитку локальних ознак запального процесу або симптомів специфічної крапельної чи іншої інфекції). Фебрильну атаку, пов’язану з формуванням вогнища хронічної бактеріальної інфекції у нирках, ми спостерігали у третини ДЧХ (721/1952, або 36,9 %), а саме: віком до 3 років — у 205/1952 (10,5 %), дошкільного віку — у 263/1952 (13,5 %) та шкільного віку — у 253/1952 (12,9 %). У цих випадках, майже на рівному місці, без усяких попереджень та повідомлень від зовнішньо здорового організму, температура критично швидко сягала зазвичай 39–40 °С або навіть вище. Головна відмінність між звичайним підвищенням температури у дитини, що реально захворіла, та ФА — невідповідність незначної вираженості катаральних проявів та симптомів гнійно-запального процесу будь-якої локалізації, насамперед у носоглотці, роті, вухах та бронхолегеневій системі, висоті температурної реакції. Тобто висока температура є, а симптомів запалення немає. Якщо зранку дитина мала звичайну поведінку, бігала, гралася, цікавилась навколишнім світом, а за 2–3 години вже вся «горіла» та мала температуру 38–40 °С, не слухайте свій внутрішній голос чи поради байдужого лікаря, що «все добре» і то «звичайне ГРВІ», «лізуть зубки», «дитина перегрілася», «ще подивимось», — це і є фебрильна атака. І тільки Бог знає, чим закінчиться вона наступного разу: новим періодом ремісії чи дебютом гострого пієлонефриту з госпіталізацією до профільного нефрологічного відділення.
Фебрильна атака у більшості випадків (443/721, або 61,4 %) була нетривалою і трималася найчастіше від декількох часів до 1–2 діб, майже в третини випадків (239/721, або 33,1 %) — від 3 до 5 діб та у 39/721, або 5,4 % випадків — до 5–7 діб. Підвищення температури при ФА, особливо впродовж декількох годин, нагадувало відому з літератури одноденну або ефемерну лихоманку (febris ephemera або febriculara), тому що не мало видимих причин, було на час виникнення клінічно майже моносимптомним і часто зникало раніше, ніж встигало наробити галасу. Тільки інколи діти шкільного віку відзначали нетривалий супутній головний біль, невеликий озноб, відчуття жару, біль у м’язах. У 142/721 (19,7 %) дітей зазвичай черговий рецидив ФА поєднувався з афтозним чи афтозно-виразковим стоматитом та збільшенням підщелепних і шийних лімфатичних вузлів. Малі діти могли не помічати високу температуру, продовжуючи свої дитячі ігри та забави. Але на відміну від ефемерної лихоманки у 544/721 (75,5%) випадках ФА поверталася, повторюючись по декілька разів на рік, а інколи — упродовж одного місяця через різні інтервали часу. До того ж майже у чверті випадків (450/1952, або 23,0 %) ФА виникали одночасно на фоні тривалого затяжного субфебрилітету. Така короткочасна фебрильна температура зазвичай погано піддавалася впливу жарознижуючих препаратів і майже не реагувала на застосування антибіотиків, що і зрозуміло, адже вона мала не запальний, а токсичний характер. Про таку температуру в дітей можна було казати, що вона прийшла нізвідки та пішла в нікуди.
У 25/1952 (1,3 %) дітей, зокрема переважно шкільного віку (17/25, або 68,0%), порушення температури мало перебіг фебрильної лихоманки на рівні 38–40 °С і вище, яку зазвичай діагностично визначали пацієнтам як лихоманку неясного генезу (ЛНГ). Переважала лихоманка переміжного типу інтермітуючого характеру (febris intermittis) зі зниженням протягом доби температури до норми і новим підвищенням. Тривалість лихоманки у більшості випадків (19/25, або 76,0 %) рахувалася місяцями: від 1 до 3 місяців — в 3/25 (12,0 %) випадках, від 4 до 6 — в 5/25 (20,0 %) та від 7 до 12 місяців — в 11/25 (44,0 %). Але майже у чверті випадків (6/25, або 24,0 % дітей) така виснажлива щоденна температура з періодичними підйомами до 38–40 °С трималася від 1 до 4 років, незважаючи на нескінченні обстеження та множинні курси лікування, що проводились упродовж усього періоду захворювання.
Згідно з табл. 1, окрім підвищеної температури, у ДЧХ зазвичай визначали інші клінічні прояви хронічної інтоксикації, пов’язаної з перебігом нефродисбактеріозу та СХБІ. При цьому батьки не завжди пред’являли скарги на стан дитини. Інколи тільки при активному їх розпитуванні можна було з’ясовувати додаткові симптоми захворювання. Підвищену слабкість та швидку втомлюваність відзначали майже 1/3 дітей (581/1952, або 29,8 %), при цьому значно частіше таку скаргу могли сформулювати діти шкільного віку (465/835, або 55,7 %), аніж дошкільнята (116/669, або 17,3 %).
Також тільки більш дорослі діти скаржилися на сонливість, порушення формули сну (182/835, або 21,8 %), а 83/835 (9,9 %) підлітків, як дорослі, казали про себе, що їхній стан нагадує їм «життя у ліжку». У 301/1952 (15,4 %) ДЧХ із СХБІ та порушенням температурного режиму відзначали під час огляду безпорадний байдужий зовнішній вигляд із помітною амімією, значно частіше — в дітей шкільного віку (271/835, або 32,4 %), хоча інколи (30/669, або 4,5 %) — навіть у дітей віком від 3 до 7 років. Третина дітей шкільного віку — 282/835 (33,8 %) та 58/669 (8,7 %) дітей віком від 3 до 7 років скаржилися на головний біль. Інколи у 12–14-річних підлітків у такому стані виникав сильний та майже постійний головний біль, що погано піддавався медикаментозній терапії. Такий виснажливий головний біль міг ставати головною скаргою дитини та її батьків, що примушувало їх місяцями та навіть роками відвідувати лікарів та робити численні марні МРТ та КТ головного мозку в пошуках відповіді на те, «що це взагалі таке», «що відбувається» та «чи немає у їх дитини чогось гіршого».
До типового симптому в ДЧХ з порушеннями температурного режиму та іншими проявами СХБІ можна було зарахувати інтоксикаційні тіні та пастозність під очима, що виявляли у більше ніж половини пацієнтів (1106/1952, або 56,6 %). При цьому, якщо у дітей перших 3 років життя їх бачили у третині випадків (у 159/448, або 35,5 %), то у дошкільному віці — вже в 57,1 % (382/669), а у шкільному — у 67,7 % (565/835). Ще одним із найбільш типових симптомів у дітей цієї групи можна вважати підвищену пітливість, яку відзначали у 903/1952 (46,3 %) випадках та від 37,5 до 52,3 % у дітей різних вікових груп. У дітей грудного віку та перших 3–5 років життя частіше спостерігали підвищену нічну пітливість, особливо при засинанні, коли білизну, за словами матері, можна було викручувати та приходилося змінювати декілька разів за ніч. Дуже часто у ДЧХ раннього шкільного віку (8–12 років) із СХБІ з’являвся смердючій запаху поту, який батьки та лікарі помилково розцінювали як прояв раннього статевого дозрівання, адже їх дитина надто рано дорослішає, що це вікові прояви та вони незабаром самі згаснуть. При цьому такі хибні висновки могли стосуватися не тільки хлопчиків, але і дівчат.
Також до типових проявів СХБІ у ДЧХ можна було віднести астенічний синдром, який спостерігали у 177/669 (26,4 %) дітей віком від 3 до 7 років та у 544/835 (65,1 %) школярів, швидку виснаженість — у 138/669 (20,6 %) і 462/835 (55,3 %) відповідно, зниження концентрації, уваги — 117/669 (17,5 %) та 257/835 (30,8 %). Школярі також нерідко повідомляли про погіршення пам’яті та логічного мислення — у 319/835 (38,2 %), зниження розумових здібностей — 123/835 (14,7 %), зниження життєвих мотивацій, інтересу до навколишнього середовища — 154/834 (30,8 %), апатію — у 123/835 (14,7 %), запаморочення — 195/835 (23,3 %), тахікардію або, навпаки, брадикардію — 154/835 (18,4 %), посилене серцебиття — 127/835 (15,2 %), у них визначали вегетосудинну дистонію — 198/835 (23,7 %). З урахуванням такого хворобливого стану, який часто супроводжувався зниженням толерантності до спортивних та розумових навантажень, що зовні могло залишатися непомітним як для вчителів, так і для батьків, які вважали це звичайною лінню, діти починали відставати від шкільної програми та втрачали інтерес до навчання й занять спортом.
Невизначеність ситуації, постійне та малоефективне лікування, обмеження у відвідуванні школи та спортивних занять, тривога й занепокоєні розмови батьків викликали у дітей різноманітні страхи: фобії виникали навіть у 75/669 (11,2 %) дітей дошкільного віку та вдвічі частіше — у школярів (198/835, або 23,7 %), загалом — у 273/1952, або 14 % ДЧХ із проявами СХБІ. Майже у кожної 10-ї дитини шкільного віку (78/835, або 9,3 %) у цьому стані виникали депресія та панічні атаки, батьки 42/835 (5,0 %) дітей вимушені були звертатися на прийом до психіатра, а у 17/835 (2,0 %) випадках підліткам навіть були призначені антидепресанти, які принципово не покращували стану дітей.
Серед дітей різних вікових груп типовим проявом СХБІ, крім підвищення температури, були різноманітні затримки розвитку: набір маси тіла, мовленнєві, психічні, емоційні розлади і розлади поведінки, що відзначали у 114/448 (25,4 %) дітей віком до 3 років, у 115/669 (17,2 %) — від 3 до 7 років та у 73/835 (8,7 %) школярів, загалом — у 302/1952 (15,5 %) випадках. При цьому початок затримки розвитку дитини або її прогресування нерідко спостерігали після проведення планових профілактичних щеплень у зв’язку з активацією в найближчому поствакцинальному періоді до того безсимптомного вогнища хронічної бактеріальної інфекції у нирках, яке спровокувало саме щеплення. Деякі батьки називали такі найближчі поствакцинальні реакції, які траплялися з їхніми дітьми, «відкатами» у розвитку. До емоційних розладів та розладів поведінки у дітей переважно перших 3 років життя зараховували синдром гіперзбудливості, або стан «гіперактивна дитина». Цей стан умовно можна було ще називати «мавпячий синдром», коли дитину неможливо було вгамувати, стримати, переконати, умовити, навіть примусити, як кажуть, «достукатися» до неї: вона однак робила те і так, як сама бажала і вважала за потрібне, не прислухаючись до того, що їй кажуть.
Клінічна палітра СХБІ у дітей раннього та дошкільного віку, що часто хворіли, взагалі була значно обмеженою порівняно з дітьми шкільного віку, але, можливо, більш виразнішою. Окрім підвищеної пітливості та субфебрильної температури, нерідко — ФА, перше, що привертало увагу, був зовнішній вигляд дитини: бліде обличчя, темні кола та інколи набряки під очима, нервозність або, навпаки, байдужість у погляді, помітна м’язова слабкість, коли дитина під час консультації наче сповзала зі стільця або, побачивши медичну кушетку, тут же вкладалася хоч трохи полежати, не звертаючи уваги на батьків та лікаря. Серед дітей, які вже могли сформулювати свої скарги, віком від 3 до 7 років, 102/669 (15,2 %) дитини жалілися на біль у суглобах (у шкільному віці — 260/835, або 43 %), а діти молодшого віку переставали ставати на ніжки та/або відмовлялися злізати з батьківських рук. У 58/669 (8,7 %) дітей дошкільного віку розвинувся реактивний артрит (у школярів — 128/835, або 15,3 %), який часто набував рецидивуючого характеру. В непоодиноких випадках діти шкільного віку скаржилися на біль у хребті (104/835, або 12,4 %) та у м’язах (44/835, або 5,3 %).
Клінічний образ дітей раннього та дошкільного віку, що часто хворіли, слід доповнити частим, зазвичай рецидивуючим ураженням шкіри різноманітними висипами. Ці стани були з різною інтенсивністю ураження: від легкої шорсткості шкіри, рецидивної кропив’янки, еритеми або інших варіантів дерматитів до тяжких пошкоджень за типом поширеного атопічного дерматиту та мокрої екземи із суцільним ураженням шкіри, коли майже не залишалося незайманих ділянок. У ДЧХ із СХБІ такі ураження шкіри розглядали як прояв бактеріальної токсикодермії, яку відзначали у 182/448 (40,6 %) дітей віком до 3 років, у більше ніж половини дітей віком від 3 до 7 років — 347/669 (51,9 %) та у 359/835 (43 %) школярів. Майже кожна п’ята дитина шкільного віку (148/825, або 17,7 %) скаржилася на свербіж шкіри та/або слизових оболонок, при цьому незалежно від наявності чи відсутності висипу на шкірі.
Ще один незвичайний прояв СХБІ у ДЧХ стосувався токсичного ураження кон’юнктиви. Під нашим спостереженням перебували 18/835 (2,2 %) ДЧХ шкільного віку із СХБІ, у яких спостерігали токсичні кон’юнктивіти. Кон’юнктивіти мали негнійний характер, але і вірусна природа їх виникнення при лабораторному обстеженні теж не була доведена. Ми вже згадували раніше, при розгляді клінічних проявів дії дерматотропних токсинів у хворих на СХБІ [11], що такі клінічні симптоми токсичних подразнень слизових оболонок очей, як постійне, а інколи нападоподібне відчуття печіння та «піску» в очах, що викликало помірну або нездоланну сльозотечу, відзначали більше половини дорослих, а серед ДЧХ із СХБІ — 70/835 (8,4 %) дітей шкільного віку. У випадках прогресування токсичного ураження слизових оболонок очей виникав токсичний кон’юнктивіт (зазвичай були уражені обидва ока) з набряком повік, набряком і гіперемією кон’юнктиви, світлобоязню, подальшим посиленням сльозотечі, почервонінням білка очей, сверблячкою очей, а іноді болем в очах.
Одним із наступних незвичайних симптомів клінічного образу ДЧХ із СХБІ був затяжний рефлекторний кашель як прояв токсичного впливу на слизові оболонки ВДШ, який виявляли у дітей усіх вікових груп (360/1952, або 18,4 %): віком до 3 років — у 32/448 (7,1 %) дітей, від 3 до 7 років — у 130/669 (19,4 %), у школярів — у 198/835 (23,7 %). Цей кашель як один з головних проявів СХБІ не був пов’язаний із запальними процесами в носоглотці та/або в дихальних шляхах і мав токсичне походження внаслідок подразнення слизової оболонки задньої стінки глотки та/або трахеї бактеріальними токсинами. Такий сухий непродуктивний кашель, який ще називали невмотивованим, мав стійкий довготривалий характер і міг триматися від декількох місяців до кількох років. Рентгенологічне дослідження, КТ, МРТ легенів залишалися майже в нормі та не могли прояснити причини виникнення цього кашлю, що часто був нападоподібним, нагадуючи кашлюк. І не тільки за клінічною картиною, а й за невтішними результатами лікування: його не можна було вгамувати призначенням ані антибіотиків, ані спазмолітичних чи відхаркувальних препаратів. Цей тяжкий стан загальної та локальної інтоксикації з незвичайним домінуючим клінічним проявом у вигляді невгамовного кашлю можливо було називати кашлюкоподібним синдромом, який частіше відомий під хибним діагнозом кашлюка. Саме від кашлюка, зазвичай неефективно, тривалий час лікували таких дітей і навіть дорослих, посилаючись на лабораторне підтвердження діагнозу шляхом виявлення відповідних антитіл IgG до збудника кашлюка, на жаль, забуваючи, що ці антитіла пожиттєво циркулюють у крові після щеплення, зробленого ще у дитячому віці.
Привертало нашу увагу і те, що в усіх пацієнтів з рефлекторним кашлем виявляли супутню до СХБІ хронічну стафілококову інфекцію носоглотки. Саме поєднання хронічної стафілококової інфекції з головним вогнищем у носоглотці та СХБІ з головним вогнищем у нирках породжувало цей тяжкий стан загальної інтоксикації та локального ураження слизових оболонок ВДШ дерматотропними бактеріальними токсинами з їх подразнюючою дією на шкіру та слизові оболонки [11]. Наведемо яскравий випадок виникнення такого кашлюкоподібного синдрому у дитини грудного віку (приклад 1).
Приклад 1
Взимку 2012 року до клініки звернувся батько хлопчика віком 5 місяців, який народився і жив у одній із скандинавських країн, де вже третій рік працювали його батьки. Дитину залишив вдома з жінкою, тому що не був певен, що вона у такому тяжкому стані витримає дорогу до Києва. За декілька років до народження хлопчика його мати проходила курс обстеження і лікування у клініці «Вітацелл» від TORCH-інфекцій у зв’язку з обтяженим акушерським анамнезом та втраченою першою вагітністю. Вдячні батьки назвали хлопчика Ігорьком. Тому в цій сім’ї я вже мав певний кредит довіри. Дитина вже 2 місяці поспіль безперервно кашляла. Кашель посилювався щоночі, ставав нападоподібним з ознаками задухи. Переляканим батькам, які весь цей час спали по черзі, здавалося, що дитина може просто задихнутися. Місцеві лікарі лікували хлопчика від кашлюка та безперервно призначали антибіотики, але поки що нічого вдіяти не могли: покращення не ставалося, кашель не припинявся. Батько розповів, що ще до початку кашля у дитини був один випадок застудного захворювання з тривалим виділенням слизу з носа, відзначали невисоку температуру (37,0–37,2 °С), помірний висип на шкірі та підвищене потіння дитини. А вже під час кашлю та лікування антибіотиками двічі були «не дуже добрі» аналізи сечі: «пробігли» незначно підвищені лейкоцити, знаходили сліди білка. Заочно клінічно стан дитини, що часто хворіла, був розцінений як нефродисбактеріоз та СХБІ з домінуючим затяжним рефлекторним кашлюкоподібним кашлем як прояв дії дерматотропних токсинів, на тлі стафілококової інфекції носоглотки. Батько повіз із собою стафілококову вакцину, виготовлену з музейних, раніше виділених, а потім депонованих та запатентованих автоштамів стафілокока. А на попередження, що місцеві лікарі навряд чи будуть її вводити, батько, який був ветеринарним лікарем, сказав, що колоти дитину буде сам. Після другої ін’єкції вакцини кашель помітно вгамувався, дитина і батьки змогли частково спати вночі, а після 5-ї — припинився зовсім і більше не повертався. Коли дитині виповнилося 3 роки, батьки приїхали до Києва і вже усією сім’єю завітали до клініки. Клінічно хлопчик був здоровим.
До деяких інших, відносно рідких проявів впливу токсинів нейротропної дії зараховували виникнення тиків (у 188/1952, або 9,6 %) та епілептичних нападів. Тиком вважали швидкі мимовільні однотипні м’язові рухи, які іноді могли зачіпати також голосовий апарат, що супроводжувалося вокалізацією (проголошенням різних звуків), та дихальні м’язи (хрюкання, покашлювання, посвистування або різкий свист, гучне видихання або втягування повітря). Тики частіше виявляли у школярів (140/835, або 16,8 %) порівняно з дітьми дошкільного віку (48/669, або 7,2 %). Частіше тики були довготривалими (більше ніж 1 рік), мали локальний характер із залученням однієї групи м’язів (мімічні на обличчі, найчастіше — моргання) та простими з елементарними рухами (примруження ока, підморгування, рух вухами, наморщування чола, зведення брів). Але в деяких випадках були складними та генералізованими із залученням декількох груп м’язів, що нагадувало цілеспрямований руховий акт, як у наступному спостереженні (приклад 2).
Приклад 2
До клініки звернулися батьки 10-річного хлопчика, учня 4-го класу, яких напередодні декілька разів викликали до школи через «погану поведінку» їхнього сина. Посеред уроку хлопчисько підривався з парти, робив повний оберт навколо себе на 360°, при цьому щось виголошуючи на кшталт хрюкання, та знову сідав на місце. Інших зауважень до поведінки учня, який був чемним та вчився на «відмінно», не було. Ані довготривалі роз’яснювальні розмови, ані двійки по поведінці у щоденнику, ані погрози батьків відмовити у прогулянках, катанні на велосипеді та ін. не мали жодного позитивного наслідку: хлопчик продовжував «накручувати» свої оберти. При консультації у клініці був встановлений діагноз ДЧХ із постійно рецидивуючим гайморитом та частими респіраторними захворюваннями (понад 6 разів на рік), а також нефродисбактеріозу з синдромом хронічної бактеріальної інтоксикації (з анамнезу були встановлені епізоди циститу та затяжного субфебрилітету в дошкільному віці). СХБІ одночасно з іншими загальнотоксичними симптомами домінував проявами дії нейротропних токсинів у вигляді складного генералізованого тику. Стан дитини відповідав класичним клінічним проявам синдрому Жиля де ла Туретта (чи просто — синдрому Туретта), який проявляється моторними та вокальними тиками з копролалією. При цьому копролалію вважають найбільш тяжким проявом цього синдрому та одним із діагностичних критеріїв захворювання. Діагноз нефродисбактеріозу був підтверджений виділенням 3 уринокультур Enterococcus faecalis. Вже відразу після першого курсу лікування бактеріальною ентерококовою автовакциною (з 10 ін’єкцій) «підскоки» дитини майже припинилися, і «хуліган» знову став відмінником.
До наступних рідких, але інколи визначальних проявів дії нейротропних токсинів у ДЧХ із СХБІ належали епілептичні напади токсичного походження, перший клінічний випадок яких ми спостерігали ще у 2008 році (приклад 3).
Приклад 3
Перший раз мама дівчинки Оленки, 10 років, звернулася до клініки 28 жовтня 2008 року. Дитину залишила вдома (в іншому місті України), до Києва приїхала сама, тому що лякалась нових епілептичних нападів та напевно не знала, чи за адресою вона взагалі звертається. При розмові з майже зневіреною жінкою було з’ясовано таке. Перший епілептичний напад у її дитини трапився ще у 5 років після різкого підвищення температури та нагадував фебрильні судоми, що нерідко трапляються в дітей під час високої лихоманки й зазвичай швидко минають назавжди. Та не у цієї дитини. Усі наступні напади, що повторювалися 1–2 рази на місяць, виникали на тлі раптового підвищення температури, що відбувалося майже постійно. Різні препарати антиконвульсантної дії були неефективними — епілептичні напади не вщухали. У зв’язку з відсутністю на ЕЕГ вогнищ біоелектричної активності в мозку етіологія нападів залишалася невстановленою. Але було чітко зафіксовано, що під час підвищення температури та епілептичних нападів у сечі завжди був підвищений вміст лейкоцитів та білка, хоча ніхто на це особливої уваги не звертав. З поглибленого анамнезу, під час розмови з матір’ю дитини, було додатково встановлено, що, починаючи з 3 років, у дівчинки періодично, без видимих причин і катаральних явищ, раптово підвищувалася температура до 39 °С та, протримавшись декілька годин або діб, зникала. Тобто вже задовго до виникнення епілептичних нападів мали місце типові фебрильні атаки, що є візитною карткою нефродисбактеріозу та СХБІ. Щоразу цей стан розцінювали та лікували як ГРВІ і призначали антибіотики. Та лише в січні 2008 року після екстреної госпіталізації у нефрологічне відділення, коли температура в черговий раз підвищилася до 40 °С, а в аналізі сечі лейкоцити покривали всі поля зору, був уперше встановлений діагноз гострого пієлонефриту та вперше виділена з сечі чиста культура E. coli. Під час бесіди мама дівчинки зауважила, що, крім температури, дитина скаржилася на постійний та часом сильний головний біль, слабкість, швидку втомлюваність, періодичний біль у суглобах. Ще у дитини відзначали постійну субфебрильну температуру, підвищену пітливість, а також зниження концентрації уваги та погіршення пам’яті, що помилково пов’язували з епілепсією. Тобто мали місце типові, як для дитини, прояви СХБІ. При обстеженні дитини у клініці з сечі були виділені у великій кількості Е. coli (двічі) та Enterobacter aerogenes. Із виділених бактерій виготовили двовалентну автовакцину та з 4 грудня 2008 р. почали імунізацію дитини. Майже після кожної ін’єкції температура підвищувалася до 38–39 °С, що розцінювали як позитивний факт і ознаку масової загибелі бактерій у нирках під впливом власної імунної системи з виділенням токсинів загальнотоксичної дії з пірогенним ефектом. Але з огляду на високу температуру судоми більше не виникали, незважаючи на те, що з початку лікування бактеріальною автовакциною антиконвульсанти дитина більше не приймала. Упродовж року дівчинка отримала ще декілька курсів вакцинації бактеріальними автовакцинами, виготовленими з нових штамів уринокультур, виділених при контрольних бактеріологічних дослідженнях сечі. За словами матері (зв’язувалися телефоном 24 лютого 2010 р.), епілептичних нападів та фебрильних атак більше не було, минув субфебрилітет, не турбував біль у суглобах, дитина поводилася активніше, веселіше, почала краще вчитися у школі.
Упродовж наступних 12 років ми спостерігали взагалі 78/1952 (4,0%) дітей із другої групи ДЧХ із СХБІ, в яких був раніше діагностований (після проведених в інших клініках досліджень) епілептичний синдром невстановленої етіології, зокрема у дітей віком до 3 років — 12/448, або 2,7 %, від 3 до 7 років — 51/669, або 7,6 %, та школярів — 15/835, або 1,8 %. Усі діти з епілептичними нападами під час обстеження та лікування в нашій клініці продовжували перебувати під наглядом невролога за місцем спостереження. Додатково всі діти у клініці були обстежені методами ІФА та ПЛР на віруси герпесу (HSV, EBV, CMV, HHV-6), на підставі чого на момент звернення у нашу клініку герпетична етіологія виникнення епісиндрому, який у дітей частіше пов’язаний із внутрішньоутробною цитомегаловірусною інфекцією [11], була повністю виключена. Хоча майже третина дітей на підставі виявлення високих титрів антитіл IgG на попередніх етапах звернення за медичною допомогою вже отримувала раніше непотрібне їм противірусне лікування, яке не допомогло. Тривалість існування епілептичного синдрому в дітей була різною та становила лише у чверті випадків від 1 місяця до 2 років (у 20/78, або 25,6 %) і зазвичай у 58/78 (74,4 %) дітей — до 3–8 років. У 17/78 (21,8 %) випадках епілептичні напади проявлялися типовими абсансами з раптовим короткочасним відключенням свідомості. У 64/78 (82,1 %) дітей з епілептичним синдромом на ЕЕГ були виявлені ознаки епілептиформної активності зазвичай дифузного характеру, але в інших 14/78 (17,9 %) випадках епілептиформні розряди взагалі не реєстрували. Серед дітей з епілептиформними порушеннями на ЕЕГ у деяких випадках тривалий час судом або абсансів взагалі не було. У більше ніж половині випадків у цій підгрупі ДЧХ (45/78, або 57,7 %) діти отримували протисудомні препарати з обмеженою або взагалі відсутньою клінічною ефективністю.
Клінічний образ ДЧХ із домінуючими токсичними проявами серед дітей шкільного віку та підлітків доповнювали такі рідкісні, але достатньо виражені симптоми, як парестезії у пальцях рук, долонях, пальцях ніг, ступнях — у 48/835 (5,7 %), інколи — локальні судоми і посмикування (39/835, або 4,7 %), частіше у кінцівках за типом м’язових фібриляцій, інколи — м’язова слабкість (15/835, або 1,9 %), дискоординованість та ускладнення при ходьбі (15/835, або 1,8 %), деякі інші, зазначені у табл. 1. Слід наголосити, що клінічні прояви СХБІ у дітей I групи (з часто рецидивуючими гнійно-запальними захворюваннями носоглотки та дихальних шляхів) частіше були симптоматично другорядними, фоновими. Водночас у дітей II групи з токсичними проявами у вигляді загальнодомінуючого порушення температурного режиму вони разом з іншими симптомами хронічної інтоксикації ставали головними.
Серед ДЧХ обох груп спостереження велика кількість дітей тривалий час страждали на такі часті та інколи постійно рецидивуючі гнійно-запальні ураження шкіри, як фурункульоз, піодермія, гідраденіти, ячмені та ін. При цьому частота їх виникнення не залежала від групи спостереження, а саме у I групі траплялися у 698/1595 (43,8 %) дітей, II групі — у 810/1952 (41,5 %), загалом — у 1508/3547 (42,5 %). Такий, здавалося б, збіг обставин лише додатковий раз підкреслював, що, по-перше, межа між цими двома групами досить умовна. А по-друге, що гнійні ураження шкіри, як і багато інших клінічних проявів, про які ми вище згадували, включно із загальним образом ДЧХ, насправді є дитиною двох батьків: вогнища хронічної бактеріальної інфекції у носоглотці та у нирках.
І тут саме час перейти до наступного розділу цієї статті: діагностики.
(Далі буде)
Висновок
Сучасний досвід педіатричної практики свідчить про те, що клінічний образ дитини, що часто хворіє, наразі є збірним і складається із симптомів рекурентних респіраторних захворювань або повторних гострих респіраторних вірусних інфекцій, рецидивуючих гнійно-запальних захворювань носа, глотки, рота, вух, очей та бронхолегеневої системи, а також клінічних проявів синдрому хронічної бактеріальної інтоксикації, що розвинувся на тлі нефродисбактеріозу.
Серед дітей I групи спостережень, яку умовно називали «Клінічний образ ДЧХ із гнійно-запальними захворюваннями» і до якої увійшли 1595/3547 (45 %) дітей, переважали хворі з хронічними риносинуситами (1324/1595, або 83,0 %), хронічними тонзилітами (1048/1595, або 65,7 %), хронічним рецидивуючим фарингітом (503/1390, або 36,2 %), болючими, часто рецидивуючими стоматитами (554/1595, або 34,7 %), хронічними рецидивуючими (до 5–9 разів на рік) одно- чи двосторонніми отитами (373/1595, або 23,4 %), гнійними, зазвичай двосторонніми кон’юнктивітами (276/1595, або 17,3 %), трахеїтами з постійним або часто рецидивуючим кашлем (1153/1595, або 72,3 %), при цьому у 308/1595 (19,3 %) випадках спостерігали симптоми ларинготрахеїту з грубим гавкаючим кашлем; більше ніж третина дітей (545/1595, або 34,2 %) страждали на затяжні та рецидивуючі трахеобронхіти і бронхіти, які переносили по декілька разів на рік. Зазвичай одна дитина одночасно страждала на 2–3 і більше гнійно-запальних захворювання.
Майже в усіх дітей із гнійно-запальними захворюваннями носоглотки (1570/1595, або 98,4 %) збільшувалися лімфатичні вузли носоглоткового кільця, а у більше ніж 1/3 випадків загалом, але переважно у дітей віком від 3 до 7 років, виникали аденоїди — 595/1595 (37,3 %). Також майже у 1/3 дітей (494/1595, або 31 %) цієї групи з гнійно-запальними захворюваннями носоротоглотки та ВДШ формувалася вторинна бактеріально-асоційована алергія, зазвичай із множинними кофакторними алергенами, які помилково сприймали як головний чинник алергії та роками лікували стандартними протиалергійними заходами з незначною або взагалі відсутньою клінічною ефективністю.
До пацієнтів ІІ групи з умовною назвою «Клінічний образ ДЧХ із домінуючими токсичними проявами» зараховували 1952/3547 (55 %) дитини з домінуючими порушеннями температурного режиму токсичного походження, а також з іншими клінічними проявами СХБІ, який розвинувся на тлі нефродисбактеріозу, рідше — пієлонефриту. У 1206/1952 (61,8 %) дітей цієї групи виник затяжний субфебрилітет, у 721/1952, або 36,9 %, — зазвичай рецидивуючі фебрильні атаки, у 25/1952 (1,3 %) — фебрильні лихоманки на рівні 38–40 °С і вище, яку зазвичай діагностично визначали пацієнтам як лихоманку неясного генезу.
Окрім підвищеної температури, у ДЧХ здебільшого визначали також інші клінічні прояви хронічної інтоксикації, пов’язаної з перебігом нефродисбактеріозу та СХБІ, а саме: підвищену слабкість та швидку втомлюваність (581/1952 (29,8 %); дорослі діти скаржилися на сонливість, порушення формули сну (182/835, або 21,8 %), третина дітей шкільного віку — 282/835 (33,8 %) та 58/669 (8,7 %) дітей віком від 3 до 7 років страждали на головний біль, інколи дуже сильний та постійний, що погано піддавався медикаментозній терапії; до типових симптомів можна було зарахувати інтоксикаційні тіні та пастозність під очима, що виявляли у більше ніж половини пацієнтів (1106/1952, або 56,6 %), підвищену пітливість (у 903/1952, або 46,3 %); у 319/835 (38,2 %) школярів відзначали когнітивні порушення, у 195/835 (23,3 %) — запаморочення, у 154/835 (18,4 %) — тахікардію або, навпаки, брадикардію, у 127/835 (15,2 %) — посилене серцебиття, у 198/835 (23,7 %) — вегетосудинну дистонію; у 273/1952 (14 %) ДЧХ із проявами СХБІ виникали фобії, майже в кожної 10-ї дитини шкільного віку (78/835, або 9,3 %) у цьому стані виникали депресія та панічні атаки.
Серед дітей різних вікових груп типовими проявами СХБІ, крім підвищення температури, були різноманітні затримки розвитку: набір маси тіла, мовленнєві, психічні, емоційні розлади і розлади поведінки, що відзначали у 114/448 (25,4 %) дітей віком до 3 років, у 115/669 (17,2 %) — від 3 до 7 років та у 73/835 (8,7 %) школярів, загалом — у 302/1952 (15,5 %) випадках, на біль у суглобах жалілися 102/669 (15,2 %) дитини віком від 3 до 7 років та 260/835 (43 %) — у шкільному віці; у 58/669 (8,7 %) дітей дошкільного віку розвинувся реактивний артрит (у школярів — 128/835, або 15,3 %), який часто набував постійно рецидивуючого характеру; у непоодиноких випадках діти шкільного віку скаржилися на біль у хребті (104/835, або 12,4 %) та у м’язах (44/835, або 5,3 %).
Клінічний образ дітей раннього та дошкільного віку, що часто хворіли, треба ще доповнити частим, зазвичай рецидивуючим ураженням шкіри різноманітними висипами. Ці стани були з різною інтенсивністю ураження: від легкої шорсткості шкіри, рецидивної кропив’янки, еритеми або інших варіантів дерматитів до тяжких пошкоджень за типом поширеного атопічного дерматиту та мокрої екземи з суцільним ураженням шкіри, коли майже не залишалося незайманих ділянок. У ДЧХ із СХБІ такі ураження шкіри розглядали як прояв бактеріальної токсикодермії, яку відзначали у 182/448 (40,6 %) дітей віком до 3 років, у більше ніж половини дітей віком від 3 до 7 років — 347/669 (51,9 %) та у 359/835 (43 %) школярів. Майже кожна п’ята дитина шкільного віку (148/825, або 17,7 %) скаржилася на свербіж шкіри та/або слизових оболонок, при цьому незалежно від наявності чи відсутності висипу на шкірі.
До незвичайних проявів нефродисбактеріозу/СХБІ у ДЧХ можна було віднести токсичне ураження кон’юнктиви: постійне, а інколи нападоподібне відчуття печіння та «піску» в очах, що викликало помірну або нездоланну сльозотечу, що відзначали 70/835 (8,4 %) дітей шкільного віку ІІ групи спостережень, та токсичні кон’юнктивіти, які спостерігали у 18/835 (2,2 %) дітей зазвичай із двостороннім ураженням обох очей з набряком повік, набряком і гіперемією кон’юнктиви, світлобоязню, подальшим посиленням сльозотечі, почервонінням білка очей, сверблячкою очей, а іноді болем в очах.
Одним із також незвичайних симптомів клінічного образу ДЧХ із СХБІ був затяжний рефлекторний кашель як прояв токсичного впливу на слизові оболонки ВДШ, який спостерігали у дітей усіх вікових груп (360/1952, або 18,4 %): віком до 3 років — у 32/448 (7,1 %) дітей, від 3 до 7 років — у 130/669 (19,4 %), у школярів — 198/835 (23,7 %). Цей кашель як один з головних проявів СХБІ не був пов’язаний із запальними процесами в носоглотці та/або дихальних шляхах і мав токсичне походження внаслідок подразнення слизової оболонки задньої стінки глотки та/або трахеї бактеріальними токсинами. Такий сухий невмотивований непродуктивний кашель, який ще можливо було називати кашлюкоподібним синдромом, мав стійкий довготривалий характер і міг триматися від декількох місяців до кількох років: його не можна було вгамувати призначенням ані антибіотиків, ані спазмолітичних чи відхаркувальних препаратів. У всіх пацієнтів з рефлекторним кашлем виявляли супутню до СХБІ хронічну стафілококову інфекцію носоглотки.
До деяких інших рідкісних, але дуже виражених проявів впливу токсинів нейротропної дії відносили виникнення тиків (у 188/1952, або 9,6 %) та епілептичних нападів. Тики частіше відзначали у школярів (140/835, або 16,8 %) порівняно з дітьми дошкільного віку (48/669, або 7,2 %). Частіше тики були довготривалими (понад 1 рік), мали локальний характер із залученням однієї групи м’язів (мімічні на обличчі, найчастіше — моргання) та були простими з елементарними рухами (примруження ока, підморгування, рух вухами, наморщування чола, зведення брів). Упродовж 12 років ми спостерігали загалом 78/1952 (4,0 %) дітей з II групи спостережень ДЧХ із СХБІ, у яких був раніше діагностований (після проведених в інших клініках досліджень) епілептичний синдром невстановленої етіології, зокрема віком до 3 років — 12/448, або 2,7 %, від 3 до 7 років — 51/669, або 7,6 %, та школярі — 15/835, або 1,8 %. У 17/78 (21,8 %) випадках епілептичні напади проявлялися типовими абсансами з раптовим короткочасним відключенням свідомості. У більше ніж половині випадків у цій підгрупі ДЧХ (45/78, або 57,7 %) діти отримували протисудомні препарати з обмеженою або взагалі відсутньою клінічною ефективністю.
Новизна дослідження. Відомо існування діагнозу «діти, що часто хворіють», етіопатогенез та ефективне лікування якого залишалися дійсно не визначеними. Нове: вперше у клінічній практиці визначено та лабораторно підтверджено (за результатами бактеріологічного та токсикологічного дослідження), що клінічний образ дитини, що часто хворіє, зараз є збірним і являє собою унікальну клінічну палітру, яка складається із симптомів рекурентних респіраторних захворювань та/або повторних гострих респіраторних вірусних інфекцій, рецидивуючих гнійно-запальних захворювань носа, глотки, рота, вух, очей та бронхолегеневої системи, а також клінічних проявів синдрому хронічної бактеріальної інтоксикації, що розвинувся на тлі нефродисбактеріозу. Уперше застосовано метод системного лікування ДЧХ бактеріальними вакцинами, виготовленими з автоштамів виділених бактерій.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 15.09.2021
Рецензовано/Revised 30.09.2021
Прийнято до друку/Accepted 10.10.2021

/35.jpg)