Вступ
Лікування інсуліном — вимушена необхідність для частини людей з цукровим діабетом (ЦД), пов’язана з потребою в підтримці оптимального рівня глюкози в крові. Останніми десятиліттями для спроби вирішення цих потреб були розроблені нові препарати інсуліну — аналоги інсуліну (АІ) та запропоновано різні схеми інсулінотерапії. Необхідно враховувати, що нові препарати інсуліну коштують значно дорожче, що може обмежувати їх застосування. Такі фактори, як ефективність лікування, його безпека і задоволеність пацієнтів, повинні прийматися до уваги при прийнятті рішення про вибір терапії, але вартість лікування також не можна ігнорувати, враховуючи, що вона, як правило, підлягає відшкодуванню за бюджетні кошти. У зв’язку з цим інсулінотерапія повинна бути індивідуально підібрана з урахуванням потреб пацієнтів, цілей лікування, його безпеки і вартості.
Світовий ринок інсуліну стає дедалі більшим і, за прогнозами, досягне 76 млрд доларів США до 2023 року [1]. З огляду на той факт, що більшість випадків ЦД припадає на країни з низьким і середнім доходом, ціна інсуліну повинна серйозно розглядатися як одна з найважливіших характеристик, а маркетинг найбільш дорогих продуктів повинен бути як ніколи відповідальним.
На сьогодні накопичений великий обсяг даних, що дозволяє порівняти рекомбінантний інсулін людини (РІЛ) з АІ, включаючи метааналізи порівняльної ефективності та безпеки, а також дані щодо економічної ефективності і дані, що стосуються можливої канцерогенної дії нових продуктів.
Автори пропонують аналіз цих даних щодо доцільності використання АІ порівняно з РІЛ для пацієнтів з ЦД 1-го типу (ЦД1) і пацієнтів з ЦД 2-го типу (ЦД2) й їх ефективності при ЦД обох типів.
Використання рекомбінантних людських інсулінів та аналогів інсуліну при ЦД 1-го та 2-го типів
Згідно з керівництвом 2008 року з лікування ЦД2 Національного інституту здоров’я і досконалості допомоги (National Institute for Health and Care Excellence, NICE) як виконавчого позавідомчого державного органу Департаменту охорони здоров’я Об’єднаного Королівства, розпочинати лікування інсуліном слід з використання нейтрального протаміну Хагедорна (НПХ-інсуліну). Однак застосування АІ тривалої дії як базального інсуліну може розглядатися при певних обставинах, наприклад при підвищеному ризику гіпоглікемії, а також у випадках, коли проблематичною є дворазова щоденна ін’єкція [2].
У спільному Консенсусі Американської діабетичної асоціації (ADA) і Європейської асоціації з вивчення діабету (EASD) [3] не повідомляється, що АІ ультракороткої і тривалої дії більш ефективні щодо зниження рівня глікованого гемоглобіну (HbА1c), ніж короткої або середньої тривалості дії препарати людського інсуліну [4–6].
Згідно зі стандартами ADA 2018 року, для надання медичної допомоги хворим на ЦД1 повинні використовуватися АІ ультракороткої дії для зниження ризику гіпоглікемії. При ЦД2 рекомендується починати інсулінотерапію НПХ-інсуліном, у разі недостатньої ефективності додати одну ін’єкцію інсуліну короткої дії перед основним прийомом їжі або перейти на готові суміші інсулінів, а в разі подальшої недостатньої ефективності перейти на готові суміші АІ або додати ін’єкції інсуліну короткої дії [7]. Однак стандарти ADA 2020 року для надання медичної допомоги при ЦД [8] вже говорять про те, що лікарі при ініціації інсулінотерапії у пацієнтів з ЦД2 повинні використовувати як базальні інсуліни з низьким гіпоглікемічним ефектом. Аналогічним чином були відредаговані рекомендації Європейського товариства кардіологів (ESC) та EASD [9]. Деякі національні керівництва рекомендують сьогодні ще більш радикальний підхід. Зокрема, в Алгоритмах медичної допомоги 2019 р. (Російська Федерація) дані прямі рекомендації починати інсулінотерапію у пацієнтів із ЦД2 з АІ.
США, як країна, яка вже зіткнулася із значним збільшенням витрат, пов’язаних із ЦД, зробили коментар у стандартах ADA 2020 року про важливість прийняття до уваги вартості інсуліну, акцентуючи, що вибір базального інсуліну повинен ґрунтуватися на специфічних для пацієнта міркуваннях, у тому числі — вартості [10].
Керівні принципи NICE з лікування ЦД2, які були переглянуті в 2019 році [11], не містять прямих рекомендацій щодо початку інсулінотерапії для пацієнтів з ЦД2 з АІ, але рекомендують починати з індивідуального вибору типу інсуліну і схеми інсулінотерапії. Рекомендується починати інсулінотерапію з призначення НПХ-інсуліну один або два рази на день відповідно до потреби. Рекомендується розглянути можливість додавання до терапії НПХ-інсуліном інсуліну короткої дії (зокрема, якщо у людини HbA1c становить 75 ммоль/моль (9,0 %) або вище), що вводиться або окремо, або у вигляді попередньо змішаного (двофазного) РІЛ. АІ як альтернатива інсуліну людини розглядаються, якщо: людині потрібна допомога доглядальниці або медичного працівника для ін’єкцій інсуліну, використання АІ знизить частоту ін’єкцій з двох до одного разу на день, або ж спостерігаються часті гіпоглікемічні епізоди, або ж людині потрібні ін’єкції НПХ-інсуліну двічі на день в поєднанні з пероральними цукрознижувальними препаратами. Розглядається можливість використання попередньо змішаних (двофазних) АІ замість попередньо змішаних (двофазних) РІЛ, що включають інсулін короткої дії, якщо: людина потребує отримувати ін’єкції інсуліну безпосередньо перед прийомом їжі, або при частих гіпоглікемічних епізодах, або рівень глюкози в крові помітно підвищується після прийому їжі [11]. Нижче ми напишемо про можливі причини, за якими NICE не поспішає долучатися до загальної тенденції. Дані щодо використання АІ тривалої дії при ЦД1 і ЦД2 також досить неоднозначні: вони не рекомендуються для першого вибору при ЦД1, проте рекомендуються як препарати першого вибору для пацієнтів з ЦД2 в останніх стандартах ADA й ESC/EASD.
Використання готових сумішей АІ є окремою темою для обговорення. Готові суміші інсуліну є одними з найбільш часто використовуваних в багатьох країнах [12]. Між готовими сумішами АІ і звичайними готовими сумішами рекомбінантних інсулінів людини існують помітні відмінності у фармакокінетичних і фармакодинамічних властивостях [13]. Питання в тому, чи мають ці відмінності клінічне значення, залишається відкритим і, безумовно, залежить від стану конкретного пацієнта. Однак АІ можуть підходити не для всіх людей з ЦД. Для багатьох пацієнтів недоліком застосування АІ можуть бути як витрати на терапію [12, 14], так і занадто короткий час дії інсуліну в осіб, у яких особливості інсулінотерапії потребують більш тривалого періоду дії інсуліну, наприклад у тих, хто звик до частих перекусів.
Дуже важливо призначати ту інсулінотерапію, якої пацієнти можуть дотримуватися, оскільки неадекватність фармакотерапії пов’язана з несприятливими наслідками [4].
Використання рекомбінантного інсуліну людини та аналогів інсуліну у пацієнтів з ЦД 2-го типу
У систематичному огляді «Порівняльна ефективність і безпека готових сумішей АІ при ЦД2» було проаналізовано 16 досліджень, в яких проводилося порівняння готових сумішей АІ з готовими сумішами РІЛ. Узагальнений аналіз показав, що готові суміші АІ забезпечують такий самий контроль рівня HbA1c, як і готові суміші РІЛ, і такий самий контроль рівня глюкози в плазмі натще, як і готові суміші РІЛ. Суміші АІ були більш ефективні, ніж суміші РІЛ, відносно зниження постпрандіальної глікемії (ППГ). Готові суміші АІ можуть викликати таку ж частоту випадків гіпоглікемії, як і готові суміші РІЛ. Висновок дослідження полягає в тому, що готові суміші АІ забезпечують глікемічний контроль, подібний до того, який забезпечується готовими сумішами РІЛ, і можуть забезпечити кращий глікемічний контроль порівняно з використанням АІ тривалої дії в комбінації з пероральними цукрознижувальними препаратами, однак дані про клінічні результати вельми обмежені [15].
Наглядове дослідження PROGENS Benefit, спрямоване на порівняння ефективності, безпеки та якості лікування пацієнтів з ЦД2 готовими сумішами РІЛ і готовими сумішами АІ, показало, що як готові суміші АІ, так і РІЛ ефективні і безпечні, і обстежені пацієнти були задоволені обома методами лікування [16].
Згідно з іншим дослідженням з порівняння ефективності та безпеки готової суміші РІЛ (генсулін M30) і готової суміші АІ аспарт 30/70 (новомікс 30) у пацієнтів з ЦД2, рівні глікемії натще, постпрандіальної глікемії і HbA1c вірогідно не відрізнялися в різних групах пацієнтів [17]. Кількість випадків тяжкої і легкої гіпоглікемії також вірогідно не відрізнялася в порівнюваних групах пацієнтів. Лікування готовими сумішами генсулін M30 або новомікс 30 протягом шести місяців призводило до однакового рівня метаболічного контролю пацієнтів (глікемія натще, постпрандіальна глікемія і HbA1c). Готові суміші РІЛ (генсулін М30) і АІ (новомікс 30) показали однаковий профіль безпеки.
Згідно з ще одним оглядом порівняння інсуліну (РІЛ або інсуліни тваринного походження) з АІ, відмінності між АІ і РІЛ щодо метаболічного контролю залишаються дуже малими (тобто 0,09 %) і не є клінічно значущими відмінностями [12]. Отже, наявні дані свідчать про те, що АІ не мають переваг перед РІЛ щодо метаболічного контролю.
Що стосується випадків гіпоглікемії, то АІ, судячи з усього, мають статистично значущі переваги порівняно з РІЛ, але ці переваги не однакові для різних типів інсуліну (ультракороткої або тривалої дії) або типів ЦД, і клінічна важливість цих відмінностей не зрозуміла. Крім того, багато досліджень, які продемонстрували різницю між АІ і РІЛ щодо виникнення гіпоглікемії, виключили пацієнтів з рецидивуючими випадками серйозної гіпоглікемії в анамнезі, тому може виявитися недоцільним припускати, що такі переваги будуть спостерігатися в усіх пацієнтів [17].
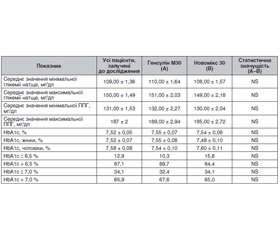
Порівняння ефективності та безпеки готових сумішей РІЛ (генсулін М30) з готовою сумішшю АІ аспарт 30/70 (новомікс 30) у пацієнтів з ЦД2 було основною метою дослідження POLGEN [18]. Пацієнти (557 осіб) з ЦД2 були розподілені на дві групи: ті, хто отримував готові суміші рекомбінантних людських інсулінів і готові суміші АІ (табл. 1).
Будь-які статистично значущі відмінності в рівні основних метаболічних параметрів, пов’язаних з ЦД (глікемія натще, ППГ, HbA1c), відзначалися в процесі дослідження між двома групами (табл. 2).
Також не було виявлено статистично значущих відмінностей у частоті гіпоглікемічних епізодів між обома групами (табл. 3).
Інший системний огляд і метааналіз [19] включав в себе вісім досліджень, в яких порівнювалися ефекти АІ тривалої дії та РІЛ у пацієнтів з ЦД2. Шість досліджень вивчали АІ гларгін і два — детемір. Не було відзначено переваг щодо зниження рівня HbA1c для інсуліну гларгін. Для інсуліну детемір метааналіз показав статистично значущу, але клінічно несуттєву перевагу РІЛ відносно метаболічного контролю. Частота симптоматичних і нічних гіпоглікемічних подій була нижче у пацієнтів, які отримували АІ гларгін, ніж у пацієнтів, які отримували РІЛ. Крім того, для детеміру в двох дослідженнях було показано, що менша кількість пацієнтів відчували загальні або нічні гіпоглікемічні епізоди в групах лікування детеміром. Методологічна якість включених досліджень дозволяє інтерпретувати результати з обережністю.
На сьогодні не було проведено жодного дослідження, спрямованого на вивчення можливих довгострокових ефектів АІ. Тому залишається незрозумілим, чи вплине і якою мірою тривале лікування АІ на розвиток і прогресування мікро- і макросудинних подій порівняно з результатами, отриманими при лікуванні РІЛ. Оскільки відмінності в загальному впливі на метаболічний контроль були незначними для АІ гларгін і РІЛ, і навіть були відсутні для АІ детемір, від лікування АІ тривалої дії не очікується ніяких значних поліпшень у плані розвитку пізніх мікросудинних ускладнень.
Що стосується переваг щодо розвитку тяжких гіпоглікемічних станів, то до них слід ставитися з певною обережністю. Статистично значущих переваг при лікуванні АІ гларгін або детемір не було виявлено. Крім того, інтерпретація результатів частоти тяжкої гіпоглікемії утруднена через суб’єктивність скарг. Пацієнти можуть неправомірно заперечувати тяжкі гіпоглікемії і описувати їх як легкі або середньої тяжкості. Точніші визначення, такі як «ін’єкція глюкози або глюкагону іншою людиною», можуть призвести до отримання більш надійних даних [20].
У всіх проведених дослідженнях частота тяжкої гіпоглікемії була дуже низькою, що робить малоймовірним клінічний ефект від різних режимів інсулінотерапії. Незважаючи на те, що метааналіз виявив послідовне зниження симптомів гіпоглікемії при використанні терапії АІ тривалої дії [19], з цих результатів не можуть бути зроблені надійні висновки, оскільки визначення гіпоглікемії відповідно до описаних симптомів робить їх дуже суб’єктивними, особливо у відкритих дослідженнях. Перевагою АІ гларгін і детемір може бути зниження нічної гіпоглікемії у пацієнтів з ЦД2 порівняно з лікуванням базальним інсуліном. Але знову ж таки, суб’єктивна оцінка не може бути виключена, що ускладнює інтерпретацію результатів.
Жодне дослідження не навело результатів щодо якості життя хворих [20]. Одне з досліджень повідомило дані про більшу задоволеність лікуванням у пацієнтів, які отримували АІ гларгін. Інтерпретація клінічної значущості цього результату ускладнена тим фактом, що вказані лише початкові і кінцеві показники дослідження, хоча автори заявляють про статистично значуще поліпшення зміни задоволеності лікуванням.
Порівняння АІ ультракороткої дії з РІЛ було проведено в огляді Cochrane [4]. Його основною метою була оцінка впливу АІ ультракороткої дії порівняно з РІЛ у пацієнтів з ЦД1 і ЦД2. За даними огляду не було виявлено статистично значущих відмінностей у показниках тривалого метаболічного контролю (HbA1c) між АІ ультракороткої дії порівняно з РІЛ при ЦД2; також не було виявлено статистично значущих відмінностей у частоті виникнення гіпоглікемічних епізодів між АІ ультракороткої дії порівняно з РІЛ у пацієнтів з ЦД2. Три дослідження (одне подвійне сліпе, два відкритих) не виявили істотних відмінностей між АІ і РІЛ; чотири дослідження відзначили поліпшення задоволеності пацієнтів лікуванням у групі АІ (в основному за рахунок змін у зручності, гнучкості та продовженні лікування, а також інтервалу між ін’єкціями і їжею). Цей системний огляд показує лише незначну клінічну перевагу АІ ультракороткої дії у більшості пацієнтів, які отримували інсулін [4].
В іншому дослідженні порівнювалися АІ і РІЛ (АІ тривалої дії і НПХ-інсуліни, і готові суміші АІ з готовими сумішами РІЛ) у пацієнтів з ЦД1 і ЦД2 і жінок з гестаційним діабетом. Мета дослідження полягала у визначенні переваг глікемічного контролю і можливості зниження ризику ускладнень і побічних ефектів. Результати показали, що відмінності в рівні HbA1c і кількості випадків гіпоглікемії незначні і не можуть вважатися клінічно значущими. На думку авторів дослідження, АІ не мають переваг з точки зору глікемічного контролю, але можуть бути корисні в лікуванні пацієнтів із повторюваними епізодами гіпоглікемії для оптимізації існуючого лікування за допомогою РІЛ. Рутинне використання АІ тривалої дії при ЦД2 не рекомендується в зв’язку з високим співвідношенням ціна/ефективність [21].
АІ ультракороткої дії значно відрізняються за фармакокінетикою і фармакодинамікою порівняно з РІЛ. Ґрунтуючись на цих результатах, значно поширена думка, що РІЛ слід вводити за 20–30 хвилин до їжі, щоб знизити рівень постпрандіальної глікемії порівняно з АІ, що вводяться безпосередньо перед прийомом їжі. При цьому інтервал між ін’єкціями і прийомом їжі для пацієнтів з ЦД2 не є обов’язковим [22]. Системний огляд 28 досліджень (10 для ЦД2) показав, що короткодіючі РІЛ та АІ ультракороткої дії (аспарт) допомагають досягти ідентичного глікемічного контролю при ЦД2, і що такі ж результати були отримані при оцінці показників HbA1c і випадків гіпоглікемії, включаючи ризик тяжкої гіпоглікемії. У цьому випадку РІЛ короткої дії показали кращі результати для контролю глікемії натще, а АІ ультракороткої дії (аспарт) — кращі результати для контролю постпрандіальної глікемії [23]. Інше дослідження, проведене в Німеччині, показало, що довгострокові переваги використання АІ тривалої дії для ЦД1 у цілому не були адекватно вивчені, і немає ніяких доказів переваг АІ гларгін і детемір порівняно з НПХ-інсуліном [24].
Вивчення використання АІ тривалої дії при ЦД2 [25] не показало переваг АІ гларгін і детемір порівняно з НПХ-інсуліном у пацієнтів, які не отримували інтенсивну інсулінотерапію; у пацієнтів, які отримували інтенсивну інсулінотерапію, базальні АІ в поєднанні з пероральними цукрознижувальними препаратами також не показали переваг АІ гларгін і детемір порівняно з НПХ-інсуліном, за умови, що терапія РІЛ була оптимізована. Було відзначено, що загалом довгострокова користь від використання АІ тривалої дії з точки зору впливу на розвиток пізніх ускладнень ЦД не цілком зрозуміла.
Вивчення використання АІ ультракороткої дії при ЦД1 [26] показало, що переваги аспарт порівняно з РІЛ у дорослих пацієнтів не цілком очевидні внаслідок недостатньої кількості даних; у пацієнтів з більш високим ризиком гіпоглікемії аналогічні результати були продемонстровані при використанні АІ ультракороткої дії лізпро та РІЛ; переваги інсуліну лізпро у пацієнтів з підвищеним ризиком тяжкої гіпоглікемії не очевидні.
Економічні аспекти інсулінотерапії
Оцінки економічної ефективності АІ перебувають у широких межах — від дещо більше 500 євро до понад 412 000 фунтів стерлінгів за рік життя з поправкою на якість (Quality-Adjusted Life Year, QALY). Оцінки, які вказують на ефективність витрат, як правило, специфічні для конкретної групи населення і режиму, однак більш широкий і всеосяжний аналіз показує, що АІ, мабуть, недостатньо ефективні з точки зору витрат.
Як і раніше, відсутні дані, що стосуються більш довгострокових наслідків ЦД, таких як смертність і пізні ускладнення. З огляду на відсутність очевидних переваг для АІ в плані боротьби з гіперглікемією, а також непослідовні і клінічно суперечливі переваги, пов’язані з виникненням гіпоглікемії, поряд із занепокоєнням з приводу якості досліджень, наявні дані не свідчать про значну перевагу АІ порівняно з РІЛ як для ЦД1, так і для ЦД2.
Всесвітня організація охорони здоров’я (ВООЗ) двічі відмовлялася додавати АІ до списку основних лікарських засобів. Так, в 2011 році було заявлено, що для ЦД1 і ЦД2 АІ ультракороткої дії і тривалої дії не демонструють виражених переваг порівняно з РІЛ на тлі розрізнених статистичних даних про позитивні властивості і відсутність клінічно значущих переваг. Не було доведено, що АІ економічно ефективні, а зв’язок між АІ і підвищеним ризиком розвитку раку до цього часу залишається невизначеним. Експертна комісія ВООЗ відзначила відсутність даних про переваги АІ порівняно з рекомбінантними людськими інсулінами. Наявні дані про вплив АІ на ступінь зниження рівня HbA1c і випадків гіпоглікемії оцінюються як скромні і такі, що не виправдовують існуючу в даний час значну різницю в цінах між АІ і РІЛ [27].
Майже такий самий висновок [1] був зроблений в 2017 році: експертна комісія відзначила відсутність даних про переваги АІ над РІЛ. Наявні дані про вплив АІ на ступінь зниження рівня HbA1c і випадків гіпоглікемії не виправдовують існуючу істотну різницю в цінах між АІ і РІЛ. Економічна ефективність АІ залежить від виду АІ і типу ЦД. За винятком АІ ультракороткої дії при ЦД1, рутинне використання АІ, особливо тривалої дії при ЦД2, навряд чи буде представляти собою ефективне використання обмежених ресурсів охорони здоров’я [13].
Згідно зі звітом Національної служби охорони здоров’я (NHS) Великої Британії про призначення АІ за 10-річний період (з 2000 по 2009 рік) [28], NHS витратила в цілому 2732 млн фунтів стерлінгів на інсулін (вартість була скоригована з урахуванням інфляції і повідомлена за цінами 2010 року). Загальна вартість збільшилася на 130 %. Річна вартість АІ збільшилася з 18,2 млн (12 % від загальної вартості інсуліну) до 305 млн (85 % від загальної вартості інсуліну), в той час як вартість РІЛ зменшилася з 131 млн (84 % від загальної вартості інсуліну) до 51 млн (14 % від загальної вартості інсуліну). Якщо припустити, що всі пацієнти, які використовують АІ, могли б отримати РІЛ замість них, то загальна додаткова вартість АІ становила 625 млн фунтів стерлінгів. Дане дослідження дійшло висновку, що, з огляду на високу вартість АІ, дотримання настанов, які рекомендують переважне використання РІЛ, призвело б до значної фінансової економії протягом цього періоду.
Приклад Великої Британії, де вартість інсулінової терапії для пацієнтів з ЦД1 збільшилася втричі за період 1997–2007 рр., в основному за рахунок використання дорогих АІ, але поліпшення рівня HbA1c було досягнуто тільки на рівні –0,1 % (8,5–8,4 %), широко відомий. У разі, якщо протягом п’яти років 50 % людей отримували б РІЛ замість АІ, можна було б додатково найняти 400 лікарів або 1000 спеціалізованих медсестер. Досвід Великої Британії показує, що клінічні переваги АІ не корелюють з їх високою ціною, очевидних клінічних переваг використання АІ у більшості пацієнтів немає. З огляду на високу вартість АІ, дотримання настанов, що рекомендують переважаюче використання РІЛ, призведе до значної фінансової економії за цей період [11].
Очевидно, що завдяки такому об’єктивному аналізу нинішні британські рекомендації не містять таких прямих рекомендацій щодо призначення АІ для ЦД2 порівняно з настановами інших країн.
У 2006 році Об’єднаний Федеральний Комітет (центр прийняття рішень в галузі охорони здоров’я Німеччини) рекомендував не фінансувати використання АІ ультракороткої дії при ЦД2. Це призвело до зниження вартості цих препаратів до рівня РІЛ. У 2009 і 2010 роках було вирішено не компенсувати вартість АІ тривалої дії для людей з ЦД1 і ЦД2 і АІ ультракороткої дії для людей з ЦД1 до тих пір, поки їх ціна не буде знижена до рівня ціни РІЛ. Відшкодування таких витрат має відбуватись лише в разі алергії на РІЛ та при високому ризику тяжкої гіпоглікемії [29].
Дослідники з Health Partners Institute в Міннеаполісі узагальнили дані 127 тис. пацієнтів з ЦД2. У період 2000–2013 років вони отримували призначений лікарем інсулін. У середньому через 2,5 року, незалежно від типу введеного інсуліну, спостерігався аналогічний рівень розвитку інфаркту міокарда, інсульту, серцевої недостатності та смертності. Не було різниці в результатах при застосуванні АІ або РІЛ у дорослих з ЦД2. Тому серцево-судинні наслідки і смертність не повинні бути мотивуючими факторами при виборі типу інсуліну у дорослих з ЦД2. Важливі фактори, які слід враховувати, — гіпоглікемія, контроль глікемії, вартість лікування і простота використання. Недавні звіти показали аналогічний вплив РІЛ і АІ на рівень контролю глюкози, частоту серйозної гіпоглікемії в первинній ланці при лікуванні ЦД2 [30].
Використовуючи наведені вище дані, автори вказують на необхідність оптимізації витрат для покриття потреб людей, які страждають від ЦД.
Невмотивоване збільшення витрат у зв’язку з підвищенням вартості інсулінової терапії може призвести до довгострокових наслідків для цієї вразливої категорії пацієнтів. Нинішня ситуація наполегливо наголошує на необхідності проведення ефективної програмної політики: по-перше, оптимізувати витрати і, по-друге, підвищити повсюдну доступність інсуліну. Ці два взаємопов’язані процеси поряд з популяризацією немедикаментозних підходів і необхідних змін способу життя (зміна раціону харчування, фізичної активності, відмова від куріння і т.д.) повинні стати наріжним каменем у наданні допомоги людям із ЦД.
Іншим обов’язковим підходом повинен стати аналіз тривалого використання різних видів інсуліну, в першу чергу аналогів інсуліну порівняно з рекомбінантними інсулінами людини в плані розвитку пізніх ускладнень ЦД. Остання радикальна зміна парадигми інсулінотерапії — відмова від використання інсуліну тваринного походження — призвела, щонайменше, до майже повного зникнення ускладнень інсулінотерапії. Які зміни ми очікуємо в зв’язку з масовою відмовою від вживання рекомбінантних інсулінів людини на користь аналогів інсуліну? За якими параметрами наукове товариство планує оцінити ефективність цього кроку? Якщо у нас немає чіткої відповіді, то слід подумати двічі, перш ніж призначати сучасні, але дорогі ліки.
Висновок
Необхідно розробити розумну політику використання інсулінової терапії на основі наявних клінічних даних, заснованих на порівняльних дослідженнях у різних групах хворих на цукровий діабет і всебічному аналізі економічних даних. Доцільність застосування нового препарату повинна оцінюватися і регулярно переглядатися з урахуванням практичних результатів його застосування в клінічній практиці. Необхідно також регулярно проводити ретроспективний економічний аналіз для оцінки фармакоекономічних переваг. Усі ці кроки повинні допомогти особам, які приймають рішення, та регуляторним органам у реалізації ефективних національних програм з розробкою нових ефективних систем закупівлі інсуліну.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів та власної фінансової зацікавленості при підготовці даної статті.
Отримано/Received 03.08.2021
Рецензовано/Revised 14.09.2021
Прийнято до друку/Accepted 11.10.2021

/63.jpg)
/64.jpg)