Визначення та епідеміологія
Мігрень — це хронічне захворювання, яке проявляється нападами пульсуючого одностороннього головного болю (ГБ), що триває 4–72 години та супроводжується підвищеною чутливістю до світла, звуків, нудотою або блюванням (мігрень без аури) [28]. Нападу ГБ при мігрені може передувати аура (минущі неврологічні порушення), що зазвичай триває не більше 60 хвилин (мігрень з аурою) [28].
Поширеність мігрені в популяції країн Європи і США в середньому становить 14 % (17 % серед жінок і 8 % серед чоловіків) [2, 7]. Поширеність мігрені досягає максимуму у віці від 35 до 39 років, а близько 75 % хворих повідомляють про початок мігрені у віці до 35 років [52]. Мігрень не має фатального характеру, проте, за даними проєкту «Глобальний тягар хвороб» (GBD, 2019), займає серед неврологічних захворювань у чоловіків і жінок віком до 50 років третє місце у світі за поширеністю і друге місце — за кількістю років, прожитих з непрацездатністю [50].
Етіологія та патогенез
Мігрень є хронічним нейроваскулярним захворюванням зі спадковою схильністю. Тригеміноваскулярна система (ТВС) розглядається як анатомо-фізіологічний субстрат, що ініціює ноцицептивну передачу, внаслідок чого виникає сприйняття мігренозного болю. При впливі ендогенних та екзогенних мігренозних тригерів посилюється збудливість кори, гіпоталамуса та стовбура головного мозку, відбувається активація ТВС [5, 32]. Активація ТВС супроводжується викидом із тригеміноваскулярних закінчень больових прозапальних пептидів — вазодилататорів, в першу чергу кальцитонін-ген-спорідненого пептиду (calcitonin-gene-related peptide, CGRP), а також нейрокініну А і субстанції Р [25]. Виникаючі після цього вазодилатація та нейрогенне запалення призводять до активації больових рецепторів у стінках судин твердої мозкової оболонки. Больові імпульси надходять у сенсорну кору головного мозку, що призводить до виникнення відчуття мігренозного болю [25].
Мігренозну ауру пов’язують із виникненням і поширенням у напрямку від зорової кори до соматосенсорної та лобово-скроневої ділянок головного мозку хвилі деполяризації (збудження) нейронів — кіркової депресії (КДР), що поширюється та порушує іонні градієнти та супроводжується церебральною гіпоперфузією [3]. Швидкість і топографія КДР визначають темп, характер і послідовність симптомів виникаючої аури [1]. Гемодинамічні зміни, які супроводжують КДР, були задокументовані при нейровізуалізації в пацієнтів з мігренню з аурою, тоді як у пацієнтів з мігренню без аури ніяких змін виявлено не було [3]. У можливому каскаді подій саме КДР тимчасово відкриває нейрональні канали паннексину-1, що призводить до вивільнення медіаторів запалення (наприклад, оксиду азоту і простагландинів), які є дилататорами внутрішньочерепних артерій [25].
Генетичні особливості
У родинному анамнезі мігрень зустрічається часто, причому спадкування оцінюється приблизно в 42 % [23]. Більшість генів мають нейронну або судинну функцію. У метааналізі геному було ідентифіковано 38 локусів сприйнятливості до мігрені, а варіанти ризику розвитку мігрені мають гени, що пов’язані з судинною та вісцеральною гладкою мускулатурою [23]. Також виявляються гени, що відповідають за іонні канали, глутаматергічну трансмісію, больову чутливість і оксидантний стрес. Крім того, один ген може відповідати за декілька функцій [54].
Таким чином, генетичні дослідження показали, що ризик розвитку мігрені є полігенним, за рідкісним винятком пов’язаного з мігренню моногенного синдрому, зокрема родинної геміплегічної мігрені [23, 54].
Клінічна картина, діагностика і класифікація
Мігрень проявляється повторюваними однотипними нападами інтенсивного, частіше однобічного та пульсуючого ГБ, переважно в ділянці скроні, очей і тімені, але нерідко біль може виникати в ділянці потилиці, переходити з одного боку на інший (чергування сторін) або, рідше, мати двобічний характер. ГБ при мігрені супроводжується нудотою, блюванням, підвищеною чутливістю до світла, звуків і посилюється при фізичному навантаженні. Тривалість нападу становить від 4 годин до 3 діб; кількість днів з ГБ при епізодичній мігрені коливається від одного на рік до 14 на місяць (в середньому 2–4 дні з ГБ на місяць), при хронічній мігрені — ≥ 15 днів з ГБ на місяць [2, 28].
При мігрені з аурою фазі ГБ передують минущі нев-рологічні порушення. Аурою можуть бути порушення зору, зорові, нюхові, смакові, слухові або тактильні галюцинації, стовбурові симптоми [28].
Найбільш типовою є зорова аура, що проявляється різними феноменами (в 90 % випадків): фотопсіями, «мушками», однобічним випадінням полів зору, мерехтливою скотомою або зигзагоподібними лініями, що світяться [2]. У рідкісних випадках після аури фаза ГБ може бути відсутньою (типова аура без ГБ). При мігрені зі стовбуровою аурою поряд із зоровими, чутливими і/або мовленнєвими порушеннями виникають два або більше повністю оборотних стовбурових симптоми: дизартрія, запаморочення, шум у вухах, зниження слуху, диплопія, атаксія або знижений рівень свідомості. Для геміплегічної мігрені характерні повністю оборотні як зорові, чутливі та/або мовленнєві симптоми, так і рухові порушення (геміпарез або геміплегія). Тривалість деяких симптомів становить 5–60 хвилин, рухових розладів — до 72 годин [2].
Невід’ємною рисою мігрені є її рецидивуючий характер. Вважається, що напад мігрені може бути спровокований різними екзо- й ендогенними факторами. Найбільш частими тригерами мігрені [2] є:
— психологічні чинники: стрес, тривожні або депресивні порушення, перевтома або розслаблення після стресу;
— зміна погоди;
— гормональні чинники: період менструації, овуляції, прийом замісної гормональної естрогенумісної терапії або комбінованих оральних контрацептивів;
— дієтичні фактори: голод, вживання низки харчових продуктів (сиру, шоколаду, горіхів, копченостей, курячої печінки, авокадо, цитрусових або кофеїновмісних продуктів);
— прийом алкоголю (особливо червоного вина);
— інші фактори: нестача або надлишок нічного сну, задуха, фізичне аеробне навантаження, зорові стимули (яскраве або мерехтливе світло), шум, перебування на висоті.
Пацієнти часто описують фактори, що, на їхню думку, викликають напади мігрені (наприклад, стрес, порушення сну, певні продукти харчування та відмова від їжі). Однак, за даними літератури, ретроспективні оцінки тригерів нападу мігрені можуть бути обмежені упередженістю та помилковою атрибуцією [30]. Висока частота неправильного визначення тригерів мігрені підтверджується дослідженням, метою якого було спровокувати напади мігрені, піддаючи пацієнтів, які мали в анамнезі мігрень з аурою, впливу тригерів. Тільки у 3 із 27 пацієнтів розвинулися напади мігрені після впливу їх особистих тригерів, що свідчить, всупереч поширеній думці, про те, що роль цих тригерів є обмеженою [30].
Діагностичні критерії мігрені
Діагностика мігрені є клінічною, тобто ґрунтується на аналізі скарг, даних анамнезу пацієнта, нормальних результатах неврологічного огляду й відповідності клінічних проявів захворювання діагностичним критеріям Міжнародної класифікації головного болю 3-го перегляду (МКГБ-3) [28].
Відповідно до МКГБ-3 виділяють основні форми мігрені: мігрень без аури (найбільш поширена — до 80 % випадків) і мігрень з аурою (до 20 % випадків) [28].
Основним клінічним проявом мігрені без аури є напад ГБ, при мігрені з аурою больовій фазі нападу передує стадія аури. Найбільш часто зустрічається мігрень з типовою аурою.
Окремо в МКГБ-3 виділяють хронічну мігрень, ускладнення мігрені й епізодичні синдроми, що можуть поєднуватися з мігренню та найчастіше зустрічаються в дитячому віці [28]. Хронічна мігрень є найбільш тяжкою формою мігрені, що обумовлює виражену дезадаптацію та зниження якості життя пацієнтів [2].
МКГБ-3 надає діагностичні критерії для трьох основних категорій мігрені: мігрені без аури, мігрені з аурою та хронічної мігрені.
Діагностичні критерії мігрені без аури (згідно з МКГБ-3) [28]:
А. Щонайменше п’ять нападів, які відповідають критеріям В–D.
В. Тривалість нападів 4–72 години (без лікування або при відсутності ефекту від лікування).
С. ГБ має як мінімум дві з наступних чотирьох характеристик:
1) однобічна локалізація;
2) пульсуючий характер;
3) середня або виражена інтенсивність болю;
4) ГБ посилюється від звичайної фізичної активності або вимагає припинення звичайної фізичної активності (наприклад, ходьба або підйом сходами).
D. ГБ супроводжується як мінімум одним із таких симптомів:
1) нудота та/або блювання;
2) фото- і фонофобія.
Е. ГБ не відповідає більшою мірою іншому діагнозу з МКГБ-3.
Діагностичні критерії мігрені з аурою (згідно з МКГБ-3) [28]:
А. Щонайменше два напади, які відповідають критеріям В і С.
В. Один або більше з таких повністю оборотних симптомів аури:
1) зорові;
2) сенсорні;
3) мовленнєві та/або пов’язані з мовленням;
4) рухові;
5) стовбурові;
6) ретинальні.
С. Щонайменше три з наступних шести характеристик:
1) як мінімум один симптом аури поступово наростає протягом > 5 хвилин;
2) два або більше симптоми виникають послідовно;
3) кожен із окремо взятих симптомів триває 5–60 хвилин;
4) як мінімум один із симптомів аури є однобічним;
5) як мінімум один із симптомів аури є позитивним;
6) протягом 60 хвилин після аури або під час неї виникає ГБ.
D. ГБ не відповідає більшою мірою іншому діагнозу з МКГБ-3.
Діагностичні критерії хронічної мігрені (згідно з МКГБ-3) [28]:
А. ГБ (мігренеподібний та/або подібний до головного болю напруження) ≥ 15 днів на місяць протягом ≥ 3 місяців, що задовольняє критеріям В і С.
В. Виникнення ≥ 5 нападів, що відповідають критеріям B–D класифікації мігрені без аури та/або критеріям B–С класифікації мігрені з аурою.
С. Виникнення ГБ ≥ 8 днів на місяць протягом 3 місяців, що відповідає будь-якому з таких критеріїв:
— мігрень без аури (критерії C і D);
— мігрень з аурою (критерії B і С);
— на думку пацієнта, був напад мігрені, який купірується або полегшується прийомом препарату групи триптанів або препаратів, що містять ерготамін.
D. ГБ не відповідає більшою мірою іншому діагнозу з МКГБ-3.
Оцінка ступеня впливу мігрені на повсякденну активність пацієнтів має важливе медико-соціальне значення. Для цього в міжнародній практиці використовується шкала MIDAS (Migraine Disability Assessment) [51].
Діагностика ускладнень мігрені, до яких відносяться мігренозний статус, персистуюча аура без інфаркту, мігренозний інфаркт (інсульт) і епілептичний напад, викликаний мигренозною аурою, також є клінічною [28].
Мігренозний статус — це типовий виснажливий напад мігрені, що триває > 72 годин, протягом якого допускаються ремісії до 12 годин, пов’язані зі сном або дією препаратів.
Персистуюча аура без інфаркту — один або кілька симптомів аури, що тривають у пацієнтів > 1 тижня, без радіографічних ознак інфаркту мозку. Для диференціальної діагностики з мігренозним інфарктом необхідне проведення магнітно-резонансної томографії головного мозку.
Мігренозний інфаркт (інсульт) — це поєднання одного або більше симптомів мігренозної аури з ішемічним пошкодженням мозку, підтвердженим нейровізуалізаційними методами. Істинний мігренозний інфаркт розвивається на тлі типового нападу мігрені з аурою, причому один або кілька симптомів аури тривають > 60 хвилин. Церебральні інфаркти, що не збігаються за часом з нападом мігрені з аурою, не можуть бути віднесені до мігренозних інфарктів.
Обстеження пацієнта з мігренню
Фізикальне обстеження включає ретельне дослідження неврологічного статусу з метою виключення органічної неврологічної симптоматики [2, 28].
При типовому перебігу мігрені неврологічний статус незмінений. При наявності у пацієнта органічної неврологічної симптоматики (менінгеальних, загальномозкових або інших вогнищевих знаків) рекомендується проведення додаткових інструментальних досліджень з метою виключення симптоматичного характеру мігрені [28].
Інструментальні дослідження і консультації фахівців рекомендовані тільки при підозрі на симптоматичний характер мігрені, тобто при нетиповому перебігу мігрені або при виявленні одного або більше сигналів небезпеки («червоних прапорців») [2, 28].
Перелік насторожуючих симптомів (сигналів небезпеки) у пацієнтів із головним болем:
— ГБ, який вперше виник після 50 років, або ГБ, який змінив свій перебіг;
— «громоподібний» ГБ або ГБ, що зростає до 10 балів за візуальною аналоговою шкалою за 1–2 секунди;
— виключно однобічний ГБ;
— ГБ без ремісій, що прогресивно посилюється;
— ГБ, що виник раптово або є незвичним для пацієнта;
— атипова мігренозна аура (з незвичними зоровими, сенсорними або руховими порушеннями та/або тривалістю > 1 години);
— зміна свідомості (оглушення, сплутаність або втрата пам’яті) або психічні порушення;
— осередкові неврологічні симптоми та симптоми системного захворювання (підвищення температури тіла, шкірні висипання, ригідність м’язів шиї, артралгії або міалгії);
— ознаки внутрішньочерепної гіпертензії (посилення ГБ при кашлі, напруженні, фізичному навантаженні);
— набряк диска зорового нерва;
— ВІЛ-інфекція, онкологічне, ендокринне чи інше системне захворювання або травма голови в анамнезі;
— дебют ГБ під час вагітності або в післяпологовому періоді;
— неефективність адекватно проведеного лікування.
Лікування
Основні цілі лікування мігрені — зменшення частоти й тяжкості нападів ГБ, зниження кількості знеболюючих засобів, що приймаються пацієнтом, профілактика хронізації захворювання і поліпшення якості життя хворих. Для досягнення цих цілей використовуються такі підходи: купірування нападів ГБ і профілактичне лікування, немедикаментозні методи лікування [28].
Купірування нападу мігрені
Медикаментозна терапія нападу мігрені призначається залежно від тяжкості нападу і ступеня дезадаптації пацієнта з урахуванням побічних ефектів препаратів [44]. При нападах легкого та помірного ступеня тяжкості рекомендують прості анальгетики та нестероїдні протизапальні засоби: ацетилсаліцилову кислоту 1000 мг, ібупрофен 400–800 мг, напроксен 550–1100 мг, диклофенак 50–100 мг, парацетамол 1000 мг [17, 34, 37, 45, 55]. При наявності у пацієнтів нудоти та/або блювання призначають антиеметики: метоклопрамід 10–20 мг, домперидон 20–30 мг. Вони також здатні покращити всмоктування анальгетиків шляхом зменшення гастростазу [17, 34, 37, 45, 55]. При тяжких нападах рекомендують триптани: суматриптан 50–100 мг, золмітриптан 2,5–5 мг, ризотриптан 10–20 мг. При мігрені без аури триптани слід приймати на самому початку нападу ГБ; при мігрені з аурою під час аури слід приймати ацетилсаліцилову кислоту або, якщо ГБ виникає одночасно з аурою або в кінці аури, триптани в кінці фази аури або на початку фази ГБ [11].
Превентивна терапія
Приблизно 38 % пацієнтів з епізодичною мігренню можуть отримати користь від профілактичної терапії, але лише менше 13 % хворих приймають профілактичні препарати [24]. Профілактична фармакотерапія знижує частоту, тяжкість нападів мігрені та дистрес, пов’язаний з ГБ, поліпшує якість життя і запобігає прогресуванню хронічної мігрені [24].
Превентивне лікування рекомендується пацієнтам, у яких спостерігаються [5, 16, 27, 31]:
— три або більше інтенсивних напади ГБ протягом місяця;
— ≥ 8 днів на місяць з ГБ при адекватному купіруванні нападів мігрені;
— тяжкі та пролонговані аури, навіть при невеликій частоті нападів;
— неефективність або погана переносимість препаратів для купірування нападів мігрені;
— хронічна мігрень;
— лікарсько-індукований ГБ;
— бажання самого пацієнта приймати профілактичну терапію для полегшення перебігу мігрені та поліпшення якості життя;
— наявність мігренозного інфаркту або мігренозного статусу в анамнезі;
— мігрень зі стовбуровою аурою;
— геміплегічна мігрень;
— виражені коморбідні порушення (в першу чергу психічні).
Профілактичне лікування вважають ефективним, якщо кількість днів із ГБ скорочується через 3 місяці терапії на 50 % і більше від вихідного значення [27, 31].
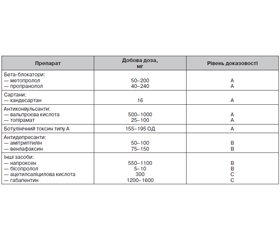
Як лікарські засоби першого вибору для профілактики мігрені рекомендуються бета-адреноблокатори (метопролол, пропранолол), антиконвульсанти (топірамат, вальпроєва кислота), ботулінічний токсин типу А — гемаглютинін комплекс (тільки для хронічної мігрені) і моноклональні антитіла до пептиду, що кодуються геном кальцитоніну (CGRP) або його рецепторів [7, 13, 24, 29, 41, 56].
Як засоби другого вибору для профілактики мігрені призначають бета-блокатори (метопролол, пропранолол), антидепресанти (амітриптилін, венлафаксин) і антагоніст рецепторів ангіотензину II (кандесартан) [24, 31, 53, 58] (табл. 1).
Пацієнтам із хронічною мігренню для зниження частоти нападів мігрені необхідна превентивна терапія, ефективність якої визначається впливом на основні патофізіологічні механізми хронізації болю при хронічній мігрені: сенситизацію тригемінальних нейронів, зниження антиноцицептивних церебральних впливів стовбура, а також підвищення збудливості нейронів кори головного мозку [7].
Застосування протиепілептичних препаратів у превентивному лікуванні мігрені було ініційовано коморбідністю мігрені й епілепсії (їх поєднання зустрічається частіше, аніж кожне з захворювань окремо) [5]. Спільність клінічної картини мігрені й епілепсії (пароксизмальний перебіг) і терапевтична відповідь на одні й ті ж фармакологічні препарати дозволяють припустити наявність в обох нозологіях подібних патогенетичних механізмів [49]. Знеболюючий ефект антиконвульсантів, серед яких найкращу доведену ефективність при хронічній мігрені має топірамат, обумовлений збільшенням порогу збудливості, що призводить до стабілізації нейронів і, таким чином, до зниження гіперзбудливості кіркових нейронів, що вважається важливим електрофізіологічним параметром, який лежить в основі патогенезу епілепсії та мігрені [46]. Механізм дії топірамату є мультиспрямованим і пояснюється впливом на ней-ротрансмісію у ноцицептивній системі за допомогою зниження надмірної активності сенситизованих тригемінальних нейронів шляхом впливу на Na+- і Ca2+-іонні канали, пригніченням вивільнення кальцитонін-ген-спорідненого пептиду, здатністю перешкоджати ней-рональній гіперзбудливості, модулюючи вивільнення глутамату, а такоже наявністю нейропластичних властивостей, що дає підставу віднести протиепілептічні препарати (топірамат) до нейромодуляторів або ней-ростабілізаторів [33, 49].
Дослідження показують, що при мігрені спостерігаються субклінічні структурні зміни мозку й стійкі зміни сприйняття болю, які в деяких випадках корелюють з тривалістю захворювання і частотою нападів та можуть відігравати роль у трансформації епізодичної мігрені в її хронічні форми [46]. Раннє і тривале профілактичне лікування може знизити ризик такої трансформації. Дані дослідження свідчать про те, що топірамат за рахунок зменшення частоти нападів мігрені і використання ліків може запобігти негативному прогресуванню епізодичної мігрені в її хронічну форму [33, 49]. В літературі опубліковані результати трьох широкомасштабних плацебо-контрольованіх досліджень, у яких вивчались ефективність і безпека профілактичного лікування мігрені топіраматом у дозах 50, 100 і 200 мг на добу в пацієнтів із хронічною мігренню і лікарсько-індукованим ГБ. За даними досліджень, превентивна терапія топіраматом у добовій дозі 100 мг знижує частоту й інтенсівність мігренозних атак і покращує якість життя пацієнтів [22]. У дослідженні А.М. Кривчун (2018) показано, що топірамат в дозі 50 мг на добу знижує частоту, тривалість та інтенсивність мігренозних атак та є ефективним препаратом для превентивного лікування мігрені [4]. У дослідженні Г.Р. Табеєвої (2012) також доведена ефективність застосування топірамату в дозі 100 мг у пацієнтів з частою епізодичною мігренню та хронічною мігренню [1].
Дані дослідження S.D. Silberstein (2017) свідчать про перевагу застосування пролонгованої форми топірамату порівняно з формою з негайним вивільненням, що ґрунтується на фармакодинамічному ефекті топірамату, пов’язаному зі значним зниженням коливань концентрації в плазмі при уповільненні всмоктування препарату. Результати ретроспективних досліджень пацієнтів з мігренню підтверджують клінічно значущу перевагу топірамату з пролонгованим вивільненням порівняно з топіраматом із негайним вивільненням з точки зору значно більш рідкого розвитку побічної дії у вигляді когнітивного дефіциту, поліпшення прихильності до лікування та загальних кращих результатів профілактики мігрені за допомогою топірамату з пролонгованим вивільненням [49].
На сьогодні нейрофізіологічне дослідження (електроенцефалографія, транскраніальна магнітна стимуляція, електроміографія) активно застосовується для функціональної оцінки компонентів нервової системи і тому стало цінним інструментом для вивчення патофізіології мігрені й ефективності проведеного фармакологічного лікування [9]. У сучасній літературі є дані, що підтверджують клінічну та нейрофізіологічну ефективність топірамату. Дані досліджень, в яких застосовували транскраніальну магнітну стимуляцію (ТМС), показали, що в процесі лікування топіраматом у пацієнтів з частою епізодичною мігренню і хронічною мігренню знижується збудливість рухової та зорової кори головного мозку [6]. У пацієнтів з мігренню одночасно з клінічним поліпшенням перебігу мігрені змінювалися показники кортикальної збудливості, що були оцінені з використанням методу ТМС [6]. Так, спочатку більш низький, ніж у здорових, поріг викликаної моторної відповіді і поріг фосфенезу в пацієнтів із хронічною мігренню на тлі лікування топіраматом підвищувались, що свідчило про вихідну кортикальну гіперзбудливість та її регрес на тлі лікування [6]. За результатами досліджень В. Шевченко, А. Артеменко і співавт. (2018), зміна кортикальної збудливості під впливом топірамату відрізняється від такої при прийомі інших лікарських засобів для профілактики мігрені [6]. Наприклад, застосування вальпроєвої кислоти, метопрололу та леветирацетаму в пацієнтів з мігренню призводило до підвищення тільки порогу фосфогенезу [21, 60]. У роботі В. Шевченко (2018) виявлена відсутність значущих кореляцій між частотою ГБ, порогом фосфогенезу і порогом викликаної моторної відповіді на тлі лікування топіраматом. Даний факт дозволяє вважати, що клінічний ефект топірамату не може бути пояснений тільки впливом на збудливість кори головного мозку [6]. Ймовірно, вплив топірамату на різні патофізіологічні механізми хронічної мігрені, включаючи кортикальну гіперзбудливість, є основою його високої клінічної ефективності [6].
Таким чином, топірамат, ймовірно, є мультимодальним профілактичним засобом, висока клінічна ефективність якого пояснюється можливістю його дії при різних формах мігрені: зниження частоти епізодичної мігрені, профілактика та лікування хронічної мігрені.
Немедикаментозне лікування мігрені
Фармакотерапію мігрені доцільно поєднувати з немедикаментозними методами, що підвищують ефективність лікування в цілому і комплаєнтність пацієнтів. За даними досліджень, найбільшу ефективність при мігрені (рівень доказовості В–С) мають біологічний зворотний зв’язок (БЗЗ), когнітивно-поведінкова терапія (КПТ) і ТМС. Помірний ефект (недостатній рівень доказовості) мають фізіотерапія, голкорефлексотерапія й остеопатичні техніки. При наявності в пацієнтів з мігренню вираженої дисфункції перикраніальних м’язів можуть бути корисними постізометрична релаксація, масаж комірцевої зони, мануальна терапія, лікувальна гімнастика [2, 5].
Метод БЗЗ є ефективним у лікуванні мігрені та проводиться з використанням спеціального обладнання для реєстрації, посилення та «звороту» пацієнту фізіологічної інформації [43]. Підґрунтям БЗЗ є залежність між вегетативними та психічними функціями організму. L.S. Williams зі співавт. повідомляють про відсутність неврологічних захворювань, що перебігають без коморбідних тривожних або депресивних розладів [57]. Тривога прямо пов’язана з напруженням попереч-но-смугастої мускулатури, в процесі температурно-міо-графічного тренінгу зниження тривоги відбувається за рахунок глибокої релаксації [24].
КПТ — психотерапевтичний метод, що рекомендується пацієнтам як профілактичне лікування епізодичної та хронічної мігрені. КПТ може призначатися пацієнтам з різною частотою мігренозних нападів [24, 26, 38].
ТМС на сьогодні є одним із багатообіцяючих методів, який призводить до зменшення частоти, тривалості та інтенсивності нападів мігрені, коморбідних депресивних розладів і пов’язаних з ними функціональних порушень, а також частоти застосування знеболюючих препаратів. Експертна група оцінила як помірний загальний рівень доказовості та рекомендації для клінічного застосування TMС для лікування нападів мігрені та її профілактики [40]. Безпека TMС у клінічній практиці, зокрема при лікуванні гострої мігрені, підтверджується даними біологічних, емпіричних і клінічних досліджень [18, 40]. Сучасні дані рекомендують використання ТМС при мігрені шляхом стимуляції або моторної кори (M1), або дорсолатеральної префронтальної кори (DLPFC) [40]. Генерація коротких магнітних імпульсів спеціальним магнітним індуктором у зоні церебральної кори дозволяє безболісно індукувати кортикальні нейрони. Цей вплив призводить до нейрональної деполяризації і може впливати на кортикальну збудливість нейронів, хоча механізми ще недостатньо вивчені [6].
На сьогодні ТМС рекомендується як додаткова профілактична терапія мігрені [14, 42]. За результатами метааналізу L. Lan, X. Zhang (2017), неінвазивне лікування мігрені методом ТМС є ефективним у терапії епізодичної мігрені, купіруванні нападів мігрені з аурою, але не поліпшує значуще перебіг хронічної мігрені [14, 36, 42, 52].
Блокада великого потиличного нерва за допомогою глюкокортикоїдів і місцевих анестетиків може рекомендуватися як додатковий метод профілактичної терапії мігрені в поєднанні з фармакотерапією та іншими немедикаментозними методами [8, 15].
Зовнішня стимуляція першої гілки трійчастого нерва (надочного нерва) — неінвазивний метод лікування мігрені, який проводиться за допомогою апарату Цефалі. Метод використовується як для купірування нападів мігрені, так і для їх профілактики [12, 47].
Електрична стимуляція потиличних нервів (ней-ростимуляція) — інвазивний метод, який може бути рекомендований пацієнтам з рефрактерною хронічною мігренню [10, 59]. Відповідно до міжнародної домовленості між експертами, рефрактерною мігрень визнається в тому випадку, якщо пацієнт виключив тригерні фактори, модифікував спосіб життя, не зловживає знеболюючими препаратами, отримував як мінімум два курси стандартної профілактичної фармакотерапії в адекватних дозах не менше 3 місяців, але значущого зниження частоти ГБ і поліпшення якості життя так і не досяг [48].
Постізометрична релаксація застосовується в пацієнтів з мігренню і поєднаним вираженим перикраніальним м’язово-тонічним синдромом [19, 24]. Метод спрямований на розслаблення перикраніальних м’язів, вправи включають два етапи — скорочення і розслаблення напружених м’язів.
Голкорефлексотерапія рекомендується як профілактичне лікування мігрені, є ефективною при її епізодичній і хронічній формі [20, 60].
Лікувальна гімнастика може бути рекомендована для запобігання нападам мігрені [35, 39]. Інтенсивність вправ повинна бути невисокою, частота занять — 3–4 рази на тиждень тривалістю від 20 до 60 хвилин.
Таким чином, протягом останнього десятиліття з’явилося нове розуміння патогенезу мігрені, розроблені ефективні фармакотерапевтичні і немедикаментозні методи лікування нападів мігрені і профілактики її трансформації у хронічну форму. Проте, незважаючи на успіх у лікуванні мігрені, деякі питання патофізіології мігрені та її окремих проявів досі залишаються не до кінця зрозумілими, і тому триває пошук більш ефективних і безпечних методів терапії. Наведені результати аналізу літератури можуть бути корисними лікарям, які надають медичну допомогу пацієнтам з мігренню.
Конфлікт інтересів. Не заявлений.
Отримано/Received 11.08.2021
Рецензовано/Revised 25.08.2021
Прийнято до друку/Accepted 02.09.2021
Список литературы
1. Азимова Ю.Э., Табеева Г.Р. Топирамат в лечении хронической мигрени. Журнал неврологии и психиатрии. 2012. № 12. С. 31-35.
2. Осипова В.В., Филатова Е.Г., Артеменко А.Р. Дагностика и лечение мигрени: рекомендации российских экспертов. Журнал неврологии и психиатрии. 2018. Т. 48. № 5. С. 621-635.
3. Калашников В.И., Абдуллаев Р.Я., Костюковская А.Е. Роль дуплексного сканирования магистральных артерий головы и магнитно-резонансной томографии в диагностике структурно-гемодинамических нарушений при мигрени. Український радіологічний журнал. 2015. Т. 23. № 1. С. 18-22.
4. Кривчун А.М. Топірамат в превентивному лікуванні мігрені. Вісник проблем біології і медицини. 2018. Вип. 4(2). С. 148-151. Режим доступу: http://nbuv.gov.ua/UJRN/Vpbm_2018_4(2)_34.
5. Филатова Е.Г. Профилактическая терапия мигрени: от клинических рекомендаций к клинической практике. Консилиум. Неврология. 2018. № 1 (161). С. 26-29.
6. Шевченко В., Артеменко А., Куренков А. Клинические и нейрофизиологические эффекты топирамата при хронической мигрени. Врач. 2018. № 29(11). С. 66-69. https://doi.org/10.29296/25877305- 2018-11-14
7. Agostoni E.C., Barbanti P., Calabresi P., et al. Italian chronic migraine group. Current and emerging evidence-based treatment options in chronic migraine: a narrative review. J. Headache Pain. 2019 Aug 30. № 20(1). Р. 92. doi: 10.1186/s10194-019-1038-4. PMID: 31470791. PMCID: PMC6734211.
8. Allen S.M., Mookadam F., Cha S.S. et al. Greater occipital nerve block for acute treatment of migraine headache: a large retrospective cohort study. J. Am. Board Fam. Med. 2018. № 1(2). Р. 211-8. doi: 10.3122/jabfm.2018.02.170188
9. Ambrosini A., Magis D., Schoenen J. Migraine-clinical neurophysiology. Handb. Clin. Neurol. 2010. № 97. Р. 275-93. doi: 10.1016/S0072-9752(10)97023-1. PMID: 20816429.
10. Cadalso R.T. Jr., Daugherty J., Holmes C. et al. Efficacy of electrical stimulation of the occipital nerve in intractable primary headache disorders: a systematic review with meta-analyses. J. Oral. Facial. Pain Headache. 2018. № 32(1). Р. 40-52. doi: 10.11607/ofph.1784.
11. Cameron C., Kelly S., Hsieh S.C., et al. Triptans in the acute treatment of migraine: a systematic review and network meta-analysis. Headache. 2015. № 55(suppl. 4). Р. 221-35. doi: 10.1111/head.12601.
12. Chou D., Yugrakh M., Winegarne D. et al. Acute-migraine-therapy-with-external-trigeminal-neurostimulation-ACME-A-randomized-controlled-trial. Cephalalgia. 2019. № 39(1). Р. 3-14. doi: 10.1177/0333102418811573.
13. Chronicle E.P., Mulleners W.M. Anticonvulsant drugs for migraine prophylaxis. Cochrane Database Syst. Rev. 2016. № 5. CD003226. doi: 10.1002/14651858.CD003226.pub3.
14. Conforto A.B., Amaro E.Jr., Goncalves A.L. et al. Rando-mized, proof-of-principle clinical trial of active transcranial magnetic stimulation in chronic migraine. Cephalalgia. 2014. № 34(6). Р. 464-72. doi: 10.1177/0333102413515340.
15. Cuadrado M.L., Aledo-Serrano A., Navarro P. et al. Short-term effects of greater occipital nerve blocks in chronic migraine: a double-blind, randomised, placebo-controlled clinical trial. Cephalalgia. 2017. № 37. Р. 864-72. doi: 10.1177/0333102416655159.
16. Dekker F., Neven A.K., Andriesse B. et al. Prophylactic treatment of migraine by GPs: a qualitative study. Br. J. Gen. Pract. 2012. № 62(597). Р. 268-74. doi: 10.3399/bjgp12X636100.
17. Derry S., Moore R.A. Paracetamol (acetaminophen) with or without an antiemetic for acute migraine headaches in adults. Cochrane Database Syst. Rev. 2013. № 4. CD008040. doi: 10.1002/14651858.CD008040.pub3.
18. Dodick D.W., Schembri C.T., Helmuth M., Aurora S.K. Transcranial magnetic stimulation for migraine: a safety review. Headache. 2010 Jul. № 50(7). Р. 1153-63. doi: 10.1111/j.1526-4610.2010.01697.x. Epub 2010 Jun 10. PMID: 20553334.
19. Falsiroli Maistrello L., Geri T., Gianola S. et al. Effectiveness of trigger point manual treatment on the frequency, intensity, and duration of attacks in primary headaches: a systematic review and meta-analysis of randomized controlled trials. Front. Neurol. 2018. № 9. Р. 254. doi: 10.3389/fneur.2018.00254.
20. Feng-Jiao Shen, Jia Xu, Yi-Jun Zhan et al. Acupuncture for migraine: A systematic review and meta-analysis. World J. Acupunct. Moxibustion. 2019. № 29(1). Р. 7-14. doi: 10.1016/j.wjam.2019.03.004.
21. Gerwig M., Niehaus L., Kastrup O. et al. Beta-blocker migraine prophylaxis affects the excitability of the visual cortex as revealed by transcranial magnetic stimulation. J. Headache Pain. 2012. № 13(1). Р. 83-9. doi: 10.1007/s10194-011-0401-x.
22. Golovacheva V.A., Parfenov V.A. Triptany v lechenii migreni. Meditsinskiy sovet. 2015. № 10. Р. 26-32. [in Russian]
23. Gormley P., Anttila V., Winsvold B.S. et al. Meta-analysis of 375,000 individuals identifies 38 susceptibility loci for migraine. Nat. Genet. 2016. № 48. Р. 856-66.
24. Ha H., Gonzalez A. Migraine Headache Prophylaxis. Am. Fam. Physician. 2019 Jan 1. № 99(1). Р. 17-24. PMID: 30600979.
25. Hansen J.M., Hauge A.W., Olesen J., Ashina M. Calcitonin gene-related peptide triggers migraine-like attacks in patients with migraine with aura. Cephalalgia. 2010. № 30. Р. 1179-86.
26. Harris P., Loveman E., Clegg A. et al. Systematic review of cognitive behavioural therapy for the management of headaches and migraines in adults. Br. J. Pain. 2015. № 9(4). Р. 213-24. doi: 10.1177/2049463715578291.
27. He A., Song D., Zhang L., Li C. Unveiling the relative efficacy, safety and tolerability of prophylactic medications for migraine: pairwise and network-meta analysis. J. Headache Pain. 2017. № 18(1). Р. 26. doi: 10.1186/s10194-017-0720-7.
28. Headache Classification Committee of the International Headache Society (IHS) The International Classification of Hea-dache Disorders, 3rd ed. Cephalalgia. 2018 Jan. № 38(1). Р. 1-211. doi: 10.1177/0333102417738202. PMID: 29368949.
29. Herd C.P., Tomlinson C.L., Rick C. et al. Botulinum toxins for the prevention of migraine in adults. Cochrane Database Syst. Rev. 2018. № 6. CD011616. doi: 10.1002/14651858.CD011616.pub2.
30. Hougaard A., Amin F.M., Hauge A.W., Ashina M., Olesen J. Provocation of migraine with aura using natural trigger factors. Neurology. 2013. № 80. Р. 428-31.
31. Jackson J.L., Cogbill E., Santana-Davila R. et al. Comparative effectiveness meta-analysis of drugs for the pophylaxis of migraine headache. PLoS One. 2015. № 10(7). Р. e0130733. doi: 10.1371/journal.pone.0130733.
32. Kelman L. The triggers or precipitants of the acute migraine attack. Cephalalgia. 2007. № 27. Р. 394-402.
33. Khalil N.Y., AlRabiah H.K., Al Rashoud S.S., Bari A., Wani T.A. Topiramate: Comprehensive profile. Profiles Drug Subst Excip Relat Methodol. 2019. № 44. Р. 333-378. doi: 10.1016/bs.podrm.2018.11.005. Epub 2019 Jan 14. PMID: 31029222.
34. Kirthi V., Derry S., Moore R. Aspirin with or without an antiemetic for acute migraine headaches in adults. Cochrane Database Syst. Rev. 2013. № 4. CD008041. doi: 10.1002/14651858.CD008041.pub3.
35. Kroll L.S., Hammarlund C.S., Linde M. et al. The effects of aerobic exercise for persons with migraine and co-existing tension-type headache and neck pain. A randomized, controlled, clinical trial. Cephalalgia. 2018. № 38(12). Р. 1805-16. doi: 10.1177/0333102417752119.
36. Lan L., Zhang X., Li X., Rong X., Peng Y. The efficacy of transcranial magnetic stimulation on migraine: a meta-analysis of randomized controlled trails. J. Headache Pain. 2017 Aug 22. № 18(1). Р. 86. doi: 10.1186/s10194-017-0792-4. PMID: 28831756; PMCID: PMC5567575.
37. Law S., Derry S., Moore R.A. Naproxen with or without an antiemetic for acute migraine headaches in adults. Cochrane Database Syst. Rev. 2013. № 10. CD009455. doi: 10.1002/14651858.CD009455.pub2.
38. Lee H.J., Lee J.H., Cho E.Y. et al. Efficacy of psychological treatment for headache disorder: a systematic review and meta-ana-lysis. J. Headache Pain. 2019. № 20(1). Р. 17. doi: 10.1186/s10194-019-0965-4.
39. Lemmens J., de Pauw J., van Soom T. et al. The effect of aerobic exercise on the number of migraine days, duration and pain intensity in migraine: a systematic literature review and meta-analysis. J. Headache Pain. 2019. № 20(1). Р. 16. doi: 10.1186/s10194-019-0961-8.
40. Leung A., Shirvalkar P., Chen R. et al. Transcranial Magnetic Stimulation for Pain, Headache, and Comorbid Depression: INS-NANS Expert Consensus Panel Review and Recommendation. Neuromodulation. 2020 Apr. № 23(3). Р. 267-290. doi: 10.1111/ner.13094. Epub 2020 Mar 25. PMID: 32212288.
41. Linde M., Mulleners W.M., Chronicle E.P., McCrory D.C. Valproate (valproic acid or sodium valproate or a combination of the two) for the prophylaxis of episodic migraine in adults. Cochrane Database Syst. Rev. 2013. № 6. CD010611. doi: 10.1002/14651858.CD010611.
42. Misra U.K., Kalita J., Bhoi S.K. High-rate repetitive trans-cranial magnetic stimulation in migraine prophylaxis: a randomized, placebo-controlled study. J. Neurol. 2013. № 260(11). Р. 2793-801. doi: 10.1007/s00415-013-7072-2.
43. Nestoriuc Y., Martin A., Rief W., Andrasik F. Biofeedback treatment for headache disorders: a comprehensive eficacy review. Appl. Psychophysiol. Biofeedback. 2008. № 33. Р. 125-40. doi: 10.1007/s10484-008-9060-3.
44. Orr S.L., Aube M., Becker W.J. et al. Canadian Headache Society systematic review and recommendations on the treatment of migraine pain in emergency settings. Cephalalgia. 2015. № 35. Р. 271. doi: 10.1177/0333102414535997.
45. Rabbie R., Derry S., Moore R.A. Ibuprofen with or without an antiemetic for acute migraine headaches in adults. Cochrane Database Syst. Rev. 2013. № 4. CD008039. doi: 10.1002/14651858.CD008039.pub3.
46. Ruiz L., Ferrandi D. Topiramate in migraine progression. J. Headache Pain. 2009 Dec. № 10(6). Р. 419-22. doi: 10.1007/s10194-009-0164-9. Epub 2009 Oct 17. PMID: 19838625. PMCID: PMC3476219.
47. Schoenen J., Vandersmissen B., Jeangette S. et al. Migraine prevention with a supraorbital transcutaneous stimulator. A randomized controlled trial. Neurology. 2013. № 80. Р. 697-704. doi: 10.1212/WNL.0b013e3182825055.
48. Schulman E.A., Lake A.E. 3rd, Goadsby P.J. et al. Defining refractory migraine and refractory chronic migraine: proposed criteria from the Refractory Headache Special Interest Sectionof the American Headache Society. Headache. 2008. № 48(6). Р. 778-82. doi: 10.1111/j.1526-4610.2008.01132.x.
49. Silberstein S.D. Topiramate in Migraine Prevention: A 2016 Perspective. Headache. 2017 Jan. № 57(1). Р. 165-178. doi: 10.1111/head.12997. Epub 2016 Nov 30. PMID: 27902848.
50. Steiner T.J., Jensen R., Katsarava Z. et al. Aids to management of headache disorders in primary care (2nd edition): on behalf of the European Headache Federation and Lifting the Burden: the Global Campaign against Headache. J. Headache Pain. 2019. № 20. Р. 57.
51. Stewart W.F., Lipton R.B., Kolodner K.B., Sawyer J., Lee C., Liberman J.N. Validity of the migraine disability assessment (MIDAS) score in comparisonto a diary-based measure in a population sample of migraine sufferers. Pain. 2000. № 88(1). Р. 41-52. https://doi.org/10.1016/S0304-3959(00)00305-5
52. Stilling J.M., Monchi O., Amoozegar F., Debert C.T. Transcranial Magnetic and Direct Current Stimulation (TMS/tDCS) for the Treatment of Headache: A Systematic Review. Headache. 2019 Mar. № 59(3). Р. 339-357. doi: 10.1111/head.13479. Epub 2019 Jan 23. PMID: 30671941.
53. Stovner L.J., Linde M., Gravdahl G.B. et al. A comparative study of candesartan versus propranolol for migraine prophylaxis: A randomised, triple-blind, placebo-controlled, double crossover study. Cephalalgia. 2014. № 34(7). Р. 523-32. doi: 10.1177/033310241351534.
54. Sutherland H.G., Griffiths L. R. Genetics of Migraine: Insights into the Molecular Basis of Migraine Disorders. Headache. 2017. Vol. 57. № 4. P. 537-569.
55. Suthisisang C.C., Poolsup N., Suksomboon N. et al. Meta-analysis of the efficacy and safety of naproxen sodium in the acute treatment of migraine. Headache. 2010. № 50(5). Р. 808-18. doi: 10.1111/j.1526-4610.2010.01635.x.
56. Tepper S., Ashina M., Reuter U. et al. Safety and efficacy of erenumab forpreventive treatment of chronic migraine: a randomised, double-blind, placebo-controlled phase 2 trial. Lancet Neurol. 2017. № 16. Р. 425-34. doi: 10.1016/S1474-4422(17)30083-2.
57. Williams L.S., Jones W.J., Shen J. Prevalence and impact of depression and pain in neurology outpatients. J. Neurol. Neurosurg. Psychiatry. 2003. Vol. 74. P. 1587-1589.
58. Xu X.M., Yang C., Liu Y. et al. Efficacy and feasibility of antidepressants for the prevention of migraine in adults: a meta-analysis. Eur. J. Neurol. 2017. № 24(8). Р. 1022-31. doi: 10.1111/ene.13320.
59. Yang Y., Song M., Fan Y., Ma K. Occipital nerve stimulation for migraine: a systematic review. Pain Pract. 2016. № 16(4). Р. 509-17. doi: 10.1111/papr.12303.
60. Yin Jiang, Peng Bai, Hao Chen et al. The effect of acupuncture on the quality of life in patients with migraine: a systematic review and meta-analysis. Front Pharmacol. 2018. № 9. Р. 1190. doi: 10.3389/fphar.2018.01190.
61. Young W., Shaw J., Bloom M. et al. Correlation of increase in phosphene threshold with reduction of migraine frequency: observation of levetiracetam-treated subjects. Headache. 2008. № 48. Р. 1490-8. doi: 10.1111/j.1526-4610.2008.01292.x.
UA-TOPI-PUB-092021-010

/75.jpg)