Международный эндокринологический журнал Том 17, №4, 2021
Вернуться к номеру
Остеокальцин: взаємозв’язок між кістковим метаболізмом та гомеостазом глюкози при цукровому діабеті
Авторы: Ковальчук А.В., Зінич О.В., Корпачев В.В., Кушнарьова Н.М., Прибила О.В., Шишкань-Шишова К.О.
ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», м. Київ, Україна
Рубрики: Эндокринология
Разделы: Справочник специалиста
Версия для печати
Дослідження останнього часу продемонстрували значення кістки як ендокринного органа, що продукує біологічно активні речовини, які регулюють як місцевий кістковий метаболізм, так і метаболічні функції у всьому організмі. Під час кісткового ремоделювання (формування/руйнування) активні клітини виділяють специфічні біомаркери, які допомагають виявляти остеометаболічну дисфункцію. Серед гормонів кісткової тканини важлива роль належить остеокальцину як координатору процесів кісткового моделювання, енергетичного гомеостазу, метаболізму глюкози, ліпідів та мінеральних речовин. Остеокальцин — структурний білок кісткового матриксу, що синтезується остеобластами і надходить до кровотоку під час резорбції кісткової тканини. Рівень остеокальцину в сироватці крові використовується як специфічний маркер формування кісткової тканини. Остеокальцин сприяє проліферації β-клітин підшлункової залози та секреції інсуліну, а також впливає на інсуліночутливість периферичних тканин. Виявлено обернену асоціацію глікемії з рівнем остеокальцину. У хворих на цукровий діабет 2-го типу (ЦД2) зазвичай спостерігається нормальна або навіть трохи підвищена мінеральна щільність кісткової тканини порівняно з контролем відповідного віку. Зниження якості кісток та підвищений ризик переломів пов’язують зі змінами кісткової мікроархітектури та місцевого гуморального середовища. Дисбаланс активності остеобластів/остеокластів може бути зумовлений окиснювальним стресом та накопиченням кінцевих продуктів глікозилювання, що сприяє хронічному запаленню та резорбції кісток у пацієнтів із діабетом. Показано, що рівень остеокальцину в сироватці крові значно знижується порівняно зі здоровим контролем як у хворих на ЦД1, так і, особливо сильно, при ЦД2. З урахуванням важливості розробки нових підходів до діагностики та корекції метаболічних порушень у хворих на ЦД вивчення впливу кісткових гормонів на гормонально-метаболічні показники та стан кісткової тканини, включаючи ризик переломів, зберігає актуальність у сучасній діабетології.
Recent studies have demonstrated the importance of bone as an endocrine organ that produces biologically active substances, which regulate both local bone metabolism and metabolic functions throughout the body. In the process of bone remodeling (formation/destruction), the active cells secrete specific biomarkers that help detect osteometabolic dysfunction. Among bone hormones, osteocalcin plays an important role as a coordinator of bone modeling processes, energy homeostasis, metabolism of glucose, lipids and minerals. Osteocalcin is a structural protein of the bone matrix, which is synthesized by osteoblasts and enters the bloodstream in the process of bone resorption. The level of osteocalcin in the serum is used as a specific marker of bone formation. Osteocalcin promotes pancreatic β-cell proliferation and insulin secretion, and also affects the insulin sensitivity of peripheral tissues. The inverse association of glycemia with the level of osteocalcin was revealed. Patients with type 2 diabetes mellitus usually have normal or even slightly elevated bone mineral density compared to age-appropriate controls. Decreased bone quality and increased risk of fractures are associated with changes in bone microarchitecture and local humoral environment. An imbalance in osteoblast/osteoclast activity may be due to oxidative stress and the accumulation of glycosylation end products, which contributes to chronic inflammation and bone resorbtion in patients with diabetes. It is shown that the level of osteocalcin in the blood serum is significantly reduced compared to healthy controls, both in patients with type 1 diabetes mellitus and, especially, in type 2 diabetes mellitus. Given the importance of developing new approaches to the diagnosis and correction of metabolic disorders in diabetic patients, the study of the influence of bone hormones on hormonal and metabolic parameters and bone status, including the risk of fractures, remains relevant in modern diabetology.
остеокальцин; біомаркери кісткового ремоделювання; секреція інсуліну; цукровий діабет; метаболічні порушення; ризик переломів; огляд
osteocalcin; bone remodeling biomarkers; insulin secretion; diabetes mellitus; metabolic disorders; fracture risk; review
1. Маркери кісткового метаболізму
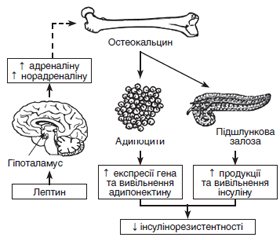
Механізми впливу остеокальцину на ефекти інсуліну, гомеостаз глюкози та кістковий метаболізм
/73.jpg)
2. Патофізіологія кісткових змін та ризик переломів при ЦД 2-го типу
/74.jpg)
- Lecka-Czernik B. Diabetes, bone and glucose-lowering agents: basic biology. Diabetologia. 2017. 60. 1163-1169. DOI: 10.1007/s00125-017-4283-6.
- Zhou R., Guo Q., Xiao Y. et al. Endocrine role of bone in the regulation of energy metabolism. Bone Res. 2021. 9. Article No 25. https://doi.org/10.1038/s41413-021-00142-4.
- Kajimura D., Lee H.W., Riley K.J. et al. Adiponectin regulates bone mass via opposite central and peripheral mechanisms through FoxO1. Cell. Metab. 2013. 17. 901-915. doi: 10.1016/j.cmet.2013.04.009.
- Abarrategi A., Mian S., Passaro D., Rouault-Pierre K., Grey W., Bonnet D. Modeling the human bone marrow niche in mice: from host bone marrow engraftment to bioengineering approaches. J. Exp. Med. 2018. 215. 729-43. doi: 10.1084/jem.20172139.
- Аndrukhova O., Streicher C., Zeitz U., Erben R. Fgf23 and parathyroid hormone signaling interact in kidney and bone. Mol. Cell. Endocrinol. 2016. 436. 224-239. DOI: 10.1016/j.mce.2016.07.035.
- Cai X., Xing J., Long C., Peng Q., Humphrey M. DOK3 modulates bone remodeling by negatively regulating osteoclastogenesis and positively regulating osteoblastogenesis. J. Bone Min. Res. 2017. 32. 2207-2218. doi: 10.1002/jbmr.3205.
- Matsuoka K., Park K., Ito M., Ikeda K., Takeshita S. Osteoclast-derived complement component 3a stimulates osteoblast differentiation. J. Bone Min. Res. 2014. 29. 1522-1530. doi: 10.1002/jbmr.2187.
- Napoli N., Chandran M., Pierroz D.D., Pierroz D., Abrahamsen B., Schwartz A., Ferrari S. IOF Bone and Diabetes Working Group. Mechanisms of diabetes mellitus-induced bone fragility. Nat. Rev. Endocrinol. 2017. 13. 208-219. doi: 10.1038/nrendo.2016.153.
- Wheater G., Elshahaly M., Tuck S.P., Datta H.K., van Laar J.M. The clinical utility of bone marker measurements in osteoporosis. J. Transl. Med. 2013 Aug. 11. 201. doi: 10.1186/1479-5876-11-201.
- Vasikaran S., Eastell R., Bruyère O. et al. Markers of bone turnover for the prediction of fracture risk and monitoring of osteoporosis treatment: a need for international reference standards. Osteoporos Int. 2011. 22(2). 391-420. doi: 10.1007/s00198-010-1501-1.
- Wei J., Karsenty G. An overview of the metabolic functions of osteocalcin. Rev. Endocr. Metab. Disord. 2015. 16. 93-98. doi: 10.1007/s11154-014-9307-7.
- Gupte A., Sabek O., Fraga D., Minze L., Nishimoto S. et al. Osteocalcin protects against nonalcoholic steatohepatitis in a mouse model of metabolic syndrome. Endocrinology. 2014. 155. 4697-4705. doi: 10.1210/en.2014-1430.
- Milovanovic P., Zimmermann E., Hahn M., Djonic D., Püschel K., Djuric M., Amling M., Busse B. Osteocytic canalicular networks: morphological implications for altered mechanosensitivity. ACS Nano. 2013. 7. 7542-7551. doi: 10.1021/nn401360u.
- Sullivan T.R., Duque G., Keech A.C., Herrmann M. An Old Friend in a New Light: The Role of Osteocalcin in Energy Metabolism. Cardiovasc. Ther. 2013. 31. 65-75. doi: 10.1111/j.1755-5922.2011.00300.x.
- Saleem U., Mosley T., Kullo I. Serum osteocalcin is associated with measures of insulin resistance, adipokine levels, and the presence of metabolic syndrome. Arterioscler. Thromb. Vasc. Biol. 2010 Jul. 30(7). 1474-1478. doi: 10.1161/ATVBAHA.110.204859.
- Zanatta L.C., Boguszewski C.L., Borba V.Z., Kulak C.A. Osteocalcin, energy and glucose metabolism. Arq. Bras. Endocrinol. Metabol. 2014. 58(5). 444-451. Doi: 10.1590/0004-2730000003333.
- Wei J., Ferron M., Clarke C.J., Hannun Y., Jiang H., Blaner W., Karsenty G. Bone-specific insulin resistance disrupts whole-body glucose homeostasis via decreased osteocalcin activation. J. Clin. Invest. 2014. 124. 1-13. doi: 10.1172/JCI72323.
- Fernandes T., Goncalves L., Brito J. Relationships between bone turnover and energy metabolism. J. Diabetes Res. 2017. 2017. 9021314. doi: 10.1155/2017/9021314.
- Yeap B.B., Alfonso H., Chubb S.A. et al. Higher serum undercarboxylated osteocalcin and other bone turnover markers are associated with reduced diabetes risk and lower estradiol concentrations in older men. J. Clin. Endocrinol. Metab. 2015. 100. 63-71. Doi: 10.1210/jc.2014-3019.
- Gonzalez-Garcia Z.M., Kullo I.J., Coletta D.K., Mandarino L.J., Shaibi G.Q. Osteocalcin and type 2 diabetes risk in Latinos: a life course approach. Am. J. Hum. Biol. 2015. 27. 859-861. doi: 10.1002/ajhb.22745.
- Kunutsor S.K., Apekey T.A., Laukkanen J.A. Association of serum total osteocalcin with type 2 diabetes and intermediate metabolic phenotypes: systematic review and meta-analysis of observational evidence. Eur. J. Epidemiol. 2015. 30. 599-614. doi: 10.1007/s10654-015-0058-x.
- Confavreux C.B., Szulc P., Casey R., Varennes A., Goudable J., Chapurlat R.D. Lower serum osteocalcin is associated with more severe metabolic syndrome in elderly men from the MINOS cohort. Eur. J. Endocrinol. 2014. 171. 275-283. doi: 10.1530/EJE-13-0567.
- Romero-Díaz C., Duarte-Montero D., Mendivil C. Diabetes and Bone Fragility. Diabetes Therapy. 2021. 12. 71-86. doi: 10.1007/s13300-020-00964-1.
- Uchida T., Nakamura T., Hashimoto N. et al. Deletion of Cdkn1b ameliorates hyperglycemia by maintaining compensatory hyperinsulinemia in diabetic mice. Nat. Med. 2005. 11. 175-182. doi.org/10.1038/nm1187.
- Takahashi A., Mulati M., Saito M. et al. Loss of cyclin-dependent kinase 1 impairs bone formation, but does not affect the bone-anabolic effects of parathyroid hormone. J. Biol. Chem. 2018 Dec. 293(50). 19387-19399. doi: 10.1074/jbc.RA118.004834.
- Ru J., Wang Y. Osteocyte apoptosis: the roles and key molecular mechanisms in resorption-related bone diseases. Cell. Death Dis. 2020. 11. 846. Doi: 10.1038/s41419-020-03059-8.
- Bao Y.Q., Zhou M., Zhou Jian et al. Relationship between serum osteocalcin and glycaemic variability in Type 2 diabetes. Clin. Exp. Pharmacol. Physiol. 2011. 38(1). 50-54. doi: 10.1111/j.1440-1681.2010.
- Ehnert S., Rinderknecht H., Aspera-Werz R., Häussling V., Nussler A.K. Use of in vitro bone models to screen for altered bone metabolism, osteopathies, and fracture healing: challenges of complex models Arch. Toxicol. 2020. 94(12). 3937-3958. doi: 10.1007/s00204-020-02906-z.
- Ma C., Tonks K., Center J., Samocha‐Bonet D., Greenfield J. Complex interplay among adiposity, insulin resistance and bone health. Clin. Obese. 2018. 4. 131-139. DOI: 10.1111/cob.12240.
- Napoli N., Strotmeyer E.S., Ensrud K.E. et al. Fracture risk in diabetic elderly men: the MrOS study. Diabetologia. 2014 Oct. 57(10). 2057-2065. doi: 10.1007/s00125-014-3289-6.
- Viljakainen H., Ivaska K.K., Paldanius P. et al. Suppressed bone turnover in obesity: a link to energy metabolism? A case — control study. J. Clin. Endocrinol. Metab. 2014. 99. 2155-2163. doi: 10.1210/jc.2013-3097.
- Tonks K.T., White C.P., Center J.R., Samocha-Bonet D., Greenfield J.R. Bone turnover is suppressed in insulin resistance, independent of adiposity. J. Clin. Endocrinol. Metab. 2017. 102. 1112-1121. doi: 10.1210/jc.2016-3282.
- Montagnani A. Antidiabetic therapy effects on bone metabolism and fracture risk Diabetes. Obes. Metab. 2013. 15(9). 784-791. doi: 10.1111/dom.12077.
- Poundarik A., Wu P., Evis Z., Sroga G., Ural A., Rubin M., Vashishth D. A direct role of collagen glycation in bone fracture. J. Mech. Behav. Biomed. Mater. 2015. 52. 120-130. doi: 10.1016/j.jmbbm.2015.08.012.
- McCarthy A., Etcheverry S., Bruzzone L., Lettieri G., Barrio D., Cortizo A. Non-enzymatic glycosylation of a type I collagen matrix: effects on osteoblastic development and oxidative stress. BMC Cell. Biol. 2001. 2. 16. doi: 10.1186/1471-2121-2-16.
- Hein G.E. Glycation endproducts in osteoporosis — is there a pathophysiologic importance? Clin. Chim. Acta. 2006. 371. 32-36. doi: 10.1016/j.cca.2006.03.017.
- Gilbert L., He X., Farmer P., Boden S., Kozlowski M., Rubin J., Nanes M. Inhibition of osteoblast differentiation by tumor necrosis factor-α. Endocrinology. 2000. 141. 3956-3964. Doi: 10.1210/endo.141.11.7739.
- Horcajada-Molteni M.N., Chanteranne B., Lebecque P., Davicco M., Coxam V., Young A., Barlet J.P. Amylin and bone metabolism in streptozotocin-induced diabetic rats. J Bone Miner. Res. 2001. 16. 958-965. doi: 10.1359/jbmr.2001.16.5.958.
- Siris E.S., Adler R., Bilezikian J. et al. The clinical diagnosis of osteoporosis: a position statement from the National Bone Health Alliance Working Group. Osteoporos. Int. 2014. 25. 1439-1443. doi: 10.1007/s00198-014-2655-z.
- Burghardt A.J., Issever A.S., Schwartz A.V. et al. High-resolution peripheral quantitative computed tomographic imaging of cortical and trabecular bone microarchitecture in patients with type 2 diabetes mellitus. J. Clin. Endocrinol. Metab. 2010. 95. 5045-5055. doi: 10.1210/jc.2010-0226.
- Patsch J.M., Burghardt A.J., Yap S.P., Baum T., Schwartz A., Joseph G., Link T.M. Increased cortical porosity in type 2 diabetic postmenopausal women with fragility fractures. J. Bone Miner. Res. 2013. 28. 313-324. doi: 10.1002/jbmr.1763.
- Ishii S., Cauley J.A., Crandall C.J., Srikanthan P. et al. Diabetes and femoral neck strength: findings from the hip strength across the menopausal transition study. J. Clin. Endocr. Metab. 2012. 97. 190-197. doi: 10.1210/jc.2011-1883.
- Urano T., Shiraki M., Kuroda T. et al. Low serum osteocalcin concentration is associated with incident type 2 diabetes mellitus in Japanese women. J. Bone Miner. Metab. 2018. 36. 470-477. doi: 10.1007/s00774-017-0857-0.
- Takashi Y., Ishizu M., Mori H., Tanaka S., Urano F., Uenishi K., Inoue S. Circulating osteocalcin as a bone-derived hormone is inversely correlated with body fat in patients with type 1 diabetes. PLoS ONE. 2019. 14. e0216416. doi: 10.1371/journal.pone.0216416.

/72.jpg)
/73_2.jpg)