Вступ з елементами історичного огляду
Хвороба Паркінсона (ХП) — хронічне нейродегенеративне захворювання, що характеризується прогресуючою втратою дофамінергічних нейронів у pars compacta чорної субстанції. Основними симптомами ХП є: акінезія, ригідність, тремор і постуральна нестабільність, крім яких присутні й немоторні симптоми. Замісна дофамінова терапія леводопою і агоністами дофамінових рецепторів є золотим стандартом лікування, що забезпечує достатній контроль симптомів на ранніх стадіях захворювання. Незважаючи на це, приблизно через 5 років лікування спостерігається прогресуюче виснаження експресії дофаміну, викликане дегенерацією дофамінергічних нейронів, що клінічно проявляється моторними флуктуаціями і леводопа-індукованими дискінезіями, які зустрічаються майже в 50 % випадків і значно погіршують якість життя пацієнтів [1]. Моторні флуктуації виникають у результаті втрати і зниження біодоступності разової дози леводопи, це відоме явище wearing-off. Пізніше може виникати феномен «включення/виключення» або періоди раптових, непередбачуваних «виключень» [2]. Немоторні ускладнення, такі як тривога, вегетативні розлади, втома, зміни настрою, біль або сенсорні симптоми, являють собою синдромокомплекс, що часто супроводжує моторні порушення [3]. Патофізіологічною основою клінічних проявів вважають індуковану дофамінергічними препаратами пульсуючу стимуляцію дофамінових рецепторів, що виникає внаслідок виснаження запасів власного дофаміну [5, 6]. Так, пульсуючий ефект перорального прийому леводопи обумовлений коротким періодом її напіврозпаду [4] і непередбачуваним процесом всмоктування з тонкого кишечника через недостатнє спорожнення шлунка [7, 8]. Згодом були розроблені препарати леводопи з уповільненим вивільненням та інгібітори метаболізму леводопи, а також агоністи дофамінових рецепторів, що забезпечують більш стабільний рівень концентрації леводопи в плазмі. Було встановлено, що перевагами агоністів дофамінових рецепторів є більш тривалий період напіврозпаду і їх селективність відносно D2 рецепторів дофаміну, які, як вважають, також сприяють зменшенню ризику появи дискінезій [9]. Інша загальноприйнята стратегія збільшення тривалості дії леводопи заснована на використанні інгібіторів катехол-O-метилтрансферази (ентакапон і толкапон) та інгібіторів моноамінооксидази (МАО-В).
Перші спроби застосування парентерального препарату з ефектом постійної дофамінергічної стимуляції були зроблені на початку 1980-х років.
Була розроблена методика внутрішньовенного введення леводопи або підшкірного введення агоніста дофаміну лізуриду. Однак внутрішньовенне введення леводопи, незважаючи на свою ефективність, було практично нездійсненним через слабку розчинність, а лізурид був відкликаний виробником під час уже розпочатої реєстрації в FDA у зв’язку тим, що виникли серйозні сумніви в його клінічній ефективності й безпеці [10, 11].
Після багаторічних робіт у цьому напрямку підшкірна форма агоніста дофамінових рецепторів апоморфіну і леводопа/карбідопа інтестинальний гель (LCIG) стали широко використовуватися для інфузійної терапії при ХП з метою отримання клінічного ефекту постійної дофамінергічної стимуляції.
Необхідно підкреслити, що апоморфін, як натуральний продукт, використовувався й раніше як блювотний, седативний, протисудомний, антипсихотичний засіб, а також при алкогольній залежності й сексуальній дисфункції [12]. Апоморфін уперше був запропонований як засіб для лікування хвороби Паркінсона Weil у 1844 році, але про його властивості при лікуванні паркінсонічних розладів не повідомлялося до опублікування роботи Schwab et al. у 1951 році.
Ефект був обґрунтований ще в 1967 році, було підтверджено здатність апоморфіну зменшувати ригідність в експериментальних тварин за рахунок структурної схожості препарату з дофаміном [12–14].
Однак широкому застосуванню апоморфіну при ХП перешкоджала його погана біодоступність при пероральному застосуванні, вихідний профіль побічних ефектів. Периферичні несприятливі ефекти апоморфіну, особливо нудота, підтверджують його дофамін-агоністичну активність, якою стало легше керувати з появою препаратів — антагоністів дофаміну периферичної дії, таких як домперидон у Європі й триметобензамід у США [15, 18].
Незважаючи на це, використання апоморфіну для лікування ХП залишалося обмеженим, оскільки наріжним каменем лікування захворювання стала леводопа й були розроблені інші агоністи дофаміну, які можна було приймати перорально. Акценти на можливості використання леводопи й агоністів дофаміну як монотерапії або в комбінації відволікали увагу клініцистів від апоморфіну, у зв’язку з чим його застосування стало обмеженим, він застосовувався лише невеликими групами неврологів, які переконливо обґрунтували його використання як невідкладної підшкірної ін’єкції або безперервної інфузії, протягом багатьох років. Особливо це стосувалося клініки А. Lees в Лондоні, Велика Британія [16–18].
Унікальність проведених А. Lees досліджень підтверджувала світова клінічна практика, яка відзначила виникаючі обмеження щодо перорального прийому леводопи й агоністів дофаміну, особливо на виражених стадіях перебігу ХП.
У даний час активно набуває визнання використання апоморфіну в лікуванні клінічних епізодів з раптовими періодами «виключення» і «скорочення періодів дії разової дози», коли пероральний прийом ліків не забезпечував адекватну клінічну ефективність. Але навіть ця об’єктивна реальність не дозволяє стверджувати, що на сьогодні апоморфін є препаратом, який досить широко використовується при ХП. Оскільки препарат в основ-ному застосовується у вузькоспеціалізованих центрах, його висока клінічна ефективність часто не може бути реально оцінена неврологами загального профілю [20–22]. При цьому нерідко виникають практичні запитання про ефективність апоморфіну порівняно з пероральним прийомом леводопи й дофаміновими агоністами та іншими методами лікування виражених стадій ХП (інфузія леводопи й глибока стимуляція мозку (DBS)) (табл. 1).
/71.jpg)
Апоморфін був першим агоністом дофаміну з потужною протипаркінсонічною дією, використовуваним у клінічній практиці на десятки років раніше за леводопу. Будучи похідним морфіну, препарат спочатку використовувався як блювотний, відхаркувальний, заспокійливий засіб, антипсихотичний і протисудомний, а також для лікування наркотичної та алкогольної залежності [23, 24]. У даний час відомо, що апоморфін — це високоліпофільний неерголіновий агоніст дофаміну короткої дії, який діє на дофамінові рецептори D1 і D2 типів [24, 26]. Апоморфін уперше був синтезований у 1869 році Matthiessen і Wright [25], а Wail уже в 1884 р. рекомендував використовувати його при ХП. Перші випробування препарату почалися в 1950 р. (Wenzel, Cotzias, Lees) [12, 25, 27]. У 1951 році Schwab et al. [28] спостерігали зменшення ригідності й тремору в пацієнтів із ХП уже через 5–10 хвилин після підшкірного введення від 0,5 до1,0 мг апоморфіну. Пізніше ці результати були підтверджені Cotzias et al. [24, 27]. Оскільки пероральний прийом апоморфіну у хворих з ХП вимагає великої дози для досягнення бажаної клінічної відповіді, виражені периферичні відповіді були звичайним побічним явищем, яке може включати нудоту, блювання, постуральну гіпотензію і порушення функції нирок, що виражається в підвищенні рівня сечовини й креатиніну [12]. Для уникнення цих побічних ефектів були вивчені різні шляхи введення апоморфіну. Найбільш успішним було визнано підшкірне введення [23, 25, 29, 30, 32]. Було показано, що апоморфін має переваги перед іншими агоністами дофаміну, такими як лізурид, тому що він має менше побічних ефектів і викликає значне покращання моторних і немоторних симптомів, таких як гіпергідроз, ніктурія, нетримання сечі, втома і розлади настрою. Препарат добре переносився пацієнтами із зоровими галюцинаціями, ілюзіями й параноїдальними ідеями, покращував стан при порушеннях сну й синдромі неспокійних ніг, не викликав денної сонливості [33]. У 1988 році група вчених під керівництвом А. Lees розробила механізм безперервної підшкірної інфузії апоморфіну, що пізніше був рекомендований пацієнтам з тяжкими, рефрактерними періодами «виключення» [17]. Хоча безперервне лікування введенням апоморфіну було вперше запропоновано Stibe et al. [17] у 1988 р., підшкірні ін’єкції препарату були схвалені FDA для використання в терапії періодів «виключення» тільки у 2004 році [26] і зареєстровані під назвою «Ефективність апоморфіну як лікарського засобу невідкладної терапії у хворих на ХП».
Так, були підсумовані й проаналізовані протоколи лікування хворих на ХП і запропоновані стандарти лікування хвороби Паркінсона. Загальні цілі симптоматичного лікування ХП полягають в забезпеченні конт-ролю над симптомами хвороби при мінімізації побічних ефектів від прийому ліків, що включають пізні ускладнення у вигляді моторних флуктуацій і дискінезій. Найбільш ефективним симптоматичним препаратом для лікування ХП є леводопа. Пероральні й трансдермальні дофамінергічні агоністи (ДA) також мають дофамінергічні переваги й можуть відстрочити розвиток рухових ускладнень при призначенні як у монотерапії, так і в комбінації з мінімальними дозами леводопи, необхідними для контролю рухової активності на ранніх стадіях хвороби Паркінсона. Після розвитку моторних флуктуацій терапевтичні підходи включають: збільшення доз леводопи або скорочення інтервалів між її прийомами, додавання інгібіторів катехол-О-метилтрансферази і/або моноаміноксидази (MAO-B) для блокування розпаду леводопи й дофаміну або додавання ДA-агоністів для пацієнтів, які ще не приймали цей клас препаратів за умови відсутності протипоказань.
Однак у значної частини пацієнтів залишаються неадекватно контрольовані моторні флуктуації, незважаючи на застосування низки пероральних (або транс-дермальних) препаратів, з перервами в дії ліків, що клінічно проявляється в періодах «виключення», а також дискінезіями, включно з дистонією. Проблема може посилюватися також порушеннями спорожнення кишечника, які часто виникають при прогресуванні ХП, що, у свою чергу, обмежує абсорбцію ліків і надійність ефекту леводопи протягом дня. Утруднене ковтання також є проблемою, що обтяжує клінічну симптоматику в пацієнтів із ХП і може впливати на здатність пацієнта дотримуватися тимчасового перорального прийому ліків.
Фармакологія і механізм дії апоморфіну
Апоморфін — це похідне апорфіну з класу дибензохінолінів, молекулярна структура якого виглядає як «ригідна» форма дофаміну (рис. 1). Ця структурна схожість надає апоморфіну його дофамінергічної активності, і саме тому він діє як потужний агоніст дофаміну прямого й широкого спектра дії, активуючи всі дофамінові D1-подібні (D1, D5) і D2-подібні (D2, D3, D4) рецептори [34]. Його високий афінітет і схожість з дофаміновими рецепторами в поєднанні з надійним і швидким ефектом і початком дії після підшкірного введення привели до того, що апоморфін став «ключем» і своєрідним інструментом у численних лабораторних дослідженнях експериментальних моделей ХП. У нормальних гризунів застосування апоморфіну викликає стереотипну поведінку щурів, він відновлює руховий дефіцит у гризунів з резерпіновою або галоперидоловою моделлю паркінсонізму, у 6-OHDA- і МРТР-модельних щурів і приматів, що відображає його дію як центрального агоніста дофаміну [35].
/72.jpg)
Поширена думка, що апоморфін є типовим агоністом дофаміну, але це не зовсім точно, якщо мати на увазі його багатогранну дію на дофамінові та інші рецептори, залучені в патогенетичний ланцюг формування клінічних проявів ХП. Фактично апоморфін — це молекула з різноманітним діапазоном фармакологічних ефектів. Навіть з урахуванням його взаємодії з дофаміновими рецепторами він значно відрізняється від широко застосовуваних пероральних дофамінових агоністів. Наприклад, якщо дії праміпексолу й ропініролу обмежені D2-подібними рецепторами (D2 і D3), то апоморфін взаємодіє як з рецепторами D1, так і з класами D2 і з усіма основними підтипами (D1, D2, D3, D4, D5), що може мати важливе функціональне значення [34, 36].
Обмежена взаємодія пероральних агоністів дофаміну з підтипами дофамінових рецепторів часто згадується як основна причина, через яку такі сполуки, як ропінірол і праміпексол, мабуть, не мають протипаркінсонічної ефективності, еквівалентної монотерапії леводопою [37]. Показано, що в нормальному мозку леводопа діє на всі типи дофамінових рецепторів через механізм перетворення в дофамін (як і ендогенний ней-ротрансмітер). Потім через механізм перетворення в дофамін леводопа впливає на всі типи дофамінових рецепторів (як і ендогенний нейротрансмітер) у нормальному мозку, що й відрізняє леводопу від пероральних дофамінових агоністів, які мають обмежену взаємодію з дофаміновими рецепторами, з меншою активацією рецепторів D1. Можна вважати, що рецептор D1, зокрема його основні шляхи проведення, пов’язані безпосередньо зі смугастим тілом, що може бути позначено як причина ініціації дискінезій [38, 39], але насправді ця гіпотеза ніколи не була доведена. Так, у доклінічних дослідженнях введення агоністів D1 не приводило до більшої індукції дискінезій або їх експресії порівняно з препаратами — агоністами D2-рецепторів. Швидше, це виглядає як перевага в стимуляції D1-рецепторов, що викликає редукцію моторного дефіциту в модельних тварин з паркінсонічним синдромом і в людей із ХП [40, 41]. Активація D1-рецепторів також може бути корисною при лікуванні такого немоторного симптому ХП, як гіперрефлексія сечового міхура, що було продемонстровано як в експериментальних моделях, так і в клінічних дослідженнях у хворих із ХП [42, 43].
У даний час відомо, що рецептори дофаміну розташовані в багатьох частинах мозку, а не тільки в базальних гангліях. Активація кіркових і лімбічних ділянок у відповідь на вплив агоністів дофаміну провокує появу деяких побічних ефектів, аналогічних тим, що виникають при замісній терапії дофамінергічними препаратами в пацієнтів із ХП, включно з порушенням імпульсного контролю (ICD) і зоровими галюцинаціями. Отже, така широка дофаміноподобна дія апоморфіну може розглядатися і як недолік. Наприклад, було висловлено припущення, що розвиток ICD може бути пов’язаний з активацією D3-рецепторів у лімбічних ділянках [44].
Дійсно, було показано, що відносно висока частка пацієнтів з ICD, які отримують терапію праміпексолом, ропініролом і ротиготином, проявляє пряму кореляцію із селективністю цих препаратів до D3-рецепторів порівняно з D2-рецепторами [44]. При цьому апоморфін має більш низьке співвідношення D3 : D2, ніж праміпексол і ропінірол [36], що може мати клінічне значення, хоча в даний час невідомо, чи частота ICD насправді була нижчою при прийомі апоморфіну порівняно з іншими агоністами дофаміну.
Відновлення дофаміну леводопою не може бути єдиною причиною того, що леводопа високоефективна при ХП. Деяка частина дофаміну, що утворюється з леводопи, у свою чергу, перетворюється в норадреналін (який, як відомо, у дефіциті при ХП). Крім того, дофамін, отриманий з леводопи, накопичується в серотонінергічних нейронах і може витісняти 5-HT. Щодо цього апоморфін також дає багатогранний фармакологічний ефект, оскільки має спорідненість до рецепторів серотоніну (5HT1A, 5HT2A, 5HT2B і 5HT2C) і α-адренорецепторів (α1B, α1D, α2A, α2B і α2C) [34]. Однак даний факт є і основною причиною застережень щодо використання пероральних агоністів ропініролу і праміпексолу, які мають, як правило, більш обмежений фармакологічний профіль.
Отже, майже всі ДА-агоністи виявляють селективність відносно одного конкретного рецептора, що опосередковує їх основну фармакологічну й клінічну діяльність. Проте лише дуже небагато з них специфічні у своїх рецепторних взаємодіях, а більшість їх представників демонструє цільову ефективність, що стає потенційною причиною небажаних побічних ефектів. Зокрема, це можна віднести до ДА-агоністів, що є дериватами ріжків (бромокриптин, перголід, каберголін), які, незважаючи на свою високу ефективність, були зняті зі застосування через рідкісні, але дуже грізні ускладнення, такі як виникнення легеневого фіброзу й серцевої фіброзної вальвулопатії, через прямий вплив на активність 5-HT2B рецепторів [45, 46]. Більше того, це стало основною причиною розробки неерголінових препаратів, таких як ропінірол і праміпексол, і їх активність була спрямована на ізольований вплив лише на деякі підтипи дофамінових рецепторів.
Розгляд мультимодального фармакологічного профілю апоморфіну щодо всіх підтипів дофамінових рецепторів показав його високу терапевтичну ефективність порівняно з профілем можливих побічних ефектів. Наприклад, апоморфін, взаємодіючи з 5-HT2B-рецепторами, на порядок менш активний, ніж похідні ріжків (принаймні in vitro) [34]. Провівши аналіз бази даних побічних ефектів агоністів ДА-рецепторів, FDA не підтвердило аналогічних ознак для апоморфіну [47]. При цьому висловлено припущення, що апоморфін відносно рідко викликає зорові галюцинації за рахунок передбачуваного потенційного механізму своєї взаємодії з активністю рецепторів 5-HT2 [48–51].
Показано також, що апоморфін зв’язується з пре- і постсинаптичними ДА-рецепторами і дає терапевтичний ефект шляхом безпосередньої стимуляції постсинаптичних D2-рецепторів у смугастому тілі, що призводить до активації прямих і інактивації непрямих стріатопалідарних зв’язків [51–53].
Рухова відповідь на одноразове підшкірне введення апоморфіну виникає аналогічно до відповіді на леводопу, але з більш швидким початком (приблизно за 4–12 хв), при середній тривалості ефекту протягом 45–60 хв [51, 57]. У світлі цих терапевтичних ефектів апоморфін став одним із прототипів «ліків невідкладної допомоги» при ХП у випадках непередбачуваних періодів «виключення», що виникають у пацієнтів на виражених стадіях захворювання з погано контрольованими моторними флуктуаціями.
Крім того, апоморфін не конкурує за метаболічні шляхи з леводопою і, на відміну від леводопи, не вимагає активного транспортного механізму для досягнення впливу на центральну нервову систему [52, 53, 58, 62, 63]. Абсорбція препарату залежить від температури, а найкраща його абсорбція досягається при введенні в підшкірну клітковину передньої черевної стінки.
В апоморфіну немає взаємодії з інгібіторами цито-хрому P450, а сама система цитохрому P450 не перешкоджає метаболізму препарату.
При підшкірному введенні апоморфін швидко всмоктується і завдяки високій ліпофільності легко проникає через гематоенцефалічний бар’єр. Пікова концентрація в плазмі досягається через 10–20 хв після підшкірного введення, а максимальна концентрація в спинномозковій рідині фіксується через 30 хв. У середньому клінічний ефект апоморфіну реалізується вже через 7–17 хв після підшкірної ін’єкції. Період напіввиведення при підшкірному введенні апоморфіну з плазми крові триває близько 30 хвилин, а концентрація препарату в плазмі залишається досить стабільною [61, 62]. Такі фактори, як місце ін’єкції, глибина ін’єкції, шкірна температура і, можливо, товщина і якість підшкірних тканин можуть змінити фазу абсорбції препарату, який вводиться, що може привести до варіабельності клінічного ефекту в різних пацієнтів, однак внутрішньоіндивідуальна відтворюваність ефекту залишається дуже високою.
Вік, стать, тривалість захворювання, дозування леводопи або тривала апоморфінова терапія, мабуть, не відіграють провідної ролі в кліренсі ліків [54, 59, 60, 61].
Ефективність апоморфіну за даними клінічних досліджень
У клінічних дослідженнях останніх десятиліть вірогідно встановлена ефективність апоморфіну для скорочення часу періодів «виключення», що виникають у пацієнтів з ХП на тлі леводопатерапії. Як і леводопа, апоморфін був уперше дозволений до клінічного використання, коли вимоги до реєстрації ліків і дизайну клінічних випробувань були менш суворими, ніж сьогодні. Апоморфін, як протипаркінсонічний препарат, використовувався у Європі задовго до отримання результатів рандомізованих контрольованих випробувань, які висвітлюють результати оцінки ефективності застосування переривчастих ін’єкцій апоморфіну у хворих із ХП.
У табл. 2 узагальнені основні дані подвійних сліпих досліджень, що оцінюють ефективність періодичних ін’єкцій апоморфіну для лікування хворих із ХП. Основна маса даних рандомізованих контрольованих досліджень була зібрана для необхідності реєстрації препарату в США. Усі разом узяті дослідження надають дуже переконливу доказову базу щодо ефективності періодичних ін’єкцій, що забезпечують швидке полегшення при раптових епізодах «виключення» у хворих на ХП.
/74.jpg)
Кілька відкритих досліджень щодо використання періодичних ін’єкцій апоморфіну, що зазвичай проводяться у відокремлених експертних центрах, надали ранні докази ефективності періодичних ін’єкцій апоморфіну (разові дози варіювали від 2 до 5 мг) для забезпечення швидкого й невідкладного лікування епізодів «виключення». Коли апоморфін вводився «за необхідності», середнє зниження добового часу виключення було в діапазоні 2,6–4,0 год. Полегшення симптомів було швидким (зазвичай через 10 хв), і, як повідомлялося, тривалість ефекту становила не менше за годину. Слід зазначити, що деякі з цих досліджень повідомляли, що пацієнти відчували кращий контроль своїх симптомів і отримували впевненість в реальній здатності виходити з епізодів «виключення» [64–66].
Зовсім недавно були опубліковані результати відкритого дослідження AM-IMPAKT [67]. Дослідження AM-IMPAKT стало IV фазою багатоцентрового дослідження, покликаного оцінити ефект ін’єкції апоморфіну пацієнтам з тривалою ранковою акінезією через відстрочене або неналежне «включення» першої ранкової дози леводопи. Ранкова акінезія вважалася дійсною, якщо час «включення» леводопи в пацієнта перевищував 45 хвилин за умови постійної добової дози леводопи протягом мінімум 3 днів і одного тижня від вихідного періоду. Слід зазначити, що пацієнти в цьому відкритому дослідженні мали більш тривалий час до періоду «включення» ранкової дози леводопи, яке становило в середньому 1 годину, і частота «неефективних разових доз» леводопи протягом доби була високою. Скорочення часу до «включення» (середнє скорочення на 37,14 хв) і підвищення надійності відповіді (частота неефективних доз при прийомі ранкової дози леводопи становила 46 % проти 7 % з апоморфіном) було клінічно значущим, про що свідчило значне покращання, що відзначається пацієнтами за шкалами оцінки якості життя і загального клінічного враження (CGI) (рис. 2).
/75.jpg)
Ефективність періодичних ін’єкцій апоморфіну
Перші подвійні сліпі дослідження, у яких періодична підшкірна ін’єкція апоморфіну застосовувалася при ХП, були проведені в 1970 році Cotzias et al., а потім в 1988 році Stibe at al., у них препарат використовувався для невідкладної терапії в періоді «виключення» [68]. Опубліковані дослідження ефективності періодичних ін’єкцій апоморфіну в ранній стадії ХП були відкритими неконтрольованими й мали невеликі розміри вибірки. Найяскравішим результатом цих досліджень стало скорочення середнього періоду «виключення» до 44 %, при цьому середнє дозування леводопи залишалася в основному без змін [69–76]. У цих дослідженнях дискінезії спеціально не розглядалися. Пізніше Hughes et al. опублікували результат дослідження 71 пацієнта. Хворі отримували періодичні ін’єкції апоморфіном до 10 разів на день і більше, унаслідок чого довелося змінити тактику періодичних ін’єкцій апоморфіну на безперервну інфузію препаратом у вигляді помпи [71]. Показано, що в 49 пацієнтів, які отримували періодичні ін’єкції апоморфіном, було досягнуто скорочення періоду «виключення» на 50 %. Після 1 року лікування близько 80 % пацієнтів продовжували повідомляти про ефективність терапії апоморфіном. При цьому середня добова доза апоморфіну збільшилася на 24 % за 1 рік використання, тоді як доза леводопи була зменшена на 5 %.
В інших дослідженнях показані аналогічні результати, що свідчать про відсутність толерантності до підшкірного введення апоморфіну, а його ефективність однаково вірогідна в пацієнтів на різних стадіях клінічного перебігу ХП.
Одне з перших подвійних сліпих плацебо-конт-рольованих досліджень було проведено в 1995 році Oestergaardon еt al. [73]. Після попередньої премедикації домперидоном 22 пацієнтам вводилась доза апоморфіну з інтервалами в 120 хв, вона становила 1,6; 3,2; 4,8 і 6,4 мг препарату підшкірно. Дози плацебо вводилися у випадковому порядку в процесі лікування.
Друга фаза цього дослідження була присвячена оцінці дозування препарату з наступною 8-денною плацебо-контрольованою перехресною терапією, включно з введенням протягом 4 днів апоморфіну і протягом 4 днів — плацебо. У третій фазі дослідження пацієнти оцінювалися протягом 8-тижневого відкритого періоду терапії в амбулаторних умовах. Спостерігалося скорочення періоду «виключення» більше ніж на 50 % при використанні апоморфіну в середній дозі 3,4 мг. 12 пацієнтів відзначили покращання «сильно» або «дуже сильно» у своїй оцінці Clinical Global Impression Scale. Кроме того, спостерігалося зниження вираженості проявів супутньої дисфонії і болючої дистонії [77].
У США було проведено низку контрольованих досліджень для оцінки ефективності й переносимості апоморфіну. Так, в Apomorphine National Institute of Health Study досліджували 28 пацієнтів із ХП, які були розподілені на чотири групи: хворі з «виснаженням ефекту разової дози», непередбачуваними коливаннями періоду «включення/виключення», стабільною реакцією на леводопу і ті, які раніше не приймали леводопу. У всіх групах було досягнуто значне покращання за показниками рухової оцінки на 35–77 %.
Дослідження APO202 було основним рандомізованим проспективним подвійним сліпим плацебо-контрольованим дослідженням. Було рандомізовано 29 пацієнтів, з яких 20 потрапили в групу активного препарату і 9 — у групу плацебо. Тривалість періоду «виключення» була оцінена за допомогою щоденника пацієнта і шкали UPDRS. Було показано значно більше скорочення періоду «виключення» (p < 0,001) у групі апоморфіну (95,0 ± 2,4 %) порівняно з групою плацебо (23,0 ± 0,4 %). Середня ефективна доза апоморфіну становила 5,4 мг. Цей ефект був порівнянний з ефектом леводопи, однак період з дискінезіями збільшився, а вираженість дискінезій не змінилася. Закінчили дослідження 17 пацієнтів групи апоморфіну й 8 пацієнтів групи плацебо. Позіхання, сонливість і нудота частіше виникали в групі апоморфіну, але в іншому відмінностей у профілях побічних ефектів не було виявлено [76].
Довгострокова ефективність апоморфіну як ліків невідкладної допомоги оцінювалася в дослідженні APO302: 62 пацієнти, які мали досвід лікування апоморфіном не менше за 3 місяці, отримали свою звичайну «невідкладну» ін’єкцію, але використовували на 2 мг більше за звичайну ефективну дозу або плацебо. Основною кінцевою точкою дослідження було отримання результатів щодо можливого покращання показників рухової частини шкали UPDRS. Показано, що більш висока ефективність при застосуванні апоморфіну порівняно з плацебо визначалася у вигляді покращання показників рухової частини шкали UPDRS і спостерігалася через 10 хв (–19,9 проти –5,6 з плацебо, p < 0,001) і 20 хв (–24,2 проти –7,4 з плацебо, p < 0,001) [78].
У дослідженні APO301, проведеному для оцінки довгострокової ефективності терапії апоморфіном у 17 пацієнтів протягом 4–51 місяців, які отримували свою звичайну ефективну дозу апоморфіну (середня доза
4 мг) або плацебо, максимальне покращання оцінки рухової частини шкали UPDRS становило 21,3 бала через 20 хв після ін’єкції [79].
У дослідженні APO303 56 пацієнтів, які раніше не отримували апоморфін, були рандомізовані з метою оцінки ефективності дії апоморфіну або плацебо в дозі до 10 мг. Показано, що оцінка UPDRS покращилася на 11,3 бала за 20 хв (р = 0,0002) в основній групі і на 13,4 бала за 40 хв у групі плацебо (p = 0,0001) [80, 81].
Ці ключові дослідження сприяли схваленню апоморфіну в US FDA у 2004 р. під назвою «Застосування періодичних підшкірних ін’єкцій апоморфіну як лікування раптових періодів «виключення» в пацієнтів із ХП».
Попередні результати IV фази багатоцентрового відкритого дослідження (Apokyn for Motor IMProvement of Morning Akinesia Trial) у 37 пацієнтів з ранкової акінезією внаслідок відстроченого початку дії леводопи виявили, що ін’єкція апоморфіну була високонадійною і ефективною терапією в 96 % пацієнтів, а досягнення скорочення часу до виникнення періоду «включення» становило до 40 хв [82]. Це дослідження також підкреслило, що непероральні шляхи доставки дофамінергічних ліків, такі як ін’єкції апоморфіну, є реальною можливістю для адекватної терапії ХП при відстроченому часі «включення» дози леводопи, що пов’язано з дисфункцією шлунково-кишкового тракту, яке зазвичай спостерігається в пацієнтів із ХП.
Дослідження TOLEDO було першим подвійним сліпим рандомізованим клінічним випробуванням підшкірної інфузії апоморфіну, проведеним у пацієнтів із ХП [87]. У дослідження увійшли пацієнти з тривалістю захворювання понад 3 роки, що супроводжується руховими флуктуаціями, які погано конт-ролювалися застосуванням пероральних або транс-дермальних протипаркінсонічних препаратів, і при якому пацієнти застосовували не менше за 4 добові дози леводопи. Дизайн 12-тижневого дослідження передбачав застосування підшкірної інфузії апоморфіну або плацебо з подальшим відкритим 64-тижневим лікуванням апоморфіном. Було рандомізовано 107 пацієнтів, більшість з яких були госпіталізовані під час фази титрації апоморфіну. Доза апоморфіну була скоригована протягом перших 4 тижнів з подальшим 8-тижневим підтримуючим періодом (доза апоморфіну: 3–8 мг/год). Показано, що підшкірна інфузія апоморфіну скорочувала тривалість періоду «виключення» (–2,47 проти –0,58 год) і збільшувала тривалість періоду «включення» за відсутності тяжких дискінезій (2,77 год порівняно з 0,80 год). Покращувалися показники шкали PGI, що дозволило помітно знизити еквівалентну дозу леводопи. Крім того, значно збільшилася кількість пацієнтів у групі, що одержувала лікування, у яких скорочення тривалості періоду «виключення» спостерігалося протягом ≥ 2 годин. У більшості випадків інфузія апоморфіну добре переносилася, а відзначені побічні ефекти були тільки легкого або помірного ступеня.
Як найбільш часті небажані явища були зареєстровані шкірні вузлики в місці введення препарату — в 44 % випадків, нудота — у 22 % і сонливість — у 22 % спостережень [129].
Слід зазначити, що леводопа теж використовувалася в клінічній практиці задовго до того, як у 2004 році були опубліковані результати першого рандомізованого подвійного сліпого плацебо-контрольованого дослідження ELLDOPA [128]. Однак відсутність масштабних рандомізованих доказів не завадила масовому використанню леводопи як золотого стандарту лікування ХП у всьому світі. Навпаки, хоча апоморфін і використовувався до цього майже 30 років, відсутність доказів ефективності класу І перешкоджала його повсюдному застосуванню. Є підстави вважати, що результати, отримані в дослідженні TOLEDO, надихнуть клініцистів у всьому світі розширити використання терапії апоморфіном і допоможуть розглянути належним чином застосування препарату як дієвий і конкурентоспроможний варіант розширеного лікування ХП, а не як останній засіб перед рекомендацією пацієнтові стати кандидатом на застосування леводопи/карбідопи — інтестинального гелю або DBS.
Під керівництвом S. Isaacson (2016) спеціальний проєкт, у якому вивчалася ранкова акінезія у хворих із ХП як можлива мішень для застосування ін’єкцій апоморфіну, був виконаний у спеціалізованих клініках США. Результати цього відкритого дослідження також переконливо демонструють, що ін’єкція апоморфіну значно скорочує час до «включення» леводопи на виражених стадіях у пацієнтів із ХП, які відзначають ранкову акінезію, що є результатом відстроченого «включення» або відсутності ефекту дії ранкової дози леводопи, а ін’єкція апоморфіну, як правило, добре переносилася більшістю пацієнтів.
У цих пацієнтів у середньому спостерігалася пролонгація часу до періоду «включення» ранкової дози леводопи до однієї години. Скорочення часу до «включення» (середнє скорочення на 37,14 хв) було клінічно значимим, про що свідчить суттєве покращання показників за шкалами якості життя і загального клінічного враження, які заповнювали пацієнти. Рання ранкова акінезія, як ускладнення терапії леводопою, відчувалася пацієнтами при пробудженні як однин із перших симптомів [89].
У дослідженні, проведеному в Європі, показано, що при послідовному й навмисному розпитуванні пацієнтів із ХП про стан їх ранкової рухової активності виявляється ≤ 60 % респондентів, які повідомляють про ранні ранкові періодах «виключення» [90]. Результати проведеного дослідження показали, що, незважаючи на таку значну поширеність клінічного феномену ранкової дистонії, ці явища часто залишаються погано виявлюваними, а тому не можуть бути скориговані прийомом традиційних пероральних протипаркінсонічних препаратів. І, незважаючи на їх часте використання, пацієнти страждали від ранкової акінезії в середньому близько 4 років.
Так, було показано, що після прийому першої ранкової дози леводопи протягом 7 днів від вихідного (початкового) періоду спостереження > 40 % пацієнтів мали хоча б один епізод «недостатнього ефекту разової дози», який визначався як відсутність періоду «включення» протягом 60 хв після прийняття дози леводопи. Це, імовірно, відображає затримку надходження леводопи зі шлунка в проксимальний відділ кишечника, де вона повинна всмоктуватися (можливо, залишки білкової їжі могли ще знаходитися в кишечнику в період пробудження). Висловлено припущення, що при більш повільному спорожненні шлунка більша кількість леводопи може метаболізуваться дофа-декарбоксилазою в дофамін у слизовій оболонці шлунка [88].
Відзначено, що при лікуванні апоморфіном неефективність дозування зустрічалася набагато рідше, а середній час до періоду «включення» при використанні підшкірної ін’єкції апоморфіну становив близько 24 хв, що дозволяє припустити, що в основі відсутності «ефекту разової дози леводопи» може лежати шлунково-кишкова дисфункція. Майже всі випробовувані (95,5 %) показали скорочення часу до початку періоду «включення». Ефект апоморфіну на рухову активність був надійним і стійким і виражався в значному покращанні показників за шкалою Hoehn і Yahr і за шкалою UPDRS-III, що розглядалося як ефект, аналогічний дії леводопи. Для пацієнтів мали клінічне значення більш безпечне пробудження й можливість подальшого виконання звичних ранкових справ і рухової активності протягом дня. Усе це свідчить про те, що пацієнти оцінюють ранкову акінезію як явну проблему, що значно погіршує якість їхнього життя.
Найбільш частими причинами припинення пацієнтами прийому апоморфіну були нудота, блювання й гіпотензія. Застосування триметобензаміду для усунення нудоти й блювання на початку і в період продовження лікування ін’єкціями апоморфіну показало, що тільки 16 % пацієнтів, які попередньо отримували триметобензамід, відчували нудоту і/або мали блювання в періоді титрації препарату [91].
Отже, підшкірні ін’єкції апоморфіну забезпечують швидкий і надійний ефект «включення» для пацієнтів з ранкової акінезією, імовірно, за рахунок усунення проблеми доставки й абсорбції дози леводопавмісного препарату через шлунково-кишковий тракт. На додаток до усунення епізодів періодів «виключення» ін’єкції апоморфіну мають клінічне застосування для зменшення ранньої ранкової акінезії, забезпечуючи швидкий і надійний ефект «включення» при використанні препарату після пробудження пацієнта.
Резюме до дослідження TOLEDO: підшкірна інфузія апоморфіну актуальна як терапія, призначена для лікування хвороби Паркінсона з моторними флуктуаціями, що оптимально не контролюються пероральним прийомом протипаркінсонічних препаратів.
Відкрита фаза дослідження показала, що інфузія апоморфіну ефективна для скорочення періоду «виключення» (періоди, коли леводопавмісні препарати не діють).
TOLEDO — це рандомізоване плацебо-контрольоване подвійне сліпе багатоцентрове дослідження, у яке включені пацієнти з 23 європейських клінічних центрів, у яких хвороба Паркінсона була діагностована протягом 3 і більше років від початку захворювання і моторні флуктуації адекватно не контролювалися пероральним прийомом препаратів. Усі пацієнти були розподілені випадковим чином (1 : 1) за допомогою комп’ютерної рандомізації кодом, стратифікованим по групах, для прийому 3–8 мг/год апоморфіну або плацебо сольового розчину в години неспання (16 годин на день протягом 12 тижнів). Швидкість інфузії досліджуваного препарату та інших пероральних препаратів могла коригуватися протягом перших 4 тижнів на основі індивідуальної ефективності й переносимості, після чого пацієнтів вводили у 8-тижневий випробувальний період.
Це дослідження зареєстровано на сайті ClinicalTrials.gov (NCT02006121) з результатами, отриманими з 3 березня 2014 р. по 1 березня 2016 р. 128 пацієнтів відібрані згідно з чинними критеріями, а 107 були призначені випадковим чином, з яких 106 були включені в повну аналітичну вибірку (n = 53 в обох групах). Інфузія апоморфіну (середня кінцева доза 4,68 мг/год [SD 1,50]) значно скоротила тривалість періоду «виключення» порівняно з плацебо (–2,47 годин на день [SD 3,70] у групі апоморфіну порівняно з –0,58 год на день [2,80] у групі плацебо; різниця –1,89 год на добу, 95% ДІ від –3,16 до –0,62; р = 0,0025) [87].
В оригінальному дослідженні Marxreiter et al. (2018) було проведено аналіз ефективності підшкірних періодичних інфузій апоморфіну за допомогою мобільного сенсорного аналізу ходьби у хворих на хворобу Паркінсона з об’єктивним вимірюванням параметрів ходьби в перехресних дослідженнях [93]. Метою даного дослідження було визначити, наскільки відповідь на дофамінергічне лікування пацієнтів із ХП можна кількісно оцінити за допомогою сенсорного аналізу ходьби з використанням спеціальних датчиків. 13 хворих із ХП отримували ін’єкції апоморфіну кожні 15 хвилин для поступового збільшення біодоступної дози апоморфіну. Показники рухової активності (UPDRS III) оцінювалися через 10 хв після кожної ін’єкції апоморфіну. Параметри ходьби були отримані після кожної оцінки параметрів UPDRS III від початку ходьби довжиною 2 × 10 м, що забезпечувало показник у 41,2 ± 9,2 кроку на пацієнта, у відповідь на кожну ін’єкцію. У перехресному аналізі показано, що в пацієнтів, які отримували апоморфін, покращувалася швидкість і довжина кроку, швидкість ходьби, максимальний кліренс стопи при ходьбі і кут відхилення пальців. Величини індивідуальних змін у швидкості, довжині й максимальному кліренсі стоп між ін’єкціями корелювали з покращанням моторики в кожного пацієнта. Крім того, значні зміни довжини кроку між ін’єкціями препарату корелювали з покращанням UPDRS III. Отже, вірогідно підтверджено, що сенсорний аналіз ходьби відображає об’єктивні зміни параметрів ходьби, які підтверджують рівень клінічної оцінки ефективності персоніфікованого дофамінергічного лікування в пацієнтів із ХП. Авторами запропоновані клінічно значущі інструментальні показники параметрів ходьби для досліджень ефективності одноразових інфузій апоморфіну, що особливо важливо в клінічній практиці.
У цьому дослідженні продемонстровано також, що показники параметрів ходьби, які визначаються на основі клінічного сенсорного аналізу ходьби, забезпечують об’єктивну оцінку якості ходьби, що відображають покращання рухової активності при ХП у результаті застосування апоморфіну.
Показано, що використання інструментального аналізу для вимірювання індивідуальних змін параметра швидкості кроку при ходьбі, довжини кроку й максимального кліренсу стопи може бути персоніфікованою стратегією оцінки рутинних клінічних обстежень пацієнтів із ХП.
Більше того, запропоновані сенсорні системи аналізу ходьби, протестовані як оціночна система рухової активності для можливих поперечних і поздовжніх когортних досліджень. Наприклад, інерційні датчики (розміщення на обох зап’ястях і щиколотках, а також на грудині й на рівні п’ятого поперекового хребця) можуть забезпечувати вимірювання показників ходьби й рівноваги в порівнянних групах, розділених на підгрупи в статусі «виключення» і «включення». Результати сенсорного аналізу ходьби під час короткої послідовної ходьби (10–40 м) відрізняли пацієнтів із ХП від 42 пацієнтів групи контролю й корелювали з руховою активністю і стадією захворювання в поперечному аналізі в 190 пацієнтів із ХП [93]. У поздовжньому дослідженні зміни параметрів ходьби також різняться між когортами пацієнтів з ХП, корелюючи з прогресуванням рухових порушень. Так само порівнювалися групи пацієнтів у стані «виключено» з групою в періоді «включено».
Так, при поперечному аналізі у 12 пацієнтів, які отримували АRТ (Apomorphine Rapid Titration), показано, що швидкість кроку, швидкість ходьби, максимальний кліренс стоп, час повороту й довжина кроку є способом вимірювання ходьби й служать показниками оцінки змін параметрів ходьби у відповідь на лікування апоморфіном. Отримані дані свідчать про те, що інструментальний аналіз ходьби служить об’єктивною мірою оцінки терапевтичного ефекту парадигми дофамінергічного лікування, запропонованого для клінічних досліджень.
Рекомендації для застосування апоморфіну при ХП
Міжнародна група фахівців з великим клінічним досвідом застосування апоморфіну в лікуванні пацієнтів з хворобою Паркінсона була запрошена компанією Britannia Pharmaceuticals Ltd., виробником ін’єкцій та інфузій апоморфіну, для участі в консультативній раді з метою обміну практичним досвідом використання препарату [130]. Метою зустрічей було розробити керівництво для неврологів, лікарів загальної практики (терапевтів) та інших медичних працівників з оптимального клінічного використання апоморфіну.
Перша зустріч відбулася в жовтні 2012 року, друга — в травні 2013 року, у них взяли участь 26 експертів з 13 країн. Усі учасники зустрічі увійшли до консенсус-групи. Підсумки двох засідань Консультативної ради привели до консенсусу в поглядах на рекомендації щодо застосування в клінічній практиці підшкірних ін’єкцій апоморфіну при ХП, розробленого після аналізу даних опитувальників, заповнених членами комісії для впровадження досвіду і рекомендацій щодо застосування в клінічній практиці апоморфіну. При аналізі відповідей у 26 заповнених опитувальниках консенсус вважався досягнутим, коли понад 80 % експертів дійшли згоди.
Апоморфін у лікуванні хвороби Паркінсона
Апоморфін має низьку біодоступність при прийомі всередину й унаслідок екстенсивного метаболізму першого введення вимагає високих доз, щоб викликати клінічний ефект. Оскільки в ранніх дослідженнях фармакодинаміки апоморфіну повідомлялося про його нефротоксичність, був проведений спеціальний аналіз функції нирок у тварин, які знаходяться на хронічному лікуванні підшкірними ін’єкціями апоморфіну, під час якого не виявлено ознак ниркової токсичності при подібному способі введення препарату [94].
У даний час вважається встановленим, що переривчасті ін’єкції апоморфіну показані пацієнтам, які відчувають періодичні стани «виключення» через затримку початку клінічно значущого ефекту після перорального прийому леводопи. Апоморфін також рекомендують використовувати як препарат невідкладної допомоги при періодах «виключення», що нерідко виникають після пробудження. Пацієнтам, які відчувають періоди «укорочення часу ефекту разової дози», рекомендується періодична ін’єкція апоморфіну як екстрене (невідкладне) лікування. Ін’єкція апоморфіну забезпечує швидкий початок ефекту (зазвичай протягом 4–12 хвилин), а у зв’язку з швидким періодами напіввиведення середня тривалість протипаркінсонічної дії препарату становить близько 45–60 хв [95]. Найбільш широко вживаними формами препарату є розчини апоморфіну гідрохлориду в картриджах, що містять 10 або 20 мг/мл, з багаторазовим шприцом-ручкою.
Введення апоморфіну в вигляді інфузії можливе й у тих випадках, коли клінічно необхідна безперервна дофамінергічна стимуляція. Доза може бути підібрана з метою досягнення оптимального ефекту, результатом якого є безперервна доставка препарату в «терапевтичне вікно» в період від 12 до 24 (зазвичай 16) годин на добу. У цих випадках апоморфін доставляється через підшкірний катетер, підключений до невеликої портативної помпи, що фіксується на поясі або навколо шиї пацієнта. Показаннями до тривалої інфузії зазвичай є непередбачувані або пролонговані періоди «виключення», моторні флуктуації або дискінезії.
Встановлено, що періодичні ін’єкції апоморфіну є швидким і ефективним засобом лікування рухових флуктуацій у пацієнтів із ХП [96–100].
Підкреслено, що рішення про використання апоморфіну має прийматись з урахуванням симптомів пацієнта і ступеня його інвалідизації в результаті рухових ускладнень, на які перестала діяти оптимальна пероральна/трансдермальна терапія.
Коли потрібно припиняти або замінювати терапію апоморфіном?
Був досягнутий консенсус, що багато пацієнтів, імовірно, припинили лікування апоморфіном не через значущі причини. Точка зору експертів була така: потенційно оборотні побічні явища, як правило, не можуть стати вагомою причиною для припинення лікування. Значимість побічних ефектів у різних пацієнтів різниться, і при прийнятті рішення про призначення або скасування лікування необхідно враховувати індивідуальні особливості кожного пацієнта й наявність дискомфорту, викликаного ін’єкцією, порівняно з пероральної терапією, що може вплинути на дотримання пацієнтом режиму інфузії апоморфіну й переносимість побічних ефектів. Залежно від потреб конкретного пацієнта він може не припиняти лікування апоморфіном при виникненні легких або помірних підшкірних вузликів в місцях введення препарату, при дискінезіях, що викликані додатковим застосуванням пероральних препаратів, при негемолітичних анеміях, при незагрозливих, легкого ступеня вираженості галюцинаціях/ілюзіях.
У підсумку при аналізі опитувальників, заповнених групою експертів, встановлено, що лікування апоморфіном необхідно продовжувати в таких ситуаціях:
— дискінезії, що виникають на тлі прийому
пероральних дофамінергічних препаратів;
— передбачувана відсутність ефективності при виникненні легких шкірних вузликів, особливо тих, які можуть бути контрольовані лікуванням (див. нижче);
— легкі когнітивні порушення;
— легка ортостатична гіпотензія.
Ведення побічних ефектів
Ефективне ведення побічних ефектів — це ключ до довгострокової терапії апоморфіном. Експерти обговорили частоту й тяжкість виникнення низки небажаних явищ і дійшли висновку, що місцеві реакції, які виникають при інфузії апоморфіну, наприклад утворення вузликів від мінімального до помірного розміру в місці інфузії, легко контролюються звичайними методами.
До них належать:
— зміна місць інфузії;
— використання голок Teflon®;
— регулювання проведення підшкірної інфузії під оптимальним кутом (45–90º);
— дотримання гігієни шкіри й використання пом’якшуючих засобів на стороні інфузії;
— вибір більш низької концентрації, наприклад 5 мг на 1 мл, що були успішно використані;
— масаж місця інфузії (гумовою масажною кулькою або вібраційним масажним пристроєм);
— застосування лікування ультразвуком;
— використання силіконових гелевих пов’язок.
Ці методи рекомендуються на підставі клінічного досвіду, але жоден не був підтверджений формальними клінічними дослідженнями, за винятком даних щодо ультразвуку, у яких було показано ефективність його застосування для лікування вузликів на шкірі, у результаті чого пролікована сторона стає придатною для подальших ін’єкцій апоморфіну [101].
Експерти відзначили також, що постуральна гіпотензія виникає на тлі лікування апоморфіном нечасто, в основному в легкій формі, піддається лікуванню нефармакологічними методами, такими як збільшення споживання рідини й солі, піднесена ножна частина ліжка під час сну, повільна зміна положення тулуба, компресійні панчохи й додавання спеціальних препаратів, таких як мінералокортикоїди або мідодрин.
Нейропсихіатричні небажані явища, такі як сплутаність свідомості, зазвичай легкі й нечасті, виникають приблизно в 10 % випадків, але можуть бути тяжкими. Можуть виникати порушення імпульсного контролю, як і при використанні будь-якого іншого агоніста ДA-рецепторів.
Пандінг, прояв стереотипної (повторюваної) поведінки, може стати проблематичним, будучи проявом синдрому дофамінової дисрегуляції.
Нудота не є частим або серйозним побічним ефектом інфузії апоморфіну, хоча гострі невідкладні ін’єкції апоморфіну в минулому використовувалися в медицині спеціально для того, щоб викликати блювання. Нудоту зазвичай можна контролювати за допомогою попереднього лікування домперидоном. Через побоювання з приводу можливого подовження інтервалу QT на електрокардіограмі (ЕКГ) у пацієнтів, які приймають домперидон, European Medicines Аgency в березні 2014 року випустило оновлені рекомендації з лікування цим препаратом. Домперидон рекомендовано використовувати для полегшення симптомів нудоти й блювання, а дози слід знизити до не більше ніж 10 мг три рази на день, і зазвичай препарат не слід використовувати довше від одного тижня.
Гемолітична анемія, як потенційно тяжка ідіосинкразична небажана реакція, виникає рідко, менше ніж в 1 % випадків.
Показання для використання апоморфіну
Коли слід використовувати апоморфін?
Першим показанням для використання апоморфіну повинен бути підтверджений діагноз леводопа-чутливої хвороби Паркінсона [102–105]. Вік, як правило, не є обмежуючим фактором, а легкі когнітивні порушення й постуральні симптоми не є протипоказаннями. У показання для застосування апоморфіну слід включити наявність у пацієнтів рефрактерних періодів «виключення», наприклад, коли є затримка в настанні ефектів перорального прийому ліків; тривалі періоди «виключення» після пробудження; значні періоди «укорочення ефекту дії разової дози леводопи».
Препарат також може покращувати немоторні симптоми, такі як порушення сечовипускання, і служити діагностичним ключем при встановленні діагнозу.
Терапевтична відповідь на максимальні дози леводопи не обов’язково вказує на хворобу Паркінсона, але він менш постійний у пацієнтів з мультисистемною атрофією. Деякі пацієнти з іншими паркінсонічними синдромами не реагують або погано реагують на леводопу. У цьому плані дослідження, проведене групою вчених під керівництвом А. Lees, показало, що апоморфін можна використовувати як діагностичний тест відповіді на леводопу, що має точність 90 %. Дослідження показало, що реакція на апоморфін підтверджує діагноз хвороби Паркінсона, у той час як відсутність відповіді вказує на те, що цей діагноз малоймовірний.
Шляхи введення апоморфіну
Були досліджені різні шляхи введення апоморфіну [106, 109–112, 118]. Пероральний прийом був уперше випробуваний Cotzias et al., які поступово збільшували дозу до 1500 мг на день [131]. Толерантність від 150 до 1440 мг добових доз у цілому була доброю, але більш високі дози викликали азотемію. Біодоступність апоморфіну, що вводиться цим шляхом, становить менше за 4 %, тому цей шлях прийнято вважати неможливим, оскільки для досягнення бажаного ефекту потрібні дуже великі дози, що призводять до значних побічних ефектів, таких як нефротоксичність, яка проявляється в підвищенні рівнів креатиніну й сечовини [107, 108]. Біодоступність апоморфіну, прийнятого під язик, також низька (10–22 %), а підшкірна доза 3 мг і сублінгвальна доза 30 мг мають аналогічні фармакологічні профілі й клінічні відповіді [113].
Спрей для інтраназального введення має фармакокінетичний профіль, схожий з профілем апоморфіну, що вводиться підшкірно, але вимагає попередньої премедикації домперидоном [111, 113, 117, 118].
У дослідженні з використанням апоморфіну при ХП не було виявлено статистично значущих відмінностей між леводопою і апоморфіном за впливом препаратів на клінічну симптоматику при ХП, виміряну за допомогою шкали UPDRS [108].
Рекомендовано першу дозу апоморфіну вводити в стаціонарі з метою спостереження за клінічною відповіддю і визначення індивідуальної терапевтичної дози при титруванні препарату.
Пероральний прийом домперидону (10–20 мг 3 рази на день) слід почати за один-три дні до терапії апоморфіном.
У даний час Penject (періодична ін’єкція) і портативна помпа (безперервна інфузія) схвалені в більшості європейських країн, де їх застосуванню надають великого значення в лікуванні хвороби Паркінсона з підтвердженням добрих результатів [114–116]. Hughes et al. опублікували дослідження 71 пацієнта, який одержував періодичні ін’єкції (10 ін’єкцій на день) або безперервні інфузії апоморфіном, коли було потрібно понад 10 ін’єкцій [133].
У 49 пацієнтів, які отримували періодичні ін’єкції, спостерігалася 50% скорочення періоду «виключення». Через рік лікування 80 % пацієнтів повідомили, що лікування апоморфіном все ще було ефективним.
Періодичну інфузію апоморфіну (Penject) виконували за допомогою інсулінового шприца, вмонтованого в інжектор-ручку з попередньо визначеними дозами для простоти введення [132]. Місцями ін’єкцій можуть бути передня черевна стінка, руки і стегна.
Основні правила для початку первинного титрування дози апоморфіну:
1. Попередня премедикація домперидоном (10–
20 мг тричі/день, розпочата за один-три дні до терапії апоморфіном);
2. Інфузія може виконуватись, якщо пацієнт не приймав дофамінові препарати протягом 12–24 годин. Леводопу слід відмінити за ніч перед тестом.
3. Перед тестом необхідно вимірювати артеріальний тиск у положенні лежачи й сидячи.
4. Починати титрування дози слід з уведення з 1–1,5 мг апоморфіну підшкірно.
Записувати оцінку UPDRS III (до і після введення апоморфіну — «включ.», «виключ.») і будь-які побічні ефекти (нудота, ортостатична гіпотензія, сонливість і дискінезії).
5. Повторювати прийом апоморфіну з інтервалом в 1 до 1,5 години, збільшуючи дозу на 1 мг до доброго або прийнятного клінічного ефекту.
Протягом години можна використовувати не більше 7–8 мг апоморфіну, 10 мг на ін’єкцію. Розчин апоморфіну поставляється в концентрації 1 мг/0,1 мл у 3 мл (30 мг) у скляних картриджах з ручним багаторазовим багатодозовим інжектором-ручкою, що вивільняє дози від 0,02 мл до 1 мл (10 мг). Щоб мінімізувати помилки в оцінках ефективності, дозу апоморфіну слід призначати в мілілітрах (а не міліграмах) за допомогою ручки-інжектора. Оптимальна терапевтична доза препарату становить 0,3 мл і 0,5 мл або 3 мг і 5 мг. Після того, як один раз визначено оптимальну дозу, її рідко потрібно коригувати. Період напіввиведення апоморфіну становить 45 хв, а мінімальний рекомендований час між ін’єкціями — 60 хв.
При підшкірному введенні препарат швидко всмоктується, досягнення максимального рівня в сироватці відбувається через 20 хв, а клінічний ефект спостерігається через 5–15 хв після введення. Апоморфін зазвичай призначається на короткий період часу. Середня добова доза становить 3–30 мг/добу і передбачає обрану дозу, яка необхідна для купірування періоду «виключення». Періодична інфузія апоморфіну є доброю невідкладною терапією у випадках моторних флуктуацій, таких як «вкорочення разової дози леводопи» і коливання періодів «включення-виключення», у результаті швидкого початку дії препарату. За необхідності апоморфін слід використовувати як лікарський засіб екстреної допомоги в періоди «виключення» без зміни режиму прийому леводопи. Препарат може повністю змінити передбачувані й непередбачувані періоди «виключання», він пролонгує період «включення» й допомагає при ранковій або нічній акінезії, при болісних дистоніях і є доречним вибором, коли абсорбція пероральної леводопи утруднена через затримку випорожнення шлунка.
Апоморфін також може покращити психіатричні симптоми, такі як депресія і панічні атаки. Деякі хірургічні центри використовують апоморфін, що вводиться Penject, як лікарський засіб невідкладної допомоги в пацієнтів до операції, коли пероральні препарати не можуть бути прийняті.
Протипоказання до застосування апоморфіну:
1) гемолітична анемія;
2) зміни ЕКГ (подовження інтервалу QT, фібриляція передсердь, тахікардія, брадіаритмії, передчасні скорочення шлуночків);
3) використання антикоагулянтів;
4) діабет та інші захворювання, що перешкоджають загоєнню хірургічних ран;
5) целюліт та інші місцеві інфекції;
6) підвищена чутливість до апоморфіну або компонентів розчину, таких як метабісульфіт натрію;
7) тяжкі психічні симптоми.
Побічні ефекти
Найбільш частий довгостроковий побічний ефект, що виникає при використанні ін’єкцій апоморфіну, — вузлики в місці ін’єкції в 70 % людей [134].
У деяких пацієнтів можуть з’явитися свербіж, синці або біль. Ці місцеві побічні ефекти пов’язані з концентрацією препарату, часом інфузії або глибиною ін’єкції. У деяких пацієнтів (10–20 %) реакції можуть бути більш вираженими — у вигляді некротичних вузлових виразок. Цю проблему можна вирішити, щоденно змінюючи місце ін’єкції, забезпечуючи асептику, застосовуючи силіконові гелеві пластирі, або, в деяких випадках, може знадобитися застосування лікування ультразвуком [103].
Періодично рекомендується проводити гематологічні тести для уникнення ризику гемолітичної анемії [107].
ЕКГ-зміни у вигляді подовження інтервалу QT можуть виникати при дозах 6 мг і більше. Профілактичного лікування антагоністами дофаміну (наприклад, метоклопрамідом) і антагоністами рецепторів серотоніну (наприклад, гранісетроном і ондансетроном) слід уникати, тому що, проникаючи через гематоенцефалічний бар’єр, препарати можуть взаємодіяти з апоморфіном.
Дози понад 6 мг не мають додаткових переваг, тому не рекомендуються [107].
Традиційне лікування пероральними препаратами порівняно з апоморфіном
Показано, що якість клінічної відповіді на перораль-ний прийом леводопи подібна якості відповіді на апоморфін [103]. Однак апоморфін, викликаючи більш коротку й швидку рухову відповідь, підтверджує думку про те, що цілісність постсинаптичних рецепторів є ключовим фактором, що визначає дофамінову відповідь при лікуванні хвороби Паркінсона. Іншими словами, клінічні реакції на ліки можуть бути подібними, усі вони мають різні механізми дії [103, 105]. Так, апоморфін має певні переваги перед леводопою. У першу чергу це спосіб призначення препарату у вигляді монотерапії, що здатна збільшувати тривалість періоду «включення» леводопи і тим самим підтримувати безперервну дофамінову стимуляцію. Не менш важливо при цьому, що в пацієнта відбувається зниження потреби в леводопі, що, у свою чергу, призводить до зменшення дискінезій і моторних флуктуацій [102, 106].
Більше того, при парентеральному введенні апоморфін покращує прихильність до лікування в пацієнтів, які не переносять пероральні ліки або в яких їх абсорбція не стійка. З іншого боку, для роботи з помпою потрібна допомога родичів або опікунів. Крім того, апоморфін швидко проникає через гематоенцефалічний бар’єр незалежно від активної транспортної системи, не конкуруючи з білками й кровообігом [104].
Порівняння апоморфіну з пероральною формою леводопи
Як обговорювалося вище, апоморфін є єдиним комерційно доступним агоністом дофаміну, який, як і леводопа, стимулює D1- і D2-подібні рецептори. Профіль цих рецепторів і є причиною того, що апоморфін, але не інші агоністи дофаміну здатний викликати реакцію, аналогічну такій при застосуванні леводопи. У більш ранньому дослідженні Kempster et al. порівнювалася величина й характер рухових відповідей на одноразові дози підшкірно введеного апоморфіну й перорального прийому леводопи в 14 пацієнтів із ХП.
Показано, що, хоча апоморфін працював набагато коротше й швидше, ніж леводопа, якість клінічної відповіді на обидва препарати практично не відрізнялась [83]. У багатьох клінічних дослідженнях, описаних вище, оптимальна доза апоморфіну визначалася як така, яка забезпечує не менше за 90 % видимої відповіді за шкалою UPDRS порівняно з леводопою. У дослідженні AP0202, виконаному в США, «подібний до леводопи» ефект додатково підтверджувався аналогічним збільшенням швидкості tapping-тесту при пальцьовій пробі (відношення 236 натискань у період «виключення» до 374 натискань у період «включення» при застосуванні апоморфіну і 356 натискань у стані «включення» при застосуванні леводопи). Відзначено також скорочення часу кроків при проведенні секундного тесту Вебстера (зменшення з 431 с у «виключеному» стані до 128 с у «включеному» стані з апоморфіном і 124 с у «включеному» стані з леводопою [39].
Також важливо відзначити, що апоморфін діє швидше, ніж леводопа, навіть коли леводопа вводиться в диспергованій формі. Встановлено, що серед усіх наявних протипаркінсонічних препаратів апоморфін викликає найбільш швидке полегшення симптомів періоду «виключення» в пацієнтів із ХП з моторними флуктуаціями. Так, в одному з небагатьох прямих досліджень Merello et al. проаналізували затримку й тривалість дії ін’єкцій апоморфіну порівняно з диспергованою формою леводопи/бенсеразиду. У цьому невеликому, але рандомізованому сліпому дослідженні 12 пацієнтів із сильно флуктуючими симптомами отримували одноразову дозу апоморфіну або дисперговану форму леводопи 2 дні поспіль. Дослідження показало, що амплітуда відповідей була однаковою для обох препаратів (з використанням модифікованого тесту Webster), але апоморфін швидше нівелював періоди «виключення» (латентність ефекту 8,08 хв для апоморфіну проти 26,8 хв для диспергованої леводопи).
Феномен моторних флуктуацій як ускладнення багаторічної леводопа-терапії у хворих на ХП є справжнім викликом, що спонукає до розробки нових засобів корекції цього тяжкого клінічного симптому. У минулому використання пролонгованих форм агоністів, таких як перголід або бромокриптин у комбінації з леводопою, давало істотну можливість впливу на тривалість періоду «виключення», але, на жаль, покращання дофамінової стимуляції в цих випадках поєднувалося з виникненням побічних ефектів, таких як дискінезії або галюцинації, що призвело до значного обмеження використання цих засобів.
Перспективним підходом до курації пацієнтів з моторними флуктуаціями у вигляді періодів «включення-виключення» варто визнати ранній початок лікування цього феномена. У цьому подвійному сліпому дослідженні апоморфін показав себе як найбільш швидкодіючий препарат порівняно зі швидкорозчинним препаратом леводопи. Навіть якщо для деяких пацієнтів ін’єкції апоморфіну були проблемними й потребували супроводу спеціально навченого лікаря, швидкий початок дії апоморфіну, згідно з цим дослідженням, робив його препаратом вибору для усунення періодів тяжких станів «виключення» [134].
Дані експериментів на тваринах показують, що апоморфін дає антипаркінсонічний ефект шляхом прямої взаємодії з постсинаптичними дофаміновими рецепторами смугастого тіла. Введення апоморфіну фактично пригнічує пульсуючу (переривчасту) стимуляцію рецепторів і, імовірно, синаптичний викид дофаміну нейронами нігростріарного тіла шляхом стимуляції пресинаптичних дофамінових рецепторів. Еквівалентність клінічної відповіді на апоморфін і леводопу суперечить уявленню про принципово інший механізм дії леводопи, який зазвичай пов’язують з фізіологічним відновленням синаптичної дофамінергічної нейротрансмісії шляхом збереження нігростріарних терміналей. Якби це було правдою, то можна було б припустити, що відмінності в ступені відповіді на дію обох агентів будуть виявлятися, особливо в пацієнтів на просунутих стадіях хвороби, що буде клінічно відображати й більш виражену втрату нігральних дофамінергічних нейронів. Отримані результати можуть бути порівняні з гіпотезою E. Melаmed про нефізіологічну дію леводопи [119]. Автор припустив, що екзогенна леводопа може піддаватися біотрансформації в дофамін на різних локусах смугастого тіла, проникаючи в позаклітинний простір і взаємодіючи з постсинаптичними дофаміновими рецепторами в обхід пресинаптичної активності дегенерованих нігростріарних терміналей. Наслідком цієї концепції може бути положення про те, що леводопа й агоніст дофамінових рецепторів апоморфін мають схожу фармакодинаміку в смугастому тілі, і клінічно це проявляється в рівнозначному покращанні рухового образу пацієнта. У той час як рівень втрати нігральних клітин і, отже, ендогенна недостатність дофаміну в смугастому тілі з найбільшою ймовірністю визначають тяжкість періоду «виключення», період «включення, як клінічна вираженість ступеня компенсації рухових порушень залежить від чутливості постсинаптичних дофамінових рецепторів смугастого тіла, що є основою для збереження основних недофамінергічних компонентів екстрапірамідної рухової системи.
Апоморфін і немоторні симптоми
Хоча оцінка ефективності апоморфіну в лікуванні моторних симптомів ХП була в центрі уваги в більшості досліджень, закономірно продовжує поставати питання про можливість впливу препарату й на немоторні аспекти хвороби. Відомо, що немоторні симптоми мають > 90 % пацієнтів із ХП, що впливає на багато факторів, які визначають якість їхнього життя. Спектр немотор-них симптомів широкий і включає психоневрологічні симптоми, порушення сну, біль, когнітивні порушення, слабоумство, депресію тощо. Пацієнти з ХП мають в середньому 8,3 немоторного симптому за час хвороби [120]. Деякі автори, зосередивши свою увагу на впливі апоморфіну на нейропсихіатричні симптоми, стверджують, що апоморфін добре переноситься пацієнтами з параноїдальними ідеями й зоровими галюцинаціями [121, 122]. Було висловлено припущення, що гіпотетичний антипсихотичний ефект апоморфіну може бути пов’язаний з його структурним піперидиновим фрагментом, який також є частиною декількох антипсихотичних молекул. Показано також, що порівняно з іншими агоністами дофаміну позитивний ефект лікування апоморфіном, мабуть, пов’язаний з меншим ризиком виникнення порушень контролю над імпульсами [123, 124]. З іншого боку, активацію рецепторів D3 пероральними агоністами дофаміну пов’язують з можливістю появи індукції імпульсивно-компульсивних розладів при ХП [125].
Проведене недавно експериментальне дослідження показало, що ін’єкції апоморфіну знижували експресію інтраневрального білка β-амілоїду і сприяли покращанню короткочасної пам’яті на мишачої моделі хвороби Альцгеймера [126]. Ґрунтуючись на цих результатах, у недавньому ретроспективному клініко-нейровізуалізаційному дослідженні вивчали недементних пацієнтів з ХП, які постійно приймали апоморфін, порівняно з контрольною групою. При аналізі зображень позитронно-емісійної томографії встановлено зниження рівня білка β-амілоїду серед суб’єктів, які отримували апоморфін, а це дає підстави для припущення про те, що препарат може застосовуватись для зменшення когнітивних порушень при ХП [127].
Отже, дані про ефективність апоморфіну при немоторних симптомах вказують на можливу користь при порушеннях сну, психоневрологічних симптомах, дисфункції сечовивідних шляхів, можливий вплив на настрій і шлунково-кишкові симптоми внаслідок скорочення часу «виключення» у пацієнтів з вираженою стадією ХП.
Висновки
Слід вважати, що ХП є клінічним відображенням нейромедіаторного дисбалансу в центральній нервовій системі, а апоморфін, що має багато фармакологічних ефектів, які лежать в основі мультимодальної дії на декілька цих систем, буде мати позитивну оцінку, крім інших препаратів, що діють на певні підтипи дофамінових рецепторів. В цьому аспекті фармакодинамічні ефекти апоморфіну значно відрізняються, і апоморфін не варто розглядати тільки як «простий» агоніст дофаміну. Апоморфін — це єдиний доступний у даний час препарат, що дає такий же протипаркінсонічний ефект, як у леводопи. Апоморфін має найшвидший початок дії порівняно з усіма використовуваними в даний час антипаркінсонічними препаратами. Спосіб застосування апоморфіну має важливе значення для обґрунтування двох дуже різних терапевтичних підходів до застосування препарату при ХП. Уведений у вигляді підшкірної ін’єкції, препарат надійно й швидко позбавляє пацієнта періодів «виключення» і забезпечує пацієнтам з тяжкими моторними флуктуаціями кращий контроль і незалежність в рухах, адекватну повсякденну активність і гідну якість життя.
Отримано/Received 04.04.2021
Рецензовано/Revised 18.04.2021
Прийнято до друку/Accepted 26.04.2021
Список литературы
Вступ з елементами історичного огляду
1. Colosimo C., De Michele M. Motor fluctuations in Parkinson’s disease: pathophysiology and treatment. Eur. J. Neurol. 1999. 6. 1-21.
2. Olanow C.W., Gracies J.M., Goetz C.G. et al. Clinical pattern and risk factors for dyskinesias following fetal nigral transplantation in Parkinson’s disease: a double blind video-based analysis. Mov. Disord. 2009. 24(3). 336-434.
3. Witjas T., Kaphan E., Azulay J.P. et al. Nonmotor fluctuations in Parkinson’s disease: frequent and disabling. Neurology. 2002. 59(3). 408-13.
4. Obeso J.A., Rodriguez-Oroz M., Marin C. et al. The origin of motor fluctuations in Parkinson’s disease: importance of dopaminergic innervation and basal ganglia circuits. Neurology. 2004. 62 (1 Suppl. 1). S17-30.
5. Jenner P. From the MPTP-treated primate to the treatment of motor complications in Parkinson’s disease. Parkinsonism Relat .Disord. 2009. 15 (Suppl. 4). S18-23.
6. Brotchie J.M. Nondopaminergic mechanisms in levodopa-induced dyskinesia. Mov. Disord. 2005. 20(8). 919-31.
7. Kurlan R., Rothfield K.P., Woodward W.R. et al. Erratic gastric emptying of levodopa may cause “random” fluctuations of parkinsonian mobility. Neurology. 1988. 38(3). 419-21.
8. Nyholm D., Askmark H., Gomes-Trolin C. et al. Optimizing levodopa pharmacokinetics: intestinal infusion versus oral sustained-release tablets. Clin. Neuropharmacol. 2003. 26(3). 156-63.
9. Jenner P. Dopamine agonists in Parkinson’s disease — focus on non-motor symptoms. Eur. J. Neurol. 2008. 15 (Suppl. 2). 1.
10. Stocchi F., Nordera G., Marsden C.D. Strategies for tre-ating patients with advanced Parkinson’s disease with disastrous fluctuations and dyskinesias. Clin. Neuropharmacol. 1997. 20(2). 95-115.
11. Stocchi F., Ruggieri S., Vacca L., Olanow C.W. Prospective randomized trial of lisuride infusion versus oral levodopa in patients with Parkinson’s disease. Brain. 2002. 125 (Pt 9). 2058-66.
12. Lees A.J. Dopamine agonists in Parkinson’s disease: a look at apomorphine. Fundam. Clin. Pharmacol. 1993. 7. 121-128.
13. Ernst A.M. Relation between the action of dopamine and apomorphine and their O-methylated derivatives upon the CNS. Psychopharmacologia. 1965. 7. 391-399.
14. Colosimo С., Merello M., Albanese А. Clinical usefulness of apomorphine in movement disorders. Clin. Neuropharmacol. 1994. 17. 243-259.
15. Corsini G.U., Del Zompo М., Gessa G.L., Mangoni А. Therapeutic efficacy of apomorphine combined with an extracerebral inhibitor of dopamine receptors in Parkinson’s disease. Lancet. 1979. 1. 954-956.
16. Stibe C., Lees A., Stern G. Subcutaneous infusion of apomorphine and lisuride in the treatment of parkinsonian on-off fluctuations. Lancet . 1987. 1. 871.
17. Stibe C.M., Lees A.J., Kempster P.A., Stern G.M. Subcutaneous apomorphine in parkinsonian on-off oscillations. Lancet. 1988. 1. 403-406.
18. Hughes A.J., Bishop S., Stern G.M., Lees A.J. The motor response to repeated apomorphine administration in Parkinson’s disease. Clin. Neuropharmacol. 1991. 14. 209-213.
19. Hughes A.J., Lees A.J., Stern G.M. The motor response to sequential apomorphine in parkinsonian fluctuations. J. Neurol. Neurosurg. Psychiatry. 1991. 54. 358-360.
20. Poewe W., Wenning G.K. Apomorphine: an underutilized therapy for Parkinson’s disease, Mov. Disord. 2000. 15. 789-794.
21. Poewe W., Lees A., Chaudhuri K.R., Isaacson S. New perspectives in non-oral drug delivery in Parkinson’s disease, Eur. Neurol. Rev. 2014. 9. 31-36.
22. Martinez-Martin Р., Reddy Р., Antonini А., Henriksen Т., Katzenschlager R., Odin Р., Todorova A., Naidu Y., Tluk S., Chandiramani С., Martin А., Chaudhuri K.R. Chronic subcutaneous infusion therapy with apomorphine in advanced Parkinson’s disease compared to conventional therapy: a real life study of non motor effect. J. Park. Dis. 2011. 1. 197-203.
23. Frankel J.P., Lees A.J., Kempster P.A., Stern G.M. Subcutaneous apomorphine in the treatment of Parkinson’s disease. J. Neurol. Neurosurg. Psychiatry. 1990 Feb. 53(2). 96-101. https://doi.org/10.1136/jnnp.53.2.96.
24. Hilker R., Antonini A., Odin P. What is the best treatment for fluctuating Parkinson’s disease: continuous drug delivery or deep brain stimulation of the subthalamic nucleus? J. Neural. Transm. (Vienna). 2011 Jun. 118(6). 907-14. https://doi.org/10.1007/s00702-010-0555-8.
25. Hardie R.J., Lees A.J., Stern G.M. On-off fluctuations in Parkinson’s disease: a clinical and neuropharmacological study. Brain. 1984 Jun. 107 (Pt 2). 487-506. https://doi.org/10.1093/brain/107.2.487.
26. Wenzel K., Homann C.N., Fabbrini G., Colosimo C. The role of subcutaneous infusion of apomorphine in Parkinson’s disease. Expert Rev. Neurother. 2014 Jul. 14(7). 833-43. https://doi.org/10.1586/14737175.2014.928202.
27. Cotzias G.C., Papavasiliou P.S., Fehling C., Kaufman B., Mena I. Similarities between neurologic effects of L-dopa and of apomorphine. N. Engl. J. Med. 1970 Jan. 282(1). 31-3. https://doi.org/10.1056/NEJM197001012820107.
28. Schwab R.S., Amador L.V., Lettvin J.Y. Apomorphine in Parkinson’s disease. Trans. Am. Neurol. Assoc. 1951. 56. 251-3.
29. Henriksen T. Clinical insights into use of apomorphine in Parkinson’s disease: tools for clinicians. Neurodegener Dis. Manag. 2014. 4(3). 271-82. https://doi.org/10.2217/nmt.14.17.
30. Kleedorfer B., Turjanski N., Ryan R., Lees A.J., Milroy C., Stern G.M. Intranasal apomorphine in Parkinson’s dise-ase. Neurology. 1991 May. 41(5). 761-2. https://doi.org/10.1212/WNL.41.5.761-a.
31. Hughes A.J., Webster R., Bovingdon M., Lees A.J., Stern G.M. Sublingual apomorphine in the treatment of Parkinson’s disease complicated by motor fluctuations. Clin. Neuropharmacol. 1991 Dec. 14(6). 556-61. https://doi.org/10.1097/00002826-199112000-00008.
32. Manson A.J., Hanagasi H., Turner K., Patsalos P.N., Carey P., Ratnaraj N. et al. Intravenous apomorphine therapy in Parkinson’s dise-ase: clinical and pharmacokinetic observations. Brain. 2001 Feb. 124 (Pt 2). 331-40. https://doi.org/10.1093/brain/124.2.331.
33. Menon R., Stacy M. Apomorphine in the treatment of Parkinson’s disease. Expert Opin Pharmacother. 2007 Aug. 8(12). 1941-50. https://doi.org/10.1517/14656566.8.12.1941.
Фармакологія і механізм дії апоморфіну
34. Millan M.J., Maiofiss L., Cussac D., Audinot V., Boutin J.A., Newman-Tancredi A. Differential actions of antiparkinson agents at multiple classes of monoaminergic receptor. I. A multivariate analysis of the binding profiles of 14 drugs at 21 native and cloned human receptor subtypes. J. Pharmacol. Exp. Ther. 2002. 303. 791-804.
35. Dankova J., Bedard P., Langelier P., Poirier L.J. Dopaminergic agents and circling behavior. Gen. Pharmacol. 1978. 9. 295-302.
36. Newman-Tancredi A., Cussac D., Audinot V., Nicolas J.P., De Ceuninck F., Boutin J.A., Millan M.J. Differential actions of antiparkinson agents at multiple classes of monoaminergic receptor. II. Agonist and antagonist properties at subtypes of dopamine D(2)-like receptor and alpha(1)/alpha(2)-adrenoceptor. J. Pharmacol. Exp. Ther. 2002. 303. 805-814.
37. Antonini A., Tolosa Е., Mizuno Y., Yamamoto M., Poewe W.H. A reassessment of risks and benefits of dopamine agonists in Parkinson’s disease. Lancet Neurol. 2009. 8. 929-937.
38. Feyder M., Bonito-Oliva A., Fisone G. L-DOPA-Induced Dyskinesia and Abnormal Signaling n striatal medium spiny neurons: focus on dopamine D1 receptor-mediated transmission. Front. Behav. Neurosci. 2011. 5. 71.
39. Guigoni C., Bezard E. Involvement of canonical and non-canonical D1 dopamine receptor signalling pathways in L-dopa-induced dyskinesia. Park. Relat. Disord. 2009. 3 (15 Suppl.) S64-S67.
40. Mailman R., Huang X., Nichols D.E. Parkinson’s disease and D1 dopamine receptors. Curr. Opin. Investig. Drugs. 2001. 2. 1582-1591.
41. Blanchet P.J., Fang J., Gillespie M., Sabounjian L., Locke K.W., Gammans R., Mouradian M.M., Chase T.N. Effects of the full dopamine D1 receptor agonist dihydrexidine in Parkinson’s disease, Clin. Neuropharmacol. 1998. 21. 339-343.
42. Yoshimura N., Mizuta E., Kuno S., Sasa M., Yoshida O. The dopamine D1 receptor agonist SKF 38393 suppresses detrusor hyperreflexia in the monkey with parkinsonism induced by 1-methyl-4-phenyl-1,2,3,6- tetrahydropyridine (MPTP). Neuropharmacology. 1993. 32. 315-321.
43. Andersson K.E. Treatment of overactive bladder: other drug mechanisms. Urology. 2000. 55. 51-57.
44. Seeman P. Parkinson’s disease treatment may cause impulse-control disorder via dopamine D3 receptors. Synapse. 2015. 69. 183-189.
45. Horowski R., Jahnichen S., Pertz H.H. Fibrotic valvular heart disease is not related to chemical class but to biological function: 5-HT2B receptor activation plays crucial role. Mov. Disord. 2004. 19. 1523-1524.
46. Antonini A., Poewe W. Fibrotic heart-valve reactions to dopamine-agonist treatment in Parkinson’s diseas. Lancet Neurol. 2007. 6. 826-829.
47. Andersohn F., Garbe E. Cardiac and noncardiac fibrotic reactions caused by ergot-and nonergot-derived dopamine agonists. Mov. Disord. 2009. 24. 129-133.
48. Geerligs L., Meppelink A.M., Brouwer W.H., van Laar Т. The effects of apomorphine on visual perception in patients with Parkinson disease and visual hallucinations: a pilot study. Clin. Neuropharmacol. 2009. 32. 266-268.
49. Borgemeester R.W., Lees A.J., van Laar T. Parkinson’s dise-ase, visual hallucinations and apomorphine: a review of the available evidence. Park. Relat. Disord. 2016. 27. 35-40.
50. Sharma J.C., Macnamara L., Hasoon M., Vassallo M. Diagnostic and therapeutic value of apomorphine in Parkinsonian patients. Int. J. Clin. Pract. 2004. 58. 1028-1032.
51. Hughes A.J., Lees A.J., Stern G.M. The motor response to sequential apomorphine in parkinsonian fluctuations. J. Neurol. Neurosurg. Psychiatry. 1991. 54. 358-360.
52. O’Sullivan J.D., Lees A.J. Use of apomorphine in Parkinson’s disease. Hosp. Med. 1999 Nov. 60(11). 816-20. https://doi.org/10.12968/hosp.1999.60.11.1236.
53. Frankel J.P., Lees A.J., Kempster P.A., Stern G.M. Subcutaneous apomorphine in the treatment of Parkinson’s disease. J. Neurol. Neurosurg. Psychiatry. 1990 Feb. 53(2). 96-101. https://doi.org/10.1136/jnnp.53.2.96.
54. Hagell P., Odin P. Apomorphine in Parkinson’s disease. 3rd ed. Bremen: UNI-MED; 2014.
55. Ramirez-Zamora A., Molho E. Treatment of motor fluctuations in Parkinson’s disease: recent developments and future directions. Expert Rev. Neurother. 2014 Jan. 14(1). 93-103. https://doi.org/10.1586/14737175.2014.868306.
56. Obering C.D., Chen J.J., Swope D.M. Update on apomorphine for the rapid treatment of hypomobility (“off”) episodes in Parkinson’s disease. Pharmacotherapy. 2006 Jun. 26(6). 840-52. https://doi.org/10.1592/phco.26.6.840.
57. Lees A.J. Dopamine agonists in Parkinson’s disease: a look at apomorphine. Fundam. Clin. Pharmacol. 1993. 7. 121-128.
58. Henriksen T. Clinical insights into use of apomorphine in Parkinson’s disease: tools for clinicians. Neurodegener Dis. Manag. 2014. 4(3). 271-82. https://doi.org/10.2217/nmt.14.17.
59. Martinez-Martin Р., Reddy Р., Antonini А., Henriksen Т., Katzenschlager R., Odin Р., Todorova A., Naidu Y., Tluk S., Chandiramani С., Martin А., Chaudhuri K.R. Chronic subcutaneous infusion therapy with apomorphine in advanced Parkinson’s disease compared to conventional therapy: a real life study of non motor effect. J. Park. Dis. 2011. 1. 197-203.
60. Menon R., Stacy M. Apomorphine in the treatment of Parkinson’s disease. Expert Opin. Pharmacother. 2007 Aug. 8(12). 1941-50. https://doi.org/10.1517/14656566.8.12.1941.
61. Pfeiffer R.F., Gutmann L., Hull K.L. Jr, Bottini P.B., Sherry J.H. Continued efficacy and safety of subcutaneous apomorphine in patients with advanced Parkinson’s disease. Parkinsonism Relat. Disord. 2007 Mar. 13(2). 93-100. https://doi.org/10.1016/j.parkreldis.2006.06.012.
62. Kempster P.A., Frankel J.P., Stern G.M., Lees A.J. Comparison of motor response to apomorphine and levodopa in Parkinson’s disease. J. Neurol. Neurosurg. Psychiatry. 1990 Nov. 53(11). 1004-7. https://doi.org/10.1136/jnnp.53.11.1004.
63. Colosimo C., Merello M., Hughes A.J., Sieradzan K., Lees A.J. Motor response to acute dopaminergic challenge with apomorphine and levodopa in Parkinson’s disease: implications for the pathogenesis of the on-off phenomenon. J. Neurol. Neurosurg. Psychiatry. 1996 Jun. 60(6). 634-7. https://doi.org/10.1136/jnnp.60.6.634.
Ефективність апоморфіну за даними клінічних досліджень
64. Stibe C.M., Lees A.J., Kempster P.A., Stern G.M. Subcuta-neous apomorphine in parkinsonian on-off oscillations. Lancet. 1988. 1. 403-406.
65. Poewe W., Kleedorfer B., Wagner M., Benke T., Gasser T., Oertel W. Side-effects of subcutaneous apomorphine in Parkinson’s disease. Lancet. 1989. 1. 1084-1085.
66. Odin P. Intermittent subcutaneous apomorphine injection. Odin Р., Hagell Р., Shing М. (Eds.). Apomorphine in Parkinson’s Disease. 3 ed. Bremen: UNIMED Verlag AG, 2005. Р. 35-36.
67. Isaacson S., Lew M., Ondo W., Hubble J., Clinch T., Pagan F. Apomorphine subcutaneous injection for the management of morning akinesia in Parkinson’s disease. Movement Disorders Clinical Practice. 2016. http://dx.doi.org/10.1002/ mdc3.12350.
Ефективність періодичних ін’єкцій апоморфіну
68. Colosimo C., De Michele M. Motor fluctuations in Parkinson’s disease: pathophysiology and treatment. Eur. J. Neurol. 1999. 6. 1-21.
69. Golbe L.I. Young-onset Parkinson’s disease: a clinical review. Neurology. 1991. 41 (2 (Pt 1). 168-73.
70. Olanow C.W., Gracies J.M., Goetz C.G. et al. Clinical pattern and risk factors for dyskinesias following fetal nigral transplantation in Parkinson’s disease: a double blind video-based analysis. Mov. Disord. 2009. 24(3). 336-434.
71. Cotzias G.C., Papavasiliou P.S., Fehling C., Kaufman B., Mena I. Similarities between neurologic effects of L-dopa and of apomorphine. N. Engl. J. Med. 1970 Jan. 282(1). 31-3. https://doi.org/10.1056/NEJM197001012820107.
72. Stibe C.M., Lees A.J., Kempster P.A., Stern G.M. Subcutaneous apomorphine in parkinsonian on-off oscillations. Lancet. 1988. 1. 403-406.
73. Poewe W., Kleedorfer B., Wagner M., Benke T., Gasser T., Oertel W. Side-effects of subcutaneous apomorphine in Parkinson’s disease. Lancet. 1989. 1. 1084-1085.
74. Kempster P.A., Iansek R., Larmour I. Intermittent subcutaneous apomorphine injection treatment for parkinsonian motor oscillations. Aust. NZJ Med. 1991. 21(3). 314-18.
75. Hughes A.J., Bishop S., Kleedorfer B. et al. Subcutaneous apomorphine in Parkinson’s disease: response to chronic administration for up to five years. Mov. Disord 1993. 8(2). 165-70.
76. Merello M., Leiguarda R. Treatment of motor fluctuations in Parkinson’s disease with subcutaneous injections of apomorphine. Medicina (B Aires). 1995. 55(1). 5-10.
77. Ostergaard L., Werdelin L., Odin P. et al. Pen injected apomorphine against off phenomena in late Parkinson’s disease: a double blind, placebo controlled study. J. Neurol. Neurosurg. Psychiatry. 1995. 58(6). 681-7.
78. Munoz J.E., Marti M.J., Marin C., Tolosa E. Long-term treatment with intermitent intr.anasal or subcutaneous apormorphine in patients with levodopa-related motor fluctuations. Clin. Neuropharmacol. 1997. 20(3). 245-52.
79. Pietz K., Hagell P., Odin P. Subcutaneous apomorphine in late stage Parkinson’s disease: a long term follow up. J. Neurol. Neurosurg. Psychiatry. 1998. 65(5). 709-16.
80. Dewey R.B. Jr, Hutton J.T., LeWitt P.A., Factor S.A. A randomized, double-blind, placebo-controlled trial of subcutaneously injected apomorphine for parkinsonian off-state events. Arch. Neurol. 2001. 58(9). 1385-92.
81. Fahn S., Elton R. UPDRS program members. Unified Parkinson’s Disease Rating Scale. Recent developments in Parkinsons disease. Fahn S., Marsden C.D., Goldstein M., Calne D.B., editors. Macmillan Healthcare Information. Florham Park, NJ, USA, 1987. 153-63.
82. Pfeiffer R.F., Gutmann L., Hull K.L. Jr, Bottini P.B., Sherry J.H. Continued efficacy and safety of subcutaneous apomorphine in patients with advanced Parkinson’s disease. Parkinsonism Relat. Disord. 2007 Mar. 13(2). 93-100. https://doi.org/10.1016/j.parkreldis.2006.06.012.
83. Stacy M. Apomorphine: North American clinical experience. Neurology. 2004. 62 (6 Suppl. 4). S18-21.
84. Pahwa R., Koller W.C., Trosch R.M. et al. Subcutaneous apomorphine in patients with advanced Parkinson’s disease: a dose-escalation study with randomized, double-blind, placebo-controlled crossover evaluation of a single dose. J. Neurol. Sci. 2007. 258 (1–2). 137-43.
85. Trosch R.M., Silver D., Bottini P.B. Intermittent subcutaneous apomorphine therapy for ‘off’ episodes in Parkinson’s disease: a 6-month open-label study. CNS Drugs. 2008. 22(6). 519-27.
86. Isaacson S.H., Chaudhuri K.R. Morning akinesia and the potential role of gastroparesis — managing delayed onset of first daily dose of oral levodopa in patients with Parkinson’s disease. Eur. Neurol. Rev. 2013. 8(2). 82-4.
87. Katzenschlager R., Poewe W., Rascol О. et al. Apomorphine subcutaneous infusion in patients with Parkinson’s disease with persistent motor fluctuations (TOLEDO): a multicentre, double-blind, randomised, placebo-controlled trial. Published online July 25, 2018. http://dx.doi.org/10.1016/S1474-4422(18)30239-4.
88. Nyholm D., Lennernas H. Irregular gastrointestinal drug absorption in Parkinson’s disease. Expert Opin. Drug Metab. Toxicol. 2008. 4. 193-203.
89. Pahwa R., Lyons K.E., eds. Handbook of Parkinson’s Disease. 5th ed. Boca Raton, FL: CRC Press; 2013.
90. Rizos A., Martinez-Martin P., Odin P. et al. Characterizing motor and non-motor aspects of early-morning off periods in Parkinson’s disease: an international multicenter study. Parkinsonism Relat. Disord. 2014. 20. 1231-123.
91. Hauser R.A., Isaacson S., Clinch T. The Tigan/Apokyn Study: randomized, placebo-controlled trial of trimethobenzamide to control nausea and vomiting during initiation and continued treatment with subcutaneous apomorphine injection. Parkinsonism Relat. Disord. 2014. 20. 1171-1176.
92. Goetz C.G., Tilley B.C., Shaftman S.R. et al. Movement Di-sorder Society-sponsored revision of the Unified Parkinson’s Disease Rating Scale (MDS-UPDRS): scale presentation and clinimetric tes-ting results. Mov. Disord. 2008. 23. 2129-70.
93. Schlachetzki J.C.M., Barth J., Marxreiter F. et al. Wearable sensors objectively measure gait parameters in Parkinson’s disease. PLoS One 12. 2017. e0183989-e0183918. https://doi.org/10.1371/ journal.pone.0183989.
Апоморфін у лікуванні хвороби Паркінсона
94. Gancher S.T., Bennett W., English J. Studies of renal function in animals chronically treated with apomorphine. Res. Commun. Chem. Pathol. Pharmacol. 1989. 66. 163-166.
95. LeWitt P.A. Subcutaneously administered apomorphine: pharmacokinetics and metabolism. Neurology. 2004. 62. S8-S11.
96. van Laar T., Jansen E.N., Essink A.W., Neef C., Oosterloo S., Roos R.A. A doubleblind study of the efficacy of apomorphine and its assessment in “off”-periods in Parkinson’s disease. Clin. Neurol. Neurosurg. 1993. 95. 231-235.
97. Ostergaard L., Werdelin L., Odin P. et al. Pen injected apomorphine against off phenomena in late Parkinson’s disease: a double blind, placebo controlled study. J. Neurol. Neurosurg. Psychiatry. 1995. 58(6). 681-687.
98. Dewey R.B. Jr, Hutton J.T., LeWitt P.A., Factor S.A. A randomized, double-blind, placebo-controlled trial of subcutaneously injected apomorphine for parkinsonian off-state events. Arch. Neurol. 2001. 58(9). 1385-92.
99. Pfeiffer R.F., Gutmann L., Hull K.L. Jr, Bottini P.B., Sherry J.H. Continued efficacy and safety of subcutaneous apomorphine in patients with advanced Parkinson’s disease. Parkinsonism Relat. Disord. 2007 Mar. 13(2). 93-100. https://doi.org/10.1016/j.parkreldis.2006.06.012.
100. Pahwa R., Koller W.C., Trosch R.M. et al. Subcutaneous apomorphine in patients with advanced Parkinson’s disease: a dose-escalation study with randomized, double-blind, placebo-controlled crossover evaluation of a single dose. J. Neurol. Sci. 2007. 258 (1–2). 137-43.
Коли потрібно припиняти або замінювати терапію апо-морфіном?
101. Poltawski L., Edwards H., Todd A., Watson T., Lees A., James C.A. Ultrasound treatment of cutaneous side-effects of infused apomorphine: a randomized controlled pilot study. Mov. Disord. 2009. 24. 115-118.
Показання для використання апоморфіну
102. Hughes A.J., Lees A.J., Stern G.M. The motor response to sequential apomorphine in parkinsonian fluctuations. J. Neurol. Neurosurg. Psychiatry. 1991. 54. 358-360. https://doi.org/10.1136/jnnp.54.4.358.
103. Hagell P., Odin P. Apomorphine in Parkinson’s disease. 3rd ed. Bremen: UNI-MED; 2014.
104. Hughes A.J., Lees A.J., Stern G.M. Apomorphine test to predict dopaminergic responsiveness in parkinsonian syndromes. Lancet. 1990 Jul. 336(8706). 32-4. https://doi.org/10.1016/0140-6736(90)91531-E.
105. Hughes A.J., Lees A.J., Stern G.M. Apomorphine in the diagnosis and treatment of parkinsonian tremor. Clin. Neuropharmacol. 1990 Aug. 13(4). 312-7. https://doi.org/10.1097/00002826-199008000-00005.
Шляхи введення апоморфіну
106. Frankel J.P., Lees A.J., Kempster P.A., Stern G.M. Subcutaneous apomorphine in the treatment of Parkinson’s disease. J. Neurol. Neurosurg. Psychiatry. 1990 Feb. 53(2). 96-101. https://doi.org/10.1136/jnnp.53.2.96.
107. Djamshidian A., Poewe W. Apomorphine and levodopa in Parkinson’s disease: two revolutionary drugs from the 1950’s. Parkinsonism Relat Disord. 2016 Dec. 33 Suppl. 1. S9-12. https://doi.org/10.1016/j.parkreldis.2016.12.004.
108. Henriksen T. Clinical insights into use of apomorphine in Parkinson’s disease: tools for clinicians. Neurodegener. Dis. Manag. 2014. 4(3). 271-82. https://doi.org/10.2217/nmt.14.17.
109. Hughes A.J., Bishop S., Lees A.J., Stern G.M., Webster R., Bovingdon M. Rectal apomorphine in Parkinson’s disease. Lancet. 1991 Jan. 337(8733). 118. https://doi.org/10.1016/0140-6736(91)90780-S.
110. Kleedorfer B, Turjanski N, Ryan R, Lees AJ, Milroy C, Stern GM. Intranasal apomorphine in Parkinson’s disease. Neurology. 1991 May. 41(5). 761-2. https://doi.org/10.1212/WNL.41.5.761-a.
111. Hughes A.J., Webster R., Bovingdon M., Lees A.J., Stern G.M. Sublingual apomorphine in the treatment of Parkinson’s disease complicated by motor fluctuations. Clin. Neuropharmacol. 1991 Dec. 14(6). 556-61. https://doi.org/10.1097/00002826-199112000-00008.
112. Manson A.J., Hanagasi H., Turner K., Patsalos P.N., Ca-rey P., Ratnaraj N. et al. Intravenous apomorphine therapy in Parkinson’s disease: clinical and pharmacokinetic observations. Brain. 2001 Feb. 124 (Pt 2). 331-40. https://doi.org/10.1093/brain/124.2.331.
113. Obering C.D., Chen J.J., Swope D.M. Update on apomorphine for the rapid treatment of hypomobility (“off”) episodes in Parkinson’s disease. Pharmacotherapy. 2006 Jun. 26(6). 840-52. https://doi.org/10.1592/phco.26.6.840.
114. Hughes A.J., Bishop S., Kleedorfer B., Turjanski N., Fernandez W., Lees A.J. et al. Subcutaneous apomorphine in Parkinson’s disease: response to chronic administration for up to five years. Mov. Disord. 1993 Apr. 8(2). 165-70. https://doi.org/10.1002/mds.870080208.
115. Colosimo C., Merello M., Hughes A.J., Sieradzan K., Lees A.J. Motor response to acute dopaminergic challenge with apomorphine and levodopa in Parkinson’s disease: implications for the pathogenesis of the on-off phenomenon. J. Neurol. Neurosurg. Psychiatry. 1996 Jun. 60(6). 634-7. https://doi.org/10.1136/jnnp.60.6.634.
116. Gunzler S.A. Apomorphine in the treatment of Parkinson disease and other movement disorders. Expert Opin Pharmacother. 2009 Apr. 10(6). 1027-38. https://doi.org/10.1517/14656560902828344.
117. Ondo W.G., Hunter C., Ferrara J.M., Mostile G. Apomorphine injections: predictors of initial common adverse events and long term tolerability. Parkinsonism Relat Disord. 2012 Jun. 18(5). 619-22. https://doi.org/10.1016/j.parkreldis.2012.01.001.
118. Kapoor R., Turjanski N., Frankel J., Kleedorfer B., Lees A., Stern G. et al. Intranasal apomorphine: a new treatment in Parkinson’s disease. J. Neurol. Neurosurg. Psychiatry. 1990 Nov. 53(11). 1015. https://doi.org/10.1136/jnnp.53.11.1015.
119. Melamed E., Offen D., Shirvan A., Ziv I. Levodopa — on exotoxin or a therapeutic drug? J. Neurol. 2000. Vol. 247. Suppl. 2. Р. II. 135-139.
120. Katunina E., Titova N. The Epidemiology of Nonmotor Symptoms in Parkinson’s Disease (Cohort and Other Studies). International review of neurobiology. 2017. Р. 91-110.
121. Borgemeester R.W.K., Lees A.J., van Laar T. Parkinson’s disease, visual hallucinations and apomorphine: a review of the available evidence. Park. Relat. Disord. 2016. 27. 35-40.
122. Rosa-Grilo M., Qamar M.A., Evans A., Chaudhuri K.R. The efcacy of apomorphine — a non-motor perspective. Park. Relat. Di-sord. 2016. 33. S28-35.
123. Moore T.J., Glenmullen J., Mattison D.R. Reports of pathological gambling, hypersexuality, and compulsive shopping associated with dopamine receptor agonist drugs. JAMA Intern. Med. 2014. 174(12). 1930.
124. Barbosa P., Lees A.J., Magee C., Djamshidian A., Warner T.T. A retrospective evaluation of the frequency of impulsive compulsive behaviors in parkinson’s disease patients treated with continuous waking day apomorphine pumps. Mov. Disord. Clin. Pract. 2016. 4(3). 323-8.
125. Samuel M., Rodriguez-Oroz M., Antonini A., Brotchie J., Ray Chaudhuri K., Brown R. et al. Impulse control disorders in Parkinson’s disease: management, controversies, and potential approaches HHS public access. Mov. Disord. 2015. 30(2). 150-9.
126. Himeno E., Ohyagi Y., Ma L., Nakamura N., Miyoshi K., Sakae N. et al. Apomorphine treatment in Alzheimer mice promoting amyloid-β degradation. Ann. Neurol. 2011. 69(2). 248-56.
127. Yarnall A.J., Lashley T., Ling H., Lees A.J., Coleman S.Y., O’Sullivan S.S. et al. Apomorphine: a potential modifer of amyloid deposition in Parkinson’s disease? Mov. Disord. 2016. 31(5). 668-75.
128. Fahn S., Oakes D., Shoulson I. et al. Levodopa and the progression of Parkinson’s disease. N. Engl. J. Med. 2004. 351. 2498-2508.
129. Martinez-Martin P., Reddy P., Katzenschlager R. et al. EuroInf: a multicenter comparative observational study of apomorphine and levodopa infusion in Parkinson’s disease. Mov. Disord. 2015. 30. 510-516.
130. Trenkwalder С., Chaudhuri K.R, Ruiz P.J.G. P.J. et al. Expert Consensus Group report on the use of apomorphine in the treatment of Parkinson’s disease — Clinical practice recommendations. Parkinsonism and Related Disorders. 2015. 1-8.
131. Cotzias G.C., Papavasilliou P.S., Fehling C. et al. Similarities between neurologic effects of L-dopa and of Apomorphine. N. Engl. J. Med. 1970 Jan. 282(1). 31-33.
132. Pessoa R.R., Moro А., Munhoz R.P. Apomorphine in the treatment of Parkinson’s disease: a review. Arq. Neuropsiquiatr. 2018. 76(12). 840-848.
133. Hughes A.J., Lees A.J., Stern G.M. The motor response to sequential apomorphine in parkinsonian fluctuations. J. Neurol. Neurosurg. Psychiatry. 1991 Apr. 54(4). 358-60. https://doi.org/10.1136/jnnp.54.4.358.
134. Kempster P.A., Frankel J.P., Stern G.M. Comparison of motor response to apomorphine and levodopa in Parkinson’s disease. Journal of Neurology, Neurosurgery, and Psychiatry. 1990. 53. 1004-1007.
Базові огляди, що використовувались при підготовці даної публікації
1. Bhidayasiri R., Chaudhuri K.R., LeWitt Р., Martin А., Boonpang K., van Laar Т. Effective Delivery of Apomorphine in the Mana-gement of Parkinson Disease: Practical Considerations for Clinicians and Parkinson Nurses. Clinical Neuropharmacology. May/June 2015. Vol. 38. № 3.
2. Carbone F., Djamshidian A., Seppi K., Poewe W. Apomorphine for Parkinson’s Disease: Efficacy and Safety of Current and New Formulations. Published online: 31 August 2019. CNS Drugs. https://doi.org/10.1007/s40263-019-00661-z.
3. Isaacson S., Lew М., Ondo W., Hubble J., Clinch Т., Pagan F. Apomorphine Subcutaneous Injection for the Management of Mor-ning Akinesia in Parkinson’s Disease. Movement Disorders Clinical Practice published by Wiley Periodicals, Inc. on behalf of the International Parkinson and Movement Disorder Society. 2016. doi:10.1002/mdc3.12350.
4. Jenner Р., Katzenschlager R. Apomorphine — pharmacological properties and clinical trials in Parkinson’s disease. Parkinsonism and Related Disorders. 2016. http://dx.doi.org/10.1016/j.parkreldis.2016.12.003.
5. Katzenschlager R, Poewe W., Rascol O., Trenkwalder C., Deuschl G., Chaudhuri K.R., Henriksen T., van Laar T., Spivey К., Vel S., Staines H., Lees A. Apomorphine subcutaneous infusion in patients with Parkinson’s disease with persistent motor fluctuations (TOLEDO): a multicentre, double-blind, randomised, placebo-controlled trial. Lancet Neurol. 2018. 17. 749-759. Published Online July 25, 2018. http://dx.doi.org/10.1016/ S1474-4422(18)30239-4.
6. Kempster P.A., Frankel J.P., Stern G.M., Lees A.J. Comparison of motor response to apomorphine and levodopa in Parkinson’s disease. Journal of Neurology, Neurosurgery, and Psychiatry. 1990. 53. 1004-1007.
7. Marxreiter F., Gabner H., Borozdina О., Barth J., Kohl Z., Schlachetzki J.C.М., Thun-Hohenstein C., Volc D., Eskofier B.M., Winkler J., Klucken J. Sensor-based gait analysis of individualized improvement during apomorphine titration in Parkinson’s disease. Journal of Neurology. Published online 08 September 2018. https://doi.org/10.1007/s00415-018-9012-7.
8. Ameghino L., Rossi M. Apomorphine, More Evidence for An Old Drug: A Key for Therapy Generalization? Movement disorders clinical practice. 2019. 6(2). 118-119. doi: 10.1002/mdc3.12717.
9. Manson A.J., Turner K., Lees A.J. Apomorphine Monothe-rapy in the Treatment of Refractory Motor Complications of Parkinson’s Disease: Long-Term Follow-Up Study of 64 Patients. Movement Disorders. 2002. Vol. 17. № 6. Р. 1235-1241. DOI 10.1002/mds.10281.
10. Merello M., Pikiely R., Cammarota A., Leiguarda R. Comparison of Subcutaneus Apomorphine Versus Dispersible Madopar Latency and Effect Duration in Parkinson’s Disease Patients: A Doble-Blind Single-Dose Study. Brief Report. Clinical Neuropharmacology.1997. Vol. 20. № 2. Р. 165-167.
11. Trenkwalder C., Chaudhuri K.R., Ruiz P.J.G., LeWitt Р., Katzenschlager R., Sixel-Doring F., Henriksen Т., Sesar А., Poewe W., on behalf of an Expert Consensus Group for the Use of Apomorphine in Parkinson’s Disease; Baker М., Ceballos-Baumann А., Deuschl G., Drapier S., Ebersbach G., Evans А., Fernandez H., Isaacson S., van Laar T., Lees А., Lewis S., Castrillo J.C.M., Martinez-Martin P., Odin P., O’Sullivan J., Tagaris G., Wenzel K. Review. Expert Consensus Group report on the use of apomorphine in the treatment of Parkinson’s disease — Clinical practice recommendations. Parkinsonism and Related Disorders. 2015. http://dx.doi.org/10.1016/j.parkreldis.2015.06.012.
12. Wenzel К., Homann C.N., Fabbrini G., Colosimo C. The role of subcutaneous infusion of apomorphine in Parkinson’s disease. Expert Review of Neurotherapeutics. 14. 7. 833-843. DOI: 10.1586/14737175.2014.928202.
13. Pessoa R.R., Moro А., Munhoz R.P., Teive H.A.G., Lees A.J. Apomorphine in the treatment of Parkinson’s disease: a review O uso da apomorfina no tratamento da doença de Parkinson: revisão da literatura. Arq. Neuropsiquiatr. 2018. 76(12). 840-848.
14. Ponte S.N., Malo C.G., Quílez M.R.B., Alonso P.S. A Novel Method of Treating ApomorphineInduced Subcutaneous Nodules. Movement disorders clinical practice. 2020. 7(1). 83-85. doi: 10.1002/mdc3.12853.
/72.jpg)
/75.jpg)

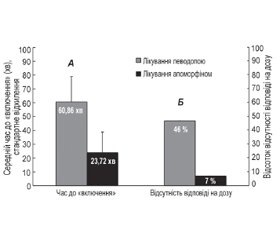
/71.jpg)
/74.jpg)