Журнал "Гастроэнтерология" Том 55, №2, 2021
Вернуться к номеру
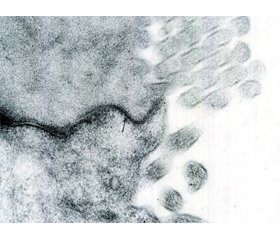
Морфологические проявления синдрома раздраженного кишечника
Авторы: Степанов Ю.М.(1), Будзак И.Я.(2), Гайдар Ю.А.(1)
(1) — ГУ «Институт гастроэнтерологии НАМН Украины», г. Днепр, Украина
(2) — Днепровский государственный медицинский университет, г. Днепр, Украина
Рубрики: Гастроэнтерология
Разделы: Справочник специалиста
Версия для печати
У статті наведені сучасні дані про морфологічні зміни у слизовій оболонці кишечника в пацієнтів із синдромом подразненого кишечника. Проаналізовано дослідження різних років, що вивчають морфологічні прояви синдрому подразненого кишечника. Показано, що при даній патології має місце незвичайне запалення низького ступеня. Важливу роль у цих запальних процесах відіграють тучні клітини, що мають вплив на дисмоторні порушення, вісцеральну гіперчутливість та інші патогенетичні фактори синдрому подразненого кишечника. Окремо проаналізовано порушення міжклітинних щільних контактів у даної категорії пацієнтів. Охарактеризована роль білків, що беруть участь у міжклітинних контактах (оклюдин, клаудин, zonula occludens). Проведено аналіз досліджень, що вивчали ці порушення. У статті наведені приклади аналізу біоптатів у хворих із синдромом подразненого кишечника при використанні різних методик їх оцінки.
В статье представлены современные данные о морфологических изменениях в слизистой оболочке кишечника у пациентов с синдромом раздраженного кишечника. Проанализированы исследования разных лет, изучающие морфологические проявления синдрома раздраженного кишечника. Показано, что при данной патологии имеет место необычное воспаление низкой степени. Важную роль в этих воспалительных процессах играют тучные клетки, которые имеют влияние на дисмоторные нарушения, висцеральную гиперчувствительность и другие патогенетические факторы синдрома раздраженного кишечника. Отдельно проанализированы нарушения межклеточных плотных контактов у данной категории пациентов. Охарактеризована роль белков, участвующих в межклеточных контактах (окклюдин, клаудин, zonula occludens). Проведен анализ исследований, изучавших эти нарушения. В статье приведены примеры анализа биоптатов у больных с синдромом раздраженного кишечника при использовании разных методик их оценки.
The article presents modern data on morphological changes in the intestinal mucosa in patients with irritable bowel syndrome. There were analyzed the studies of different years on the morphological manifestations of irritable bowel syndrome. It has been shown that this pathology has an unusual low-grade inflammation. Mast cells play an important role in these inflammatory disorders, they have an effect on motility disorders, visceral hypersensitivity and other pathogenetic factors of irritable bowel syndrome. Disorders of intercellular tight junctions in this category of patients were also analyzed. The role of proteins involved in intercellular contacts (occludin, claudin, ZO) has been characterized. An analysis of the studies investigating these disorders has been carried out. The article provides examples of the analysis of biopsies in patients with irritable bowel syndrome using various methods of their assessment.
синдром подразненого кишечника; морфологічна діагностика; запалення низького ступеня; тучні клітини; щільні контакти
синдром раздраженного кишечника; морфологическая диагностика; воспаление низкой степени; тучные клетки; плотные контакты
irritable bowel syndrome; morphological diagnosis; low-grade inflammation; mast cells; tight junctions
- Lacy B.E., Pimentel M., Brenner D.M., Chey W.D., Keefer L.A., Long M.D., Moshiree B. ACG Clinical Guideline. Management of Irritable Bowel Syndrome. Am. J. Gastroenterol. 2021 Jan. 1. 116 (1). 17-44.
- Alzahrani M.A., Alshamrani A.S., Ahmasani I.M., Alahmari F.S., Asiri A.H., Alshehri A.M., Alsamghan A.S., Awadalla N.J. Coronavirus disease 2019 pandemic stress and its effects on irritable bowel syndrome patients in Saudi Arabia. Medicine (Baltimore). 2020 Dec. 18. 99 (51). e23711.
- Lee Y.J., Park K.S. Irritable bowel syndrome: emerging paradigm in pathophysiology. World J. Gastroenterol. 2014. 20. 2456-2469.
- Nasef N.A., Mehta S. Role of Inflammation in Pathophysiology of Colonic Disease. An Update. Int. J. Mol. Sci. 2020 Jul. 3. 21 (13). 4748.
- Sinagra E., Pompei G., Tomasello G. et al. Inflammation in irritable bowel syndrome. Myth or new treatment target? World J. Gastroenterol. 2016. 22 (7). 2242-2255.
- Matricon J., Meleine M., Gelot A., Piche T., Dapoigny M., Muller E., Ardid D. Review article. Associations between immune activation, intestinal permeability and the irritable bowel syndrome. Aliment. Pharmacol. Ther. 2012. 36. 1009-1031.
- Lee K.N., Lee O.Y. The Role of Mast Cells in Irritable Bowel Syndrome. Gastroenterol. Res. Pract. 2016. 2016. 2031480.
- Gué M., Del Rio-Lacheze C., Eutamene H., Théodorou V., Fioramonti J., Buéno L. Stress-induced visceral hypersensitivity to rectal distension in rats. role of CRF and mast cells. Neurogastroenterology and Motility. 1997. 9 (4). 271-279.
- Hiatt R.B., Katz L. Mast cells in inflammatory conditions of the gastrointestinal tract. Am. J. Gastroenterol. 1962. 37. 541-545.
- O’Sullivan M., Clayton N., Breslin N.P., Harman I., Bountra C., McLaren A., O’Morain C.A. Increased mast cells in the irritable bowel syndrome. Neurogastroenterol. Motil. 2000. 12. 449-457.
- Piche T., Saint-Paul M.C., Dainese R., Marine-Barjoan E., Iannelli A., Montoya M.L., Peyron J.F., Czerucka D., Cherikh F., Filippi J. et al. Mast cells and cellularity of the colonic mucosa correlated with fatigue and depression in irritable bowel syndrome. Gut. 2008. 57. 468-473.
- Cremon C., Gargano L., Morselli-Labate A.M. et al. Mucosal immune activation in irritable bowel syndrome: gender-dependence and association with digestive symptoms. The American Journal of Gastroenterology. 2009. 104 (2). 392-400.
- Barbara G., Stanghellini V., De Giorgio R., Cremon C., Cottrell G.S., Santini D., Pasquinelli G., Morselli-Labate A.M., Grady E.F., Bunnett N.W., Collins S.M., Corinaldesi R. Activated mast cells in proximity to colonic nerves correlate with abdominal pain in irritable bowel syndrome. Gastroenterology. 2004 Mar. 126 (3). 693-702.
- Buhner S., Li Q., Vignali S. et al. Activation of human enteric neurons by supernatants of colonic biopsy specimens from patients with irritable bowel syndrome. Gastroenterology. 2009. 137 (4). 1425-1434.
- Balestra B., Vicini R., Cremon C., Zecchi L., Dothel G., Vasina V., De Giorgio R., Paccapelo A., Pastoris O., Stanghellini V., Corinaldesi R., De Ponti F., Tonini M., Barbara G. Colonic mucosal mediators from patients with irritable bowel syndrome excite enteric cholinergic motor neurons. Neurogastroenterol. Motil. 2012 Dec. 24 (12). 1118-e570.
- Groschwitz K.R., Ahrens R., Osterfeld H., Gurish M.F., Han X., Abrink M., Finkelman F.D., Pejler G., Hogan S.P. Mast cells regulate homeostatic intestinal epithelial migration and barrier function by a chymase/Mcpt4-dependent mechanism. Proc. Natl. Acad. Sci USA. 2009 Dec. 29. 106 (52). 22381-6.
- Martínez C., Vicario M., Ramos L., Lobo B., Mosquera J.L., Alonso C., Sánchez A., Guilarte M., Antolín M., de Torres I., González-Castro A.M., Pigrau M., Saperas E., Azpiroz F., Santos J. The jejunum of diarrhea-predominant irritable bowel syndrome shows molecular alterations in the tight junction signaling pathway that are associated with mucosal pathobiology and clinical manifestations. Am. J. Gastroenterol. 2012 May. 107 (5). 736-46.
- Sun H., Ma Y., An S., Wang Z. Altered gene expression signatures by calcitonin gene-related peptide promoted mast cell activity in the colon of stress-induced visceral hyperalgesia mice. Neurogastroenterol. Motil. 2020 Dec. 31. e14073.
- Alonso C., Guilarte M., Vicario M., Ramos L., Rezzi S., Martínez C., Lobo B., Martin F.P., Pigrau M., González-Castro A.M., Gallart M., Malagelada J.R., Azpiroz F., Kochhar S., Santos J. Acute experimental stress evokes a differential gender-determined increase in human intestinal macromolecular permeability. Neurogastroenterol. Motil. 2012 Aug. 24 (8). 740-6, e348-9.
- Akbar A., Yiangou Y., Facer P., Walters J.R., Anand P., Ghosh S. Increased capsaicin receptor TRPV1-expressing sensory fibres in irritable bowel syndrome and their correlation with abdominal pain. Gut. 2008 Jul. 57 (7). 923-9.
- Di Nardo G., Barbara G., Cucchiara S. et al. Neuroimmune interactions at different intestinal sites are related to abdominal pain symptoms in children with IBS. Neurogastroenterology and Motility. 2014. 26 (2). 196-204.
- Cremon C., Carini G., Wang B. et al. Intestinal serotonin release, sensory neuron activation, and abdominal pain in irritable bowel syndrome. American Journal of Gastroenterology. 2011. 106 (7). 1290-1298.
- Ohman L., Isaksson S., Lindmark A.C., Posserud I., Stotzer P.O., Strid H., Sjövall H., Simrén M. T-cell activation in patients with irritable bowel syndrome. Am. J. Gastroenterol. 2009. 104. 1205-1212.
- Lee K.J., Kim Y.B., Kim J.H., Kwon H.C., Kim D.K., Cho S.W. The alteration of enterochromaffin cell, mast cell, and lamina propria T lymphocyte numbers in irritable bowel syndrome and its relationship with psychological factors. J. Gastroenterol. Hepatol. 2008. 23. 1689-1694.
- Singh M., Singh V., Schurman J.V., Colombo J.M., Friesen C.A. The relationship between mucosal inflammatory cells, specific symptoms, and psychological functioning in youth with irritable bowel syndrome. Sci Rep. 2020 Jul. 20. 10 (1). 11988.
- Sinagra E., Morreale G.C., Mohammadian G., Fusco G., Guarnotta V., Tomasello G., Cappello F., Rossi F., Amvrosiadis G., Raimondo D. New therapeutic perspectives in irritable bowel syndrome. Targeting low-grade inflammation, immuno-neuroendocrine axis, motility, secretion and beyond. World J. Gastroenterol. 2017 Sep 28. 23 (36). 6593-6627.
- Piche T., Barbara G., Aubert P., Bruley des Varannes S., Dainese R., Nano J.L., Cremon C., Stanghellini V., De Giorgio R., Galmiche J.P. et al. Impaired intestinal barrier integrity in the colon of patients with irritable bowel syndrome. involvement of soluble mediators. Gut. 2009. 58. 196-201.
- Zhou Q., Zhang B., Verne G.N. Intestinal membrane permeability and hypersensitivity in the irritable bowel syndrome. Pain. 2009. 146. 41-46.
- Santos J., Yang P.C., Söderholm J.D., Benjamin M., Perdue M.H. Role of mast cells in chronic stress induced colonic epithelial barrier dysfunction in the rat. Gut. 2001. 48. 630-636.
- Bertiaux-Vandaële N., Youmba S.B., Belmonte L., Lecleire S., Antonietti M., Gourcerol G., Leroi A.M., Déchelotte P., Ménard J.F., Ducrotté P. et al. The expression and the cellular distribution of the tight junction proteins are altered in irritable bowel syndrome patients with differences according to the disease subtype. Am. J. Gastroenterol. 2011. 106. 2165-2173.
- Martínez C., González-Castro A., Vicario M., Santos J. Cellular and molecular basis of intestinal barrier dysfunction in the irritable bowel syndrome. Gut. Liver. 2012 Jul. 6 (3). 305-15.
- Turner J.R. Intestinal mucosal barrier function in health and disease. Nat. Rev. Immunol. 2009. 9. 799-809.
- Garrett W.S., Gordon J.I., Glimcher L.H. Homeostasis and inflammation in the intestine. Cell. 2010. 140. 859-870.
- Spiller R.C., Jenkins D., Thornley J.P. et al. Increased rectal mucosal enteroendocrine cells, T lymphocytes, and increased gut permeability following acute Campylobacter enteritis and in post-dysenteric irritable bowel syndrome. Gut. 2000. 47. 804-811.
- Zhou Q., Zhang B., Verne G.N. Intestinal membrane permeability and hypersensitivity in the irritable bowel syndrome. Pain. 2009. 146. 41-46.
- Martínez C., Vicario M., Ramos L. et al. The jejunum of diarrhea-predominant irritable bowel syndrome shows molecular alterations in the tight junction signaling pathway that are associated with mucosal pathobiology and clinical manifestations. Am. J. Gastroenterol. 2012 May. 107 (5). 736-46.
- Cheng P., Yao J., Wang C., Zhang L., Kong W. Molecular and cellular mechanisms of tight junction dysfunction in the irritable bowel syndrome. Mol. Med. Rep. 2015. 12 (3). 3257-3264.
- Zhang M., Chen C.Y., Hu Y., Lyu B. The relationship between adherens junction and tight junction and clinical symptoms in patients with diarrhea predominant irritable bowel syndrome. Zhonghua Nei Ke Za Zhi. 2020 Jan. 1. 59 (1). 40-46.

/60.jpg)
/61.jpg)