Журнал «Актуальная инфектология» Том 9, №1, 2021
Вернуться к номеру
Епідеміологічні аспекти інфікування Нelicobacter pylori в дітей
Авторы: Сорокман Т.В., Молдован П.М., Попелюк Н.О., Парфьонова І.В.
Буковинський державний медичний університет, м. Чернівці, Україна
Рубрики: Инфекционные заболевания
Разделы: Справочник специалиста
Версия для печати
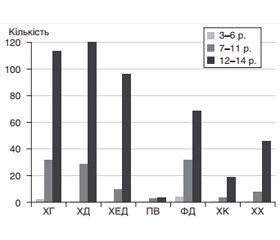
Актуальність. Серед бактеріальних інфекцій особливе місце посідають інфекції, спричинені Нelicobacter pylori (H.pylori). Інфікування H.pylori частіше відбувається в дитячому віці й зазвичай є безсимптомним. Все більшої актуальності набуває вивчення регіональних і субрегіональних особливостей інфекції H.pylori в дітей. Матеріали та методи. Проведено ретроспективний аналіз статистичних даних річних звітів за 5 років (2015–2019) на базі гастроентерологічних стаціонарів м. Чернівці. Результати. У структурі захворювань органів травлення провідне місце впродовж останніх 5 років займали захворювання органів гастродуоденальної ділянки. Серед 2013 дітей у 916 (45,5 %) була виявлена інфекція H. pylori, з віком частота інфікування зростає та має залежність від статі. Встановлено, що серед родичів 1-го і 2-го ступеня споріднення, частіше по материнській лінії, 759 (82,8 %) дітей із позитивним тестом на H.pylori захворювання шлунка і дванадцятипалої кишки діагностували у 455 (59,9 %) осіб. Існує прямий зв’язок між ендоскопічним нодулярним гастритом і H.pylori-інфекцією. Висновки. Поширеність H.pylori серед дитячої популяції Чернівецької області становить 45,5 %. Інфекція H.pylori є захворюванням різних періодів дитинства з переважанням дівчаток і супроводжується ураженням слизової шлунка і дванадцятипалої кишки, її частота збільшується з віком дітей, що супроводжується зростанням ерозивно-виразкових уражень.
Актуальность. Среди бактериальных инфекций особое место занимают инфекции, вызванные Нelicobacter pylori (H.pylori). Инфицирование H.pylori чаще происходит в детском возрасте и бывает обычно бессимптомным. Все большую актуальность приобретает изучение региональных и субрегиональных особенностей инфекции H.pylori у детей. Материалы и методы. Проведен ретроспективный анализ статистических данных годовых отчетов за 5 лет (2015–2019) на базе гастроэнтерологических стационаров г. Черновцы. Результаты. В структуре заболеваний органов пищеварения ведущее место в течение последних 5 лет занимали заболевания органов гастродуоденальной зоны. Среди 2013 детей у 916 (45,5 %) была выявлена инфекция H.pylori, с возрастом частота инфицирования возрастает и имеет зависимость от пола. Установлено, что среди родственников 1-й и 2-й степени родства, чаще по материнской линии, 759 (82,8 %) детей с положительным тестом на H.pylori заболевания желудка и двенадцатиперстной кишки диагностировали у 455 (59,9 %) человек. Существует прямая связь между эндоскопическим нодулярным гастритом и H.pylori-инфекцией. Выводы. Распространенность H.pylori среди детской популяции Черновицкой области составляет 45,5 %. Инфекция H.pylori является заболеванием различных периодов детства с преобладанием девочек и сопровождается поражением слизистой желудка и двенадцатиперстной кишки, частота увеличивается с возрастом детей, сопровождается ростом эрозивно-язвенных поражений.
Background. Among bacterial infections those caused by Helicobacter pylori (H.pylori) have a special place. H.pylori infection is more common in childhood and is usually asymptomatic. The study of regional and subregional features of H.pylori infection in children is becoming increasingly important. Materials and methods. A retrospective analysis of statistical data of annual reports for 5 years (2015–2019) was conducted on the basis of gastroenterological hospitals in Chernivtsi. Results. For the last 5 years, gastroduodenal diseases were most common in the structure of digestive disorders. Since 2013, 916 children (45.5 %) have been diagnosed with H.pylori infection, its frequency increases with age and is sex-dependent. It was found that in 759 (82.8 %) children with a positive test for H.pylori, diseases of the stomach and duodenum were diagnosed in first- and second-degree relatives, more often through the maternal line — in 455 (59.9 %) people. There is a direct link between endoscopic nodular gastritis and H.pylori infection. Conclusions. The prevalence of H.pylori among the child population of Chernivtsi region is 45.5 %. H.pylori infection is a disease of different periods of childhood with predominance in girls and is accompanied by lesions of the gastric and duodenal mucosa, its frequency increases with age of children that is accompanied by an increase in erosive-ulcerative lesions.
діти; H.pylori
дети; H.pylori
children; H.pylori
Вступ
Матеріали та методи
Результати та обговорення
/19_2.jpg)
Обговорення
Висновки
- UEG Week 2018 Oral Presentations. United European Gastroenterol J. 2018. 6(8). A1–A134. doi: 10.1177/2050640618792817.
- 27th International Congress of the European Association for Endoscopic Surgery (EAES) Sevilla, Spain, 12–15 June 2019. Surg Endosc. 2019. 33(2). 485-781. doi: 10.1007/s00464-019-07109-x.
- Hunf R.H., Tytgat G.N.J. Helicobacter pylori. Basic mechanisms to clinical cure 2000. Kluwer academic publishers: Dordrecht, Boston, London, 2000. 3-255.
- Chmiela M., Karwowska S., Gonciarz W. et al. Host pathogen interactions in Helicobacter pylori related gastric cancer. World J. Gastroenterol. 2017. 23(9). 1521-1540. doi: 10.3748/wjg.v23.i9.1521.
- Харченко Н.В., Бабак О.Я. Гастроентерологія. К., 2007. 720 с.
- Андерсен Л.П. Новые виды рода Нelicobacter pylori у человека. РЖГГК. 2003. 2. 81-84.
- Baj J., Korona-Głowniak I., Forma A. et al. Mechanisms of the Epithelial-Mesenchymal Transition and Tumor Microenvironment in Helicobacter pylori-Induced Gastric Cancer. Cells. 2020. 9(4). 1055. doi: 10.3390/cells9041055.
- Amieva M.R., El-Omar E.M. Helicobacter pylori. Взаимодействие хозяина и инфекции. Therapia. 2009. 1. 8-22.
- UEG Week 2017 Poster Presentations United European Gastroenterol J. 2017. 5(5). A161–A836. doi: 10.1177/2050640617725676.
- Park J.Y., Forman D., Waskito L.A. et al. Epidemiology of Helicobacter pylori and CagA-Positive Infections and Global Variations in Gastric Cancer. Toxins (Basel). 2018. 10(4). 163. doi: 10.3390/toxins10040163.
- Gravina A.G., Zagari R.M., Musis C.D. et al. Helicobacter pylori and extragastric diseases: A review. World J. Gastroenterol. 2018. 7. 24(29). 3204-3221. doi: 10.3748/wjg.v24.i29.3204.
- George S., Lucero Y., Torres J.P. et al. Gastric Damage and Cancer-Associated Biomarkers in Helicobacter pylori-Infected Children. Microbiol. 2020. 11. 90. doi: 10.3389/fmicb.2020.00090.
- Fahim S.M., Das S., Gazi M.A. et al. Helicobacter pylori infection is associated with fecal biomarkers of environmental enteric dysfunction but not with the nutritional status of children living in Bangladesh. PLoS Negl. Trop. Dis. 2020. 14(4). e0008243. doi: 10.1371/journal.pntd.0008243.
- Muhsen K., Athamna A., Bialik A. et al. Presence of Helicobacter pylori in a sibling is associated with a long-term increased risk of H.pylori infection in Israeli Arab children. Helicobacter. 2010 Apr. 15(2). 108-13. doi: 10.1111/j.1523-5378.2010.00746.
- Weyermann M., Rothenbacher D., Brenner H. Acquisition of Helicobacter pylori infection in early childhood: independent contributions of infected mothers, fathers, and siblings. Am. J. Gastroenterol. 2009. 104 (1). 182-9. doi: 10.1038/ajg.2008.61.
- Malfertheiner P., Megraud F., O’Morain C. et al. Current European concepts in the management of Helicobacter pylori infection. The Maastricht 2-2000 Consensus Report Aliment. Pharmacol. Ther. 2002. 16(2). 167-80. doi: 10.1046/j.1365-2036.2002.01169.x.
- Malfertheiner P., Megraud F., O’Morain C. et al. The European Helicobacter Study Group (EHSG). Management of Helicobacter pylori infection — the Maastricht IV; Florence Consensus Report. Gut. 2012. 61. 646-664. doi: 10.1136/gutjnl-2012-302084.
- Malfertheiner P., Megraud F., O’Morain C. et al. Management of Helicobacter pylori infection — the Maastricht V/Florence Consensus Report. Gut. 2016. 0. 1-25. doi: 10.1136/gutjnl-2016-312288/.
- Sugano K., Tack J., Kuipers E.J. et al. Kyoto global consensus report on Helicobacter pylori gastritis. Gut. 2015. 64(9). 1353-67. doi: 10.1136/gutjnl-2015-309252.
- Koletzko S., Jones N., Goodman K. et al. Evidence-based guidelines from ESPGHAN and NASPGHAN for Helicobacter pylori infection in children. J. Pediatr. Gastroenterol. Nutr. 2011. 53. 230-43. doi: 10.1097/MPG.0b013e3182227e90.
- Jones N., Koletzko S., Goodman K. et al. Joint ESPGHAN/ NASPGHAN Guidelines for the Management of Helicobacter pylori in Children and Adolescents (Update 2016). J. Pediatr. Gastroenterol. Nutr. 2017. 64(6). 991-1003. doi: 10.1097/MPG.0000000000001594.
- Pohl D., Keller P.M., Bordier V., Wagner K. Review of current diagnostic methods and advances in Helicobacter pylori diagnostics in the era of next generation sequencing. World J. Gastroenterol. 2019. 28. 25(32). 4629-4660. doi: 10.3748/wjg.v25.i32.462.
- Georgopoulos S.D., Michopoulos S., Rokkas T. et al. Hellenic consensus on Helicobacter pylori infection. Ann. Gastroenterol. 2020. 33(2). 105-124. doi: 10.20524/aog.2020.0446.
- Антипкін Ю.Г., Волосовець О.П., Майданник В.Г. та ін. Стан здоров’я дитячого населення — майбутнє країни. Ч. 1. Здоровье ребенка. 2018. 13(1). 1-11. doi: 10.22141/2224-0551.13.1.2018.127059.
- Шадрін О.Г., Ігнатко Л.В., Шебела В.І. Особливості періоду ремісії хронічних захворювань верхніх відділів травного каналу у дітей за наявності Helicobacter pylori інфекції. Перинатологія і педіатрія. 2007. 1. 55-58.
- Shimatani T., Inoue M., Iwamoto K. et al. Prevalence of Helicobacter pylori infection, endoscopic gastric findings and dyspeptic symptoms among a young Japanese population born in the 1970s. J. Gastroenterol. Hepatol. 2005. 20(9). 1352-7. doi: 10.1111/j.1440-1746.2005.03866.x.
- Kusters J.G., van Vliet A.H.M., Kuipers E.J. Pathogenesis of Helicobacter pylori Infection. Clin. Microbiol. Rev. 2006. 19(3). 449-490. doi: 10.1128/CMR.00054-05.
- Court M., Robinson P.A., Dixon M.F., Jeremy A.H.T. The effect of gender on Helicobacter felis-mediated gastritis, epithelial cell proliferation, and apoptosis in the mouse model. The Journal of Pathology. 2003. 201(2). 303-11. doi: 10.1002/path.1422.

/18.jpg)
/19.jpg)