У 2020 році Міжнародною асоціацією з вивчення болю (International Association for the Study of Pain — IASP) вперше з 1979 року було оновлене загальне визначення болю та його розуміння. Отже, згідно з IASP, біль — неприємне сенсорне й емоційне переживання, пов’язане або таке, що здається пов’язаним з дійсним або потенційним пошкодженням тканин [1].
IASP розробила переглянуте визначення разом з шістьма примітками, щоб краще передати особливості і складність переживання болю, а саме: біль — це завжди особистий досвід, на який тією чи іншою мірою впливають біологічні, психологічні та соціальні чинники; біль і ноцицепція — різні явища, біль не може бути виведений тільки з активності сенсорних нейронів; завдяки своєму життєвому досвіду люди пізнають поняття болю; звіт людини про переживання як про біль повинен поважатися; хоча біль зазвичай відіграє адаптивну роль, він може несприятливо впливати на функції, соціальне та психологічне благополуччя; вербальний опис є лише одним із декількох способів вираження болю; нездатність спілкуватися не заперечує можливості того, що людина або тварина відчуває біль [1].
У сучасному розумінні визначають декілька типів болю (ноцицептивний, невропатичний і ноципластичний), що в першу чергу відображає механізми їх виникнення та клінічні особливості прояву.
Одним із найбільш частих типів болю, з яким стикається лікар у щоденній практиці, є ноцицептивний біль. Ноцицептивний біль — це біль, який виникає через активацію ноцицепторів у ненервовій тканині з фактичним пошкодженням або загрозою пошкодження тканини [2].
При пошкодженні тканини вивільняються медіатори запалення: простагландини, продукти арахідонової кислоти, брадикінін, цитокіни, гістамін, серотонін тощо. У результаті подразнення ноцицепторів поріг болю зменшується і збільшуються відповіді на підпорогові стимули, викликаючи первинну гіпералгезію. Ця периферична сенсибілізація є процесом, який сприяє посиленню болю від місця травми і має функцію захисту тканини від більшого пошкодження, додаючи час на відновлення пошкодження [3].
Класичний ноцицептивний біль виникає при таких патологіях, як: ревматоїдний артрит і артрози, травми і поранення, неспецифічний біль у спині, вісцеральний біль тощо [4].
Другий вид болю, який, за різними даними, становить від 6,9 до 10 % у генеральній популяції, це невропатичний біль, який поділяють на центральний (травма спинного мозку, інсульт, розсіяний склероз) та периферичний невропатичний біль (постгерпетична невралгія, тригемінальна невралгія, діабетична полінейропатія) [5].
У виникненні невропатичного болю відіграє роль низка периферичних і центральних механізмів, які часто взаємопов’язані. Одними з периферичних механізмів виникнення невропатичного болю можуть бути: спонтанна ектопічна активність в пошкоджених нейронах, обумовлена зміною структури натрієвих каналів у регенеруючих аксонах пошкоджених нервів, патологічні взаємодії між нервовими волокнами (імпульс, що йде від нейрона з пошкодженою мієліновою оболонкою, може потрапляти на сусідні волокна, та/або виникають перехресні розряди в нейронах спінального ганглію з виникненням циркулюючого нервового імпульсу та формуванням так званого порочного кола патологічної імпульсації), розвиток гіперчутливості нейронів до катехоламінів, симпатичне посилення болю [6].
З центральних механізмів виникнення невропатичного болю головним чином слід відзначити центральну сенситизацію, яка полягає в підвищенні чутливості ноцицептивних нейронів у центральній нервовій системі (ЦНС) до нормального або підпорогового аферентного імпульсу унаслідок гіперзбудливості нейронів зі стійкою деполяризацією постсинаптичної мембрани нейронів іонами кальцію. Цей стан обумовлений появою ектопічних спонтанних розрядів у пошкоджених нервових волокнах, що доповнює порочне коло периферичної патологічної імпульсації центральним компонентом. Серед інших центральних механізмів невропатичного болю можна відзначити ефект спраутинга та феномен накручування (wind-up). Ефект спраутинга полягає в проникненні відростків Аβ-волокон до С-волокон і призводить до того, що небольові (тактильні) імпульси, які передаються Аβ-волокнами, сприймаються як больові. Це значною мірою збільшує потік больових сигналів у задній ріг спинного мозку. При феномені накручування (wind-up) відповідь нейронів на кожний наступний больовий імпульс підвищується навіть в тому випадку, якщо величина цього імпульсу не змінюється. У подальшому розвивається дефіцит гальмування, який виникає через загибель гальмівних інтернейронів унаслідок ексайтотоксичності. Слідом за цими змінами спостерігається зменшення щільності рецепторів ГАМК у задньому розі спинного мозку [6].
Наслідком вищенаведених механізмів є формування чітких клінічних симптомів невропатичного болю, а саме: гіпералгезія (посилення больової реакції на шкідливі стимули), алодинія (зниження больового порогу), гіперпатія (надмірна суб’єктивна реакція на больові і небольові стимули, яка зберігається протягом тривалого часу), вторинна гіпералгезія (поширення больових відчуттів за межі тканинного ушкодження) [5].
У 2017 році IASP було введено новий термін на позначення третього різновиду болю, а саме «ноципластичний біль», який фактично замінив раніше існуючий термін «дисфункціональний біль».
Ноципластичний біль — це біль, який виникає через зміну ноцицепції, незважаючи на відсутність явних доказів наявності пошкодження або загрози пошкодження тканини, що викликає активацію периферичних ноцицепторів, або відсутність доказів захворювання чи ураження соматосенсорної системи, що викликають біль. Головна відмінність ноципластичного болю від ноцицептивного і невропатичного полягає в тому, що при традиційному обстеженні не вдається виявити причину болю або органічні захворювання, які могли б пояснити походження болю [6].
Ноципластичний біль обумовлений не первинною патологією відповідного органа або системи, а нейробіологічними, нейрофізіологічними, нейрохімічними і морфологічними змінами в ЦНС. Основними факторами, що сприяють розвитку цього виду болю, є психологічні, соціальні фактори й емоційний стрес. Ці фактори відіграють ключову роль у порушенні адекватної роботи низхідної норадренергічної і серотонінергічної системи. У підсумку це призводить до того, що звичайні небольові стимули починають сприйматися як больові [8].
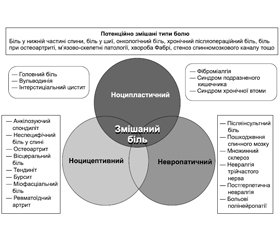
Оскільки в клінічній практиці найбільш часто зустрічається ноцицептивний біль або його комбінації з невропатичним і ноципластичним болем (рис. 1) [4], його ефективне лікування може сприяти більш швидкому покращенню стану хворого та якості його життя. Більше того, ефективне його лікування може запобігти його хронізації та формуванню на його основі невропатичного та ноципластичного больового синдрому, що ускладнюватиме перебіг захворювання і відтерміновуватиме одужання хворого.
Відомо, що препаратами вибору в лікуванні ноцицептивного або змішаного болю є нестероїдні протизапальні засоби (НПЗЗ). Однак і тут існують певні моменти, які необхідно брати до уваги при їх використанні, особливо знеболюючий потенціал та безпеку застосування в окремих категорій пацієнтів, а також їх патологію.
Найбільш важливим механізмом НПЗЗ є здатність пригнічувати циклооксигеназу (ЦОГ) — фермент, що каталізує перетворення вільних поліненасичених жирних кислот в простагландини, а також інші ейкозаноїди — тромбоксани (перш за все тромбоксан A2) і простациклін (простагландин I2) [9].
Відомо, що НПЗЗ поділяються на неселективні інгібітори ЦОГ (тобто пригнічують обидва ферменти ЦОГ-1 і ЦОГ-2) та селективні (пригнічують переважно ЦОГ-2). Більш детальний поділ НПЗЗ за впливом на різновиди ЦОГ подано в табл. 1.
Установлено, що обидва ізоферменти (ЦОГ-1 і ЦОГ-2) беруть участь у регулюванні і модуляції такого патологічного процесу, як запалення. А ЦОГ-2, що традиційно вважається «патологічною», відповідальна за низку фізіологічних процесів, таких як регуляція репродуктивної функції, функції нирок, ремоделювання кісткової тканини, регулювання функції підшлункової залози (табл. 2) [10, 11]. З огляду на той факт, що в патофізіологічних механізмах розвитку больового синдрому беруть участь обидва ізоферменти ЦОГ, найбільш доцільним є використання препаратів із збалансованою інгібуючою активністю щодо ЦОГ-1 і ЦОГ-2 [11].
ЦОГ — основний, але не єдиний таргетний білок НПЗЗ. Тому препарати цієї групи мають істотні відмінності як у фармакологічній дії, так і в побічних реакціях [12].
Порівняння селективної аналгезуючої активності щодо ступеня пригнічення синтезу простагландинів показало, що деякі НПЗЗ із сильними аналгетичними властивостями є слабкими інгібіторами синтезу простагландинів, і навпаки, інші НПЗЗ, здатні активно пригнічувати синтез простагландинів, мають слабкі аналгезуючі властивості. Таким чином, має місце дисоціація між аналгезуючою і протизапальною активністю НПЗЗ. Цей феномен пояснюється тим, що аналгетична дія деяких НПЗЗ пов’язана не тільки з пригніченням центральних і периферичних простагландинів, але й із впливом на синтез та активність інших нейроактивних речовин, які відіграють ключову роль у сприйнятті больового імпульсу в ЦНС [9].
Завдання практичного лікаря полягає в тому, щоб серед безлічі аналгетиків правильно вибрати препарат для пацієнта, беручи до уваги всі показання і протипоказання, адекватно підібрати дозу аналгетиків. При цьому бажано використовувати препарат з максимальною швидкістю розвитку протибольового ефекту і мінімальним ризиком ускладнень із боку шлунково-кишкового тракту (ШКТ) без шкоди для ефективності [13].
Відомо, що неселективні щодо ЦОГ НПЗЗ викликають більш виражений аналгетичний ефект порівняно з селективними препаратами, але при цьому мають більший спектр побічних реакцій, частота яких збільшується з віком. Серед НПЗЗ найбільшу аналгетичну активність має кетопрофен, який, будучи неселективним інгібітором ЦОГ, також не позбавлений загальних для НПЗЗ побічних реакцій [14].
Субстанція «звичайного» кетопрофену являє собою рацемат, тобто рівномірну суміш енантіомерів — «дзеркальних» право- (S+) і лівообертальних (R–) стереоізомерів молекул діючої речовини. Енантіомерами (оптичними ізомерами) є пари оптичних речовин-антиподів, що характеризуються протилежними за знаком і однаковими за величиною обертаннями в площині поляризації світла при ідентичності всіх інших фізичних та хімічних властивостей. Представники групи НПЗЗ, похідні арилпропіонових кислот, до яких відноситься кетопрофен, містять асиметричний атом вуглецю. Речовини, пов’язані з цим атомом, можуть формувати дві різні конфігурації однієї молекули (енантіомери). При цьому тільки правообертальний стереоізомер (S+) кетопрофену має фармакологічну (аналгетичну, протизапальну) активність, блокуючи фермент ЦОГ-2, що бере участь в утворенні простагландинів у вогнищі ушкодженої тканини. Синтез цих простагландинів викликає формування ноцицептивного болю і розвиток процесів ексудативного запалення в місці пошкодження тканин. Лівообертальний стереоізомер (R–) практично не має фармакологічної активності, але при цьому його метаболіти відповідальні за розвиток небажаних ефектів кетопрофену. Хімічна ідентифікація правообертального стереоізомеру кетопрофену та встановлення його ролі в розвитку фармакологічного ефекту дозволили створити новий лікарський препарат — декскетопрофену трометамол, який являє собою водорозчинну сіль правообертального стереоізомеру кетопрофену [15].
Правообертальний ізомер кетопрофену декскетопрофен має кращий профіль гастроінтестинальної переносимості та менше метаболічне навантаження на організм завдяки можливості використання більш низьких терапевтичних доз. Крім того, важливим є той факт, що декскетопрофен метаболізується в організмі без участі цитохромів печінки, що значно знижує ризик міжлікарської взаємодії. Вплив декскетопрофену на вироблення медіаторів болю на рівні ЦНС обумовлений його здатністю проникати через гематоенцефалічний бар’єр завдяки високій ліпофільності. Ефективність декскетопрофену трометамолу в дозі 50 мг внутрішньом’язово була подібна 4 мг морфіну підшкірно за швидкістю настання ефекту, проте тривалість знеболювання була значно більшою [11].
Отже, декскетопрофен є повноцінним протизапальним засобом з периферичною дією через інгібування ЦОГ-2 (яка надмірно експресується під час периферичного запального процесу) і центральною дією на спинний мозок і гліальні клітини через інгібування ЦОГ-1 (помірно пригнічує ЦОГ-2 і сильно — ЦОГ-1) та пригнічення деполяризації нейронів задніх стовпів спинного мозку [16].
Протизапальна дія декскетопрофену може здійснюватися за допомогою модулювання метаболізму простагландинів і лейкотрієнів, а також інгібування матричних металопротеїназ. Антиагрегаційні ефекти декскетопрофену можуть бути обумовлені пригніченням тромбоксан-A2-синтетази на 72 ± 49 %. Показано також, що декскетопрофен на відміну від молекул порівняння не пригнічує рецептори нейротрофічних факторів BDNF/NT-3 (ген NTRK2) і аденілатциклази (ADCY6 і ADCY7), а отже, не справляє негативного впливу на когнітивну сферу і пам’ять [12].
У дослідженні на моделі запального процесу було виявлено активацію NO та 5-HT (серотонінергічних) шляхів під дією декскетопрофену, які відіграють важливу роль у системному антиноцицептивному ефекті [17].
Поєднання декскетопрофену з трометамолом сприяє прискоренню абсорбції активної речовини і швидкому ефекту [18].
Декскетопрофену трометамол швидко і повністю всмоктується після прийому всередину, а максимальна концентрація в плазмі крові досягається швидше, ніж при прийомі кетопрофену, — за 15–45 хв [9].
На рис. 2 показана швидкість настання знеболюючого ефекту різних НПЗЗ, серед яких найшвидшу дію має декскетопрофен.
Висока інгібуюча активність декскетопрофену щодо ЦОГ-1 і ЦОГ-2 визначає його центральні і периферичні аналгетичні ефекти, а висока протизапальна активність препарату поєднується з доброю переносимістю [18].
Цікавим аспектом для НПЗЗ, необхідним для вибору препарату, є порівняння їх знеболюючої активності. Для визначення ефективності препарату у відповідній дозі досить часто використовують епідеміологічний показник ефективності медичного втручання, а саме number-needed-to-treat (NNT, число, необхідне для лікування). NNT показує кількість пацієнтів, яким потрібно приймати препарат, щоб досягти принаймні 50% полегшення болю, порівняно з плацебо протягом 4–6 годин.
За результатами одного з метааналізів була продемонстрована тенденція залежного від дози ефекту декскетопрофену. Так, NNT для декскетопрофену в дозі 12,5 мг становить 3,5, у дозі 25 мг — 3,0, а в дозі 50 мг — 2,1 [19].
Для порівняння, за результатами різних досліджень, NNT для вальдекоксибу 40 мг і ібупрофену 800 мг становить 1,6, кеторолаку в дозі 60 мг внутрішньом’язово — 1,8 та в дозі 30 мг — 3,4, парацетамолу 1000 мг — 3,4 та в дозі 500 мг — 3,7, напроксену в дозі 275 мг — 3,1 та в дозі 550 мг — 3,0, аспірину 1000 мг — 2,4 та в дозі 500 мг — 4,4 [20].
Окрім індексу NNT, для порівняння ефективності НПЗЗ між собою при різних патологіях з больовим синдромом також проводилися окремі дослідження, які вказували на особливості знеболюючої ефективності декскетопрофену, а також його безпечності. Найбільш цікавими можуть бути дослідження з порівнянням декскетопрофену і НПЗЗ широкого використання та вираженою аналгетичною активністю, а саме: диклофенаку, кеторолаку, лорноксикаму і парацетамолу.
Порівняння декскетопрофену і диклофенаку для лікування неспецифічного болю в спині у 185 пацієнтів продемонструвало більш високу ефективність декскетопрофену на всіх етапах лікування. Декскетопрофен був ефективнішим відносно як інтенсивності болю, так і ступеня непрацездатності [21].
Також декскетопрофен у дозі 50 мг внутрішньовенно за 30 хвилин до закінчення лапароскопічної холецистектомії виявився ефективнішим в післяопераційному знеболюванні порівняно з диклофенаком 75 мг внутрішньовенно, крім того, додаткове використання опіоїдів було значно нижчим при використанні декскетопрофену (р < 0,01) [22].
У багатоцентровому рандомізованому подвійному сліпому паралельному дослідженні порівнювалася аналгетична ефективність декскетопрофену і кеторолаку у 115 онкологічних пацієнтів з болем, викликаним метастазами пухлини в кістки. Препарат порівняння кеторолак призначали всередину по 10 мг 4 рази на добу. Протягом дослідження було встановлено, що декскетопрофен і кеторолак продемонстрували подібну знеболюючу дію з тенденцією до більш вираженого аналгетичного ефекту на сьомий день лікування у декскетопрофену. При оцінці загальної ефективності більш високий відсоток пацієнтів і лікарів оцінили декс-кетопрофен як «досить ефективний» або «дуже ефективний» препарат порівняно з кеторолаком. Відсоток пацієнтів, виключених з дослідження з будь-якої причини, у тому числі через недостатність терапевтичного ефекту або небажані явища, був нижчим у групі декс-кетопрофену, ніж у групі кеторолаку. Небажані ефекти при використанні кеторолаку виникали частіше, ніж при використанні декскетопрофену: у 24 і 16 % пацієнтів відповідно [23].
Порівняння декскетопрофену з лорноксикамом проводили при оцінці післяопераційного болю та опіоїдзберігаючого ефекту після великих ортопедичних операцій. Декскетопрофен вводили у дозі 50 мг, а лорноксикам 8 мг внутрішньовенно 2 рази на добу. У дослідженні було встановлено, що декскетопрофен перевершує лорноксикам з точки зору аналгетичної ефективності та сприяє меншому використанню опіоїдів [24].
Ефективність запобіжного знеболювання з порівнянням декскетопрофену і парацетамолу проводили при планових оперативних втручаннях з приводу дискектомії в поперековому відділі хребта у 75 пацієнтів. Пацієнт отримував перорально 25 мг декскетопрофену, або 500 мг парацетамолу, або плацебо за 30 хвилин до введення анестезії. У подальшому знеболювання проводилося за потребою, з використанням морфію. Дослідження продемонструвало, що використання декскетопрофену 25 мг було пов’язано зі зменшенням використання морфію на 35 % протягом 24 годин після операції порівняно з плацебо. Парацетамол у дозі 500 мг не виявив очікуваного опіоїдзберігаючого ефекту [25].
Одним із нових напрямків використання декскетопрофену є лікування гострих нападів мігрені. Було встановлено, що декскетопрофен покращує контроль болю протягом 48 годин і зменшує потребу у використанні інших протимігренозних засобів у пацієнтів із нападами мігрені [26].
Так, в одному з досліджень оцінювалися ефективність і переносимість двох доз декскетопрофену порівняно з плацебо. Дев’яносто три пацієнти з принаймні одним нападом мігрені на місяць за попередні 6 місяців були зараховані та рандомізовані до прийому 25 і 50 мг декскетопрофену та плацебо у рандомізованому подвійному сліпому одноцентровому плацебо-контрольованому дослідженні. Первинною кінцевою точкою були безболісні епізоди через 2 години після прийому препарату. Частота безболісних епізодів після прийому 50 мг декскетопрофену була суттєво більшою проти плацебо (33,8 проти 14,7 %, p = 0,0065), тоді як доза 25 мг була ефективнішою, ніж плацебо, хоча різниця не досягала статистичної значущості (23 проти 14,7 %, p = 0,1182) [27].
Також під час дослідження 42 пацієнтів декскетопрофен після внутрішньовенного введення перевершував плацебо в ефективності лікування гострих нападів мігрені (22,3 проти 55,4 %), що вказувало на його значиму ефективність у контролі мігренозних нападів [28].
Перспективним у контролі тяжкого больового синдрому виявилося комбінування декскетопрофену 25 мг з трамадолом в дозі 75 мг. NNT такої комбінації становив 1,6 (95% довірчий інтервал від 1,3 до 2,1). Додавання трамадолу до декскетопрофену призводило до більшого купірування болю протягом тривалого часу (медіана тривалості 8,1 год) [29, 30].
При лікуванні НПЗЗ велике значення має безпека їх використання. Відомо, що неселективні НПЗЗ, до яких відноситься декскетопрофен, можуть викликати побічні дії переважно з боку ШКТ, що необхідно мати на увазі при їх призначенні.
Індуковані НПЗЗ шлунково-кишкові кровотечі є частою причиною госпіталізації. Окрім виразкової хвороби в анамнезі у пацієнта, їх ризик залежить від конкретного препарату та його дози, а також від супутнього лікування [31].
Основні побічні ефекти, характерні для декскетопрофену, як і для всієї групи НПЗЗ, це диспептичні явища (0,1–1 % випадків), озноб, набряки кінцівок, фотосенсибілізація, рідко (0,01–0,1 %) — ерозивно-виразкові ураження шлунково-кишкового тракту, дуже рідко (менше за 0,01 %) — алергічні реакції і бронхоспазм, порушення функції нирок, підвищення артеріального тиску [13].
Особливо цікавими є дослідження з порівняння побічних ефектів НПЗЗ. У дослідженні J. Laporte et al. (2004) було виконано аналіз 4309 випадків кровотечі з ШКТ, діагностованої у пацієнтів старше за 18 років. Після вторинного виключення в аналіз було включено 2813 випадків. Контрольну групу становили 7193 пацієнти. Дослідження проводили у вісімнадцяти лікарнях Італії та Іспанії. Основний показник результату: співвідношення шансів (СШ) кровотечі з верхніх відділів шлунково-кишкового тракту для кожного препарату з урахуванням потенційних змін. Індивідуальні ризики для кожного НПЗЗ залежали від дози. Кеторолак асоціювався з найвищим ризиком (24,7; 95% ДІ 8,0, 77,0). Для нових НПЗЗ ризики були такими: ацеклофенак — 1,4 (95% ДІ 0,6, 3,3), целекоксиб — 0,3 (95% ДІ 0,03, 4,1), декскетопрофен — 4,9 (95% ДІ 1,7, 13,9), мелоксикам — 5,7 (95% ДІ 2,2), 15,0), німесулід — 3,2 (95% ДІ 1,9, 5,6) та рофекоксиб — 7,2 (95% ДІ 2,3, 23,0). Ризик суттєво збільшився у пацієнтів з пептичною виразкою та/або кровотечами у верхніх відділах шлунково-кишкового тракту в анамнезі, а також у тих, хто приймав антиагрегантні препарати. Таким чином, СШ на тлі прийому декскетопрофену становило 4,9, що було нижчим, ніж у мелоксикаму (СШ 5,7) і особливо кеторолаку (СШ 24,7). Більшість випадків кровотеч, які зареєстровані на тлі прийому декскетопрофену, виникали при використанні його добової дози, що перевищує 50 мг. У пацієнтів, які отримували дозу менше за 50 мг, ризик розвитку кровотечі був значно меншим [31].
Оскільки Європейське агентство з лікарських засобів та інші контролюючі органи виявили занепокоєння щодо профілю безпеки НПЗЗ, був оцінений профіль безпеки перорального застосування декскетопрофену трометамолу для лікування гострого легкого та помірного болю різного походження в реальних умовах використання, особливо в умовах первинної медичної допомоги. Проспективне когортне дослідження було розроблене для оцінки переносимості декскетопрофену порівняно з іншими анальгетиками, що часто призначаються. Інтенсивність болю оцінювали на початковому рівні та на 1-й та 7-й дні лікування препаратом за допомогою 100-мм візуальної аналогової шкали. Загалом у дослідження було включено 7337 пацієнтів (середній вік — 46 [33–61] років); порівнювали декскетопрофен (n = 5429), диклофенак (n = 485), ібупрофен (n = 479), парацетамол (n = 459), метамізол (n = 207), ацеклофенак (n = 103), напроксен (n = 74), піроксикам (n = 69) та дексібупрофен (n = 32). Причинами застосування НПЗЗ були: патологія опорно-рухового апарату, головний біль, дисменорея та одонталгія. Метамізол/парацетамол та декскетопрофен показали найнижчу поширеність побічних дій (2,7 та 3,6 % відповідно), тоді як ацеклофенак/диклофенак показали найвищу поширеність (8,2 %) (р < 0,0001). Найчастіше під час лікування НПЗЗ спостерігались порушення, які були пов’язані зі шлунково-кишковим трактом (3,5 % пацієнтів, 84 % усіх побічних дій), з нервовою системою (0,4 %) та шкірою (0,1 %). Більшість з повідомлених порушень (91,3 %) були легкої та помірної інтенсивності (303 із 332), і лише 3,3 % з них вважалися тяжкими (11 із 332). Беручи метамізол/парацетамол як еталонну групу, співвідношення шансів (95%) становили: 1,30 (0,77–2,19) для декскетопрофену, 1,57 (0,79–3,13) для ібупрофену та дексібупрофену, 2,31 (0,64–8,27) для напроксену, 2,63 (0,85–8,15) для піроксикаму та 3,37 (1,87–6,06) для ацеклофенаку/диклофенаку. Таким чином, ці результати підтвердили безпеку перорального використання декс-кетопрофену у пацієнтів з гострим болем різної етіології, що спостерігалося і в попередніх дослідженнях, і підтримують використання декскетопрофену як препарату першої лінії за затвердженими терапевтичними показаннями [32].
В одному з нещодавніх досліджень декскетопрофен використовували у 870 хворих із болем у суглобах, спині, головним болем, дисменореєю тощо. Більшість отримували рекомендовану дозу 50–75 мг/добу протягом у середньому 1 тижня. Виявлялося статистично значиме покращення (р < 0,0001) показників болю серед пацієнтів, незалежно від стану здоров’я та дозування декскетопрофену і тривалості його використання. У досліджуваній популяції спостерігалася низька (2,8 %) частота побічних явищ. Більшість побічних ефектів були несуттєвими і не порушували повсякденне функціонування [33].
Отже, декскетопрофену трометамол — це модифікований неселективний інгібітор ЦОГ зі швидким початком дії, доступний у формі як для перорального, так і для парентерального введення. Одноразова доза декскетопрофену трометамолу забезпечує ефективне знеболювання при лікуванні гострого болю, такого як післяопераційний біль (стоматологічна та нестоматологічна хірургія), ниркова колька, гострі порушення опорно-рухового апарату та дисменорея, а також зменшує споживання опіоїдів у післяопераційному періоді. Він швидко починає діяти і добре переноситься під час короткочасного лікування [34].
Розчин декскетопрофену для ін’єкцій універсальний в плані шляхів його введення: його можна вводити як внутрішньом’язово, внутрішньовенно струминно, так і внутрішньовенно краплинно, що вигідно відрізняє його від багатьох інших знеболюючих НПЗЗ. Рекомендована ін’єкційна доза для дорослих 50 мг кожні 8–12 годин. При необхідності можливе повторне введення засобу з 6-годинним інтервалом. Добова доза становить 150 мг. Для інфузій уміст ампули (2 мл) розводять в 30–100 мл фізіологічного розчину. Аналгезуюча дія настає через 30 хвилин і продовжується 4–8 годин [9, 18].
Використання таблетованих форм декскетопрофену трометамолу (Сертофен) рекомендовано в дозах 12,5 мг кожні 4–6 годин або 25 мг кожні 8 годин, добова доза не повинна перевищувати 75 мг, тобто 1 таблетка 3 рази на добу.
Однак схеми і тривалість використання таблетованого й ін’єкційного декскетопрофену можуть відрізнятися залежно від вираженості і тривалості больового синдрому, а також переносимості препарату.
Так, Т.В. Каймак та ін. (2013) для лікування гострих больових синдромів у поперековій ділянці ефективно використовували таблетований декскетопрофен у дозі 25 мг тричі на добу протягом 5 днів [35].
У дослідженні Е.Ю. Плотникова та ін. (2020) декс-кетопрофен у дозі 25 мг тричі на добу протягом 7 діб показав високу ефективність і безпечність у лікуванні гострого болю в шиї та спині [36].
Для лікування гострого болю в нижній частині спини H. Zippel et al. (2007) безпечно і ефективно використовувався декскетопрофен у дозі 50 мг двічі на добу протягом 2 діб [37].
Слід відзначити, що після використання декскетопрофену парентерально протягом 1–2 діб подальше лікування може бути продовжене з використанням таблетованих форм до повного усунення больового синдрому.
Важливим аспектом у використанні в клінічній практиці декскетопрофену трометамолу (Сертофен) є анонсування фірмою World Medicine, вперше в Україні, виходу нової форми декскетопрофену у вигляді Сертофен гелю для місцевого застосування. Сертофен гель містить 12,5 мг декскетопрофену в 1 г речовини і може використовуватися для місцевого лікування запального процесу та больового синдрому при захворюваннях суглобів, пошкодженні сухожилків і м’язів, зумовленому травмами та дегенеративними процесами. Гель можна використовувати 2–3 рази на добу, втираючи в уражену ділянку. Тривалість лікування може становити до 7 діб. Добра переносимість препарату та практична відсутність побічних дій робить цю форму препарату альтернативою при протипоказаннях чи непереносимості інших форм НПЗЗ.
Висновки
Декскетопрофену трометамол (препарат Сертофен фірми World Medicine) — це модифікований неселективний інгібітор ЦОГ з найшвидшим початком дії (15–30 хв) порівняно з іншими НПЗЗ, доступний у формі як для перорального, так і для парентерального (внутрішньовенно струминно або краплинно) введення.
Одноразові та повторні дози декскетопрофену трометамолу (Сертофен) забезпечують ефективне знеболювання при лікуванні гострого ноцицептивного та змішаного больового синдрому різного походження та ступеня тяжкості.
Рекомендована ін’єкційна доза для дорослих — 2 мл (50 мг) кожні 8–12 годин. При необхідності можливе повторне введення засобу з 6–8-годинним інтервалом у середньому 2–3 доби (добова доза становить 150 мг), з наступним можливим переходом на пероральну форму. Пероральні форми можна ефективно і безпечно використовувати по 1 табл. (25 мг) 2–3 р/добу (добова доза становить 75 мг/добу), у середньому 5–7 діб. Форма гелю може використовуватися для місцевого лікування протягом 7 діб.
Висока протизапальна активність препарату поєднується з коротким періодом напіввиведення та сприятливим профілем безпеки і переносимості, що обумовлює його широке використання як на стаціонарному, так і на амбулаторному рівні, включаючи використання у поліморбідних пацієнтів.
Конфлікт інтересів. Не заявлений.
Список литературы
1. Raja S.N., Carr D.B., Cohen M., et al. The revised International Association for the Study of Pain definition of pain: concepts, challenges, and compromises. Pain. 2020. 161(9). 1976-1982. doi: 10.1097/j.pain.0000000000001939.
2. Treede R.D., Rief W., Barke A., et al. Chronic pain as a symptom or a disease: the IASP classification of chronic pain for the international classification of diseases (ICD-11). Pain. 2019. 160(1). 19-27. doi: 10.1097/j.pain.0000000000001384.
3. Woolf C.J. Central sensitization: implications for the diagnosis and treatment of pain. Pain. 2011. 152(3). 2-15. doi: 10.1016/j.pain.2010.09.030.
4. Freynhagen R., Parada H.A., Calderon-Ospina C.A., et al. Current understanding of the mixed pain concept: a brief narrative review. Curr. Med. Res. Opin. 2019. 35(6). 1011-1018. doi: 10.1080/03007995.2018.1552042.
5. Rosenberger D.C., Blechschmidt V., Timmerman H., Wolff A., Treede R.-D. Challenges of neuropathic pain: focus on diabetic neuropathy. Journal of Neural Transmission. 2020. 127(4). 589-624. doi: 10.1007/s00702-020-02145-7.
6. Жумалиева В.А. Современные представления о патогенезе нейропатической хронической боли. Медицина и экология. 2015. № 4. С. 25-32.
7. Trouvin A.-P., Perrot S. New concepts of pain. Best Practice & Research Clinical Rheumatology. 2019. 33(3). 101415. doi: 10.1016/j.berh.2019.04.007.
8. Chimenti R.L., Frey-Law L.A., Sluka K.A. Mechanism-Based Approach to Physical Therapist Management of Pain. Phys. Ther. 2018. 98(5). 302-314. doi: 10.1093/ptj/pzy030.
9. Соловьева Э.Ю., Карнеев А.Н., Иваноков А.Н., Джутова Э.Д. Декскетопрофен в лечении острой боли в спине. Неврология и психиатрия. 2012. № 5. С. 36-40.
10. Романенко И.Г., Горобец С.М., Коняева Е.И. и др. Применение нестероидных противовоспалительных лекарственных средств в детской стоматологии. Таврический медико-биологический вестник. 2012. № 15(4). С. 320-323.
11. Побел Е.А. Сравнительное исследование препарата Дексалгин и других анальгетиков, применяемых для послеоперационного обезболивания. Поликлиника. 2012. № 2. С. 40-42.
12. Торшин И.Ю., Громова О.А., Федотова Л.Э., Громов А.Н. Сравнительный хемореактомный анализ декскетопрофена, кетопрофена и диклофенака. Неврология, нейропсихиатрия, психосоматика. 2018. № 10(1). С. 47-54. doi:10.14412/2074-2711-2018-1-47-54.
13. Пилипович А.А. Декскетопрофен: возможности применения в неврологии. Consilium Medicum. 2018. № 20(9). С. 71-75. doi: 10.26442/2075-1753_2018.9.71-75.
14. Чичасова Н.В. Новые подходы к купированию острого болевого синдрома в ревматологии и неврологии. Consilium Medicum. 2009. № 11(2). С. 50-55.
15. Пчелинцев М.В. Болевой синдром в онкологии. Возможности применения декскетопрофена. Медицинский совет. 2020. № 9. С. 146-154. doi: 10.21518/2079-701X-2020-9-146-154.
16. Romero-Alejo E., Puig M.M., Romero A. Antihyperalgesic effects of dexketoprofen and tramadol in a model of postoperative pain in mice — effects on glial cell activation. J. Pharm. Pharmacol. 2016. 68(8). 1041-50. doi: 10.1111/jphp.12584.
17. Mirandaa H.F., Sierraltab F., Arandab N., Noriegaa V., Prietoa J.C. Pharmacological profile of dexketoprofen in orofacial pain. Pharmacological Reports. 2016. 68(6). 1111-1114. DOI: 10.1016/j.pharep.2017.08.003
18. Трухан Д.И., Багишева Н.В., Голошубина В.В., Коншу Н.В. Возможности декскетопрофена в лечении болевого синдрома на этапе оказания первичной медико-санитарной помощи. Международный журнал прикладних и фундаментальных исследований. 2017. № 5. С. 263-268.
19. Moore R.A., Barden J. Systematic review of dexketoprofen in acute and chronic pain. BMC Clin. Pharmacol. 2008. 8. 11. doi: 10.1186/1472-6904-8-11.
20. Ong C.K.S., Lirk P., Tan C.H., Seymour R.A. An Evidence-Based Update on Nonsteroidal Anti-Inflammatory Drugs. Clinical Medicine & Research. 2007. 5(1). 19-34. doi: 10.3121/cmr.2007.698.
21. Brzeziński K., Wordliczek J. Comparison of the efficacy of dexketoprofen and diclofenac in treatment of non-specific low back pain. Ann. Agric. Environ. Med. 2013. 1. 52-56.
22. Anıl A., Kaya F.N., Yavaşcaoğlu B., Efe E.M., Türker G., Demirci A. Comparison of postoperative analgesic efficacy of intraoperative single-dose intravenous administration of dexketoprofen trometamol and diclofenac sodium in laparoscopic cholecystectomy. Journal of Clinical Anesthesia. 2016. 32. 127-133. doi.org/10.1016/j.jclinane.2016.02.020.
23. Rodriguez M., Contreras D., Galvez R., et al. Double-blind evaluation of short-term analgesic efficacy of orally administered dexketoprofen trometamol and ketorolac in bone cancer pain. Pain. 2003. 104(1–2). 103-110. doi: 10.1016/S0304-3959(02)00470-0.
24. Sivrikoz N., Koltka K., Güresti E., Büget M., Şentürk M., Özyalçin S. Perioperative dexketoprofen or lornoxicam administration for pain management after major orthopedic surgery: a randomized, controlled study. AĞRI. 2014. 26(1). 23-28. doi: 10.5505/agri.2014.09821
25. Kesimci E., Gümüş T., İzdeş S., Şen P., Kanbak O. Сomparison of efficacy of dexketoprofen versus paracetamol on postoperative pain and morphine consumption in laminectomy patients. AĞRI. 2011. 23(4). 153-159. doi: 10.5505/agri.2011.86548.
26. Yang B., Xu Z., Chen L., Chen X., Xie Y. The efficacy of dexketoprofen for migraine attack. A meta-analysis of randomized controlled studies. Medicine. 2019. 98(46). e17734. doi: 10.1097/MD.0000000000017734.
27. Mainardi F., Maggioni F., Pezzola D., Zava D., Zanchin G. Dexketoprofen Trometamol in the Acute Treatment of Migraine Attack: A Phase II, Randomized, Double-Blind, Crossover, Placebo-Controlled, Dose Optimization Study. The Journal of Pain. 2014. 15(4). 388-394. doi: 10.1016/j.jpain.2013.12.006.
28. Gungor F., Akyol K.C., Kesapli M., et al. Intravenous dexketoprofen vs placebo for migraine attack in the emergency department: A randomized, placebo-controlled trial. Cephalalgia. 2016. 36(2). 179-184. doi: 10.1177/0333102415584604.
29. Andrew Moore1 R., Gay-Escoda C., Figueiredo R., et al. Dexketoprofen/tramadol: randomised double-blind trial and confirmation of empirical theory of combination analgesics in acute pain. The Journal of Headache and Pain. 2015. 16. 60. doi 10.1186/s10194-015-0541-5.
30. Varrassi G., Hanna M., Macheras G., et al. Multimodal analgesia in moderate-to-severe pain: a role for a new fixed combination of dexketoprofen and tramadol. Curr. Med. Res. Opin. 2017. 33(6). 1165-1173. doi: 10.1080/03007995.2017.1310092.
31. Laporte J-R., Ibáñez L., Vidal X., Vendrell L., Leone R. Upper gastrointestinal bleeding associated with the use of NSAIDs: newer versus older agents. Drug Saf. 2004. 27(6). 411-20. doi: 10.2165/00002018-200427060-00005.
32. Carne X, Rios J., Torres F. Postmarketing cohort study to assess the safety profile of oral dexketoprofen trometamol for mild to mode-
rate acute pain treatment in primary care. Methods and Findings in Experimental and Clinical Pharmacology. 2009. 31(8). 533-40. doi: 10.1358/mf.2009.31.8.1419070.
33. Rey-Matias R.R., Leochico C.F.D., Nilo G.S. Effectiveness and Safety of Oral Dexketoprofen for Mild to Moderate Pain among Filipino Adults: A Post-marketing Surveillance Study. J. Pain Relief. 2018. 7. 319. doi: 10.4172/2167-0846.1000319.
34. Hanna M., Moon J.Y. A review of dexketoprofen trometamol in acute pain. Current Medical Research and Opinion. 2019. 35(2). 189-202. doi: 10.1080/03007995.2018.1457016.
35. Каймак Т.В., Калиева А.К., Оспанов Б.Т., Чайко В.И., Ишмухаметов Р.Ш. Боль в спине: купирование острых болевых синдромов поясничной области вертеброгенного генеза. Mедицина. 2013. № 11. С. 53-56.
36. Плотникова Е.Ю., Золотухина В.Н., Исаков Л.К. и др. Эффективность и безопасность различных нестероидных противовоспалительных препаратов при острой боли в шее и спине. Неврология, нейропсихиатрия, психосоматика. 2020. № 12(2). С. 42-47. doi: 10.14412/2074-2711-2020-2-42-47.
37. Zippel H., Wagenitz A. multicentre, randomised, double-blind study comparing the efficacy and tolerability of intramuscular dexketoprofen versus diclofenac in the symptomatic treatment of acute low back pain. Clin. Drug Investig. 2007. 27(8). 533-43. doi: 10.2165/00044011-200727080-00002.

/95_2.jpg)
/95.jpg)
/96.jpg)
/97.jpg)