Журнал «Актуальная инфектология» Том 7, №5-6, 2019
Вернуться к номеру
Лікування гельмінтозів. Сучасний погляд на проблему
Авторы: Крамарьов С.О., Закордонець Л.В.
Національний медичний університет імені О.О. Богомольця, м. Київ, Україна
Рубрики: Инфекционные заболевания
Разделы: Справочник специалиста
Версия для печати
У статті подані сучасні погляди на проблему гельмінтозів. Висвітлено питання впливу гельмінтів на організм людини. Описано побічні реакції антигельмінтних препаратів і можливі способи запобігання їх розвитку.
В статье представлены современные взгляды на проблему гельминтозов. Освещены вопросы влияния гельминтов на организм человека. Описаны побочные реакции антигельминтных препаратов и возможные способы предупреждения их развития.
The article presents modern views on the problem of helminthiases. The questions of the influence of helminths on the human body are highlighted. Adverse reactions of anthelmintic drugs and possible ways to prevent their development are described.
гельмінтози; діти; лікування; антигельмінтні препарати
гельминтозы; дети; лечение; антигельминтные препараты
helminthiases; children; treatment; anthelmintic drugs
З огляду на значне поширення й різноманітність негативного впливу на організм гельмінтози залишаються актуальною світовою проблемою медицини.
Залежно від шляхів поширення паразитів і особливостей їх біології гельмінти поділяються на 3 групи:
— біогельмінти;
— геогельмінти;
— контактні гельмінти.
У біогельмінтів цикл розвитку залежить від зміни хазяїв: в організмі проміжного хазяїна проходять стадії яєць і личинок, а в організмі остаточного хазяїна гельмінт досягає статевої зрілості. До біогельмінтозів належать опісторхоз, теніоз, ехінококоз, трихінельоз, дифілоботріоз. Людина заражається біо–гельмінтами, вживаючи в їжу недостатньо термічно оброблені заражені м’ясо й рибу. Також зараження може відбуватися при ковтанні під час купання зараженої личинками води, при використанні цієї води для миття овочів, фруктів, посуду.
Яйця геогельмінтів дозрівають у ґрунті. Зараження відбувається при ковтанні яєць, що можуть перебувати на овочах, фруктах, немитих руках, у некип’яченій воді. До геогельмінтозів належать токсокароз, аскаридоз, анкілостомоз, некатороз, трихоцефальоз. Інфекції, що викликаються Ascaris lumbricoides, Trichuris trichiur, Necator americanus, Ancylostoma duodenale і Ancylostoma ceylanicum, є основними кишковими гельмінтними інфекціями в людей [1]. Сьогодні приблизно чверть населення земної кулі заражена геогельмінтами [2]. В ендемічних регіонах понад 70 % населення можуть бути інфіковані ними [3].
До гельмінтозів, що передаються контактним шляхом, належать ентеробіоз і гіменолепідоз. Зараження цими хворобами відбувається при особистому контакті здорової людини з людиною, що має інвазію, при використанні загального посуду, предметів туалету, білизни, також можливе самозараження (автоінвазія).
За даними ВООЗ, інфекції, викликані гельмінтами, є більш серйозною причиною поганого стану здоров’я дітей у віці від 5 до 15 років, ніж будь-яка інша інфекція [2]. Серед інфікованих геогельмінтами приблизно 5–10 % становлять діти віком до двох років [4]. Ascaris lumbricoides і Trichuris trichiura є переважаючими гельмінтними інфекціями в ранньому дитинстві, випадки зараження якими зареєстровані навіть у дітей першого року життя [4, 5].
Гельмінти чинять на організм багатогранний і різноспрямований вплив. Клінічно гельмінтози характеризуються широким розмаїттям проявів: від безсимптомного носійства до вкрай тяжких, загрозливих для життя станів, що залежить від виду гельмінтів, їх кількості, сприйнятливості організму хазяїна і низки інших факторів [6]. Гельмінтози можуть призводити до зниження імунітету, хронічної інтоксикації, затримки психічного й фізичного розвитку дітей, гіпотрофії, викликати алергізацію організму, ураження органів дихання й шлунково-кишкового тракту, сприяти розвитку анемії, гіповітамінозу, міалгії, лімфаденопатії, пухлин [4, 6].
Кишкові гельмінти сприяють пригнічення синтезу Th1-цитокінів, що призводить до зниження місцевого й загального імунітету організму хазяїна. Цей сприяє зараженню й розвитку вторинної інфекції. Особи, заражені гельмінтами, набагато частіше інфікуються туберкульозом, гепатитом, черевним тифом, шигельозом. Також при гельмінтозах зростає ризик розвитку злоякісних новоутворень [6].
При паразитуванні в шлунково-кишковому тракті гельмінти порушують всмоктування жирів, вітамінів (особливо вітаміну А), сприяють порушенню всмоктування й збільшенню втрат поживних речовин [4], викликають тимчасову непереносимість лактози [7]. Ці порушення найбільше виражені при зараженні аскаридами й трихінелами. У дітей часто знижуються апетит, збільшення маси тіла, відбувається затримка розвитку, погіршується успішність у школі [4].
При спостереженні за розвитком дітей, інфікованих геогельмінтами у віці від одного до двох років, встановлено, що вони мали вірогідно нижчі когнітивні показники у віці від двох до п’яти років порівняно з тими дітьми, які ніколи не були зараженими. Також було виявлено, що зараження геогельмінтами один раз протягом другого року життя пов’язане з більш низькими показниками розвитку мовлення у віці від двох до п’яти років [8].
Аналізуючи дані останніх досліджень, можна підсумувати, що гельмінти чинять на організм швидше імуномодулюючу дію, а не імунодепресивну. Імуномодуляція реалізується двома шляхами: 1) завдяки індукції Th2-відповіді синтезуються специфічні цитокіни, включно з IL-4, IL-5 і IL-13, IgE, еозинофілами, мастоцитами; 2) через активацію регуляторної відповіді із синтезом протизапальних цитокінів (IL-10, TGF-β, регуляторні T- (Treg) і B- (Breg) клітини, альтернативно активовані макрофаги) [9].
Зміни в імунітеті залежать від стадії зараження гельмінтами. У групі пацієнтів із цілорічним алергічним ринітом у гострій стадії гельмінтозу (аскаридоз і токсокароз) спостерігалося підвищення кількості фагоцитуючих клітин і їх поглинальної здатності, підвищення здатності до утворення активних форм кисню. Ці зміни вказують на гіперреактивність імунної системи. Однак у групі пацієнтів із хронічною стадією гельмінтозу спостерігалася зворотна картина: зниження кількості фагоцитуючих клітин і їх поглинальної здатності, зниження киснеутворення. Ці зміни вказують на зниження імунітету, що сприяє персистенції бактеріальних і вірусних інфекцій, активації автоімунних захворювань [10].
Гельмінтози можуть супроводжуватися формуванням різних типів алергічних реакцій: анафілактичних, імунокомплексних і клітинно-опосередкованих.
Незалежно від виду гельмінтозу при міграції тканинних гельмінтів виникають алергічні реакції на продукти обміну личинок. Міграційна стадія може супроводжуватися утворенням еозинофільних інфільтратів, поліморфними висипаннями на шкірі, гіпереозинофілією [6]. Гельмінти можуть як сприяти формуванню алергічних захворювань (атопічного дерматиту, алергічної кропив’янки, бронхіальної астми, полінозу, харчової алергії), так і обтяжувати перебіг уже наявних алергічних станів. Алергічні реакції особливо посилюються при зараженні Ascaris, Anisakidae, Strongyloides spp., Toxocara spp. Ascaris lumbricoides є фактором ризику розвитку астми [11]. Численні дослідження дозволили проаналізувати зв’язок між IgE проти аскарид і симптомами астми, у цілому виявивши сильні позитивні асоціації наявності специфічних IgE із задишкою, астмою і гіперреактивністю бронхів [12, 13]. Присутність антиаскаридозних IgE була пов’язана із сенсибілізацією IgE до аероалергенів, що може бути обумовлено більш високим ступенем атопії в дітей із задишкою/астмою на тлі аскаридозу або прямим впливом на реактивність дихальних шляхів запалення, викликаного личинками аскарид, які мігрують через легені. Наявність у дитини антиаскаридозних IgE-антитіл була більш значуща для підвищення чутливості до поширених алергенів і розвитку бронхіальної астми, ніж сімейний алергологічний анамнез [14].
При цьому хронічні паразитарні інфекції сприяють модуляції Th2-імунітету, що сприяє виживанню паразита [12]. Регуляція імунітету хазяїна при хронічних геогельмінтних інфекціях може впливати не тільки на відповідь на антигени паразита, але і на інші екзогенні антигени, наприклад антигени вакцин, аероалергени. Дослідження, проведені серед дітей і дорослих, показують, що супутні геогельмінтні інфекції можуть пригнічувати захисні імунні реакції як на парентеральні [15], так і пероральні [16] вакцини, вираженість алергічної реакції в шкірних тестах [17], які використовуються як маркер атопічної або алергічної сенсибілізації. Виявлено, що після проведення дегельмінтизації спостерігалося підвищення атопічної сенсибілізації шкіри в дітей у Венесуелі [17], Габоні [18], В’єтнамі [19]. У дослідженнях, проведених в Уганді, виявлено, що діти, народжені від матерів, інфікованих гельмінтами, мають менший ризик розвитку екземи, ніж діти, які народилися від здорових матерів (9 проти 39 % відповідно) [20]. При цьому лікування матерів у другому або третьому триместрі вагітності одноразовою дозою альбендазолу було пов’язане з підвищеним ризиком виявлення екземи в дітей протягом першого року життя.
Однак у дослідженнях, проведених в Еквадорі, не було виявлено зниження частоти екземи, атопії і задишки в немовлят протягом перших трьох років життя за наявності геогельмінтів у їх матерів під час вагітності [12]. Із 2090 обстежених дітей геогельмінти виявлялися у 34,1 % дітей до трьох років життя і 45,5 % матерів під час вагітності [13]. Серед цих дітей до 5-річного віку задишка й астма були зареєстровані в 5,7 і 12,6 % обстежених дітей відповідно. Отже, у дітей до 5-річного віку зростав ризик задишки за наявності геогельмінтів у матерів, на той час як зараження гельмінтами, особливо протягом третього року життя, було пов’язане зі зниженням ризику задишки і астми. Можливо, різниця в результатах пов’язана з різними видами геогельмінтів: в Уганді переважав анкілостомоз (у 44 % матерів), а в Еквадорі — аскаридоз (у 27,5 %). Материнський аскаридоз в Еквадорі був пов’язаний з підвищеним ризиком екземи в дітей, але зі зниженим ризиком атопічної сенсибілізації шкіри до всіх алергенів. Останній ефект не був пов’язаний з інтенсивністю інфекції і зараженням дітей гельмінтами протягом перших 2 років життя.
Характер і вираженість алергічної реакції при гельмінтозах залежать від виду паразита, генетичних особливостей організму хазяїна, стадії інвазії. Рано набуті і/або тривалі інфекції захищають від алергії, на той час як більш пізнє зараження і/або короткочасні інфекції підсилюють алергічні симптоми [12, 13]. Цікаво, що інфекція низької інтенсивності, ймовірно, посилює алергічні розлади на відміну від тяжкої інфекції [12]. Генетично сприйнятливі люди більш схильні до ризику розвитку алергії у відповідь на зараження гельмінтами [16].
При діагностиці алергій слід враховувати, що деякі гельмінти (наприклад, Ascaris lumbricoides) мають перехресну реактивність з тропоміозинами кліщів домашнього пилу, що може давати хибнопозитивні результати при проведенні алергопроб [6, 14].
Паразитарні інфекції можуть викликати запалення в червоподібному відростку й клінічно імітувати гострий апендицит. Види Enterobius vermicularis і Taenia є одними з найбільш поширених паразитарних агентів, що викликають гострий апендицит [22]. Згідно з останніми даними, у 32 (1,3 %) із 2400 пацієнтів, прооперованих із приводу гострого апендициту, були виявлені паразити [22].
Також Toxocara canis, Ancylostoma caninum, Strongyloides stercoralis, Ascaris lumbricoides при субретинальній локалізації можуть викликати нейроретиніти, що за відсутності лікування прогресують до атрофії зорового нерва з дифузними змінами пігментного епітелію сітківки [23].
Ентеробіоз є одним з найпоширеніших гельмінтозів у світі. За даними літератури, до 200 мільйонів осіб у всьому світі інфіковані гостриками (Enterobius vermicularis), причому на дітей віком від 5 до 10 років припадає понад 30 % випадків [24]. E.vermicularis передається контактним шляхом між людьми. Сліпа кишка є основним місцем проживання гостриків, самка мігрує зазвичай вночі й відкладає до 15 000 яєць у ділянці ануса. За відсутності автоінфікування хазяїна зараження зазвичай триває всього 4–6 тижнів [24]. Хоча зараження гостриками може бути безсимптомним у більшості пацієнтів, у деяких з них відзначається періанальний свербіж, особливо вночі, безсоння, занепокоєння й дратівливість [24]. Це може супроводжуватися порушенням концентрації уваги, емоційною нестабільністю або енурезом [25]. При проникненні в піхву гострики можуть висхідним шляхом потрапити в матку, фаллопієві труби, яєчники, очеревину. Гострики можуть викликати серйозні захворювання, такі як апендицит і еозинофільний ентероколіт, запальні захворювання органів малого таза, інфекції сечовивідних шляхів [24]. Міграція гостриків в уретру зустрічається рідко, але при цьому вони можуть переносити Escherichia coli та інші бактерії з прямої кишки в сечовивідні шляхи й сприяти розвитку рецидивуючих інфекцій сечовивідних шляхів, особливо в дітей [26].
При масивній інвазії гостриками можливий розвиток діареї за рахунок запалення стінки сліпої кишки, що є місцем проживання гостриків. Також розвиток діареї при ентеробіозі пов’язують з порушенням процесів всмоктування й перетравлювання харчових продуктів, порушенням нормального складу мікробної флори кишечника. Тривалий перебіг ентеробіозу супроводжується розвитком періанального дерматозу, появою тріщин.
Аскаридоз також належить до найбільш поширених глистяних інвазій у світі [27]. У більшості випадків захворювання перебігає безсимптомно або з мінімальними симптомами з боку шлунково-кишкового тракту, але іноді може призводити до тяжких ускладнень. У період міграції личинок у легені можуть спостерігатися кашель, задишка, кровохаркання, а при масивній інвазії — гарячка, еозинофільні запалення легенів, кропив’янка. Кишкова фаза супроводжується симптомами ураження шлунково-кишкового тракту. Аскариди виділяють інгібітори трипсину й хімотрипсину, у результаті чого погіршуються процеси травлення й всмоктування білків, жирів, мікроелементів, вітамінів, може знижуватися толерантність до лактози. Це призводить до анемії, гіпотрофії, гіповітамінозу, затримки фізичного й розумового розвитку. До ускладнень при кишковій фазі аскаридозу належать непрохідність кишечника, апендицит, перитоніт, аскаридоз печінки й жовч–них шляхів [28].
Ехінококоз людини є паразитарною хворобою, що викликається стрічковими черв’яками роду Echinococcus. З відомих шести видів Echinococcus тільки чотири викликають захворювання в людей: Echinococcus granulosus (викликає кістозний ехінококоз), Echinoccus multilocularis (викликає альвеолярний ехінококоз), E.vogeli і E.oligarthrus (викликають полікістозний ехінококоз). У людей кістозний ехінококоз і альвеолярний ехінококоз мають особливе значення через значне географічне поширення й медико-економічний вплив. Кістозний ехінококоз поширений у всьому світі й виявляється на всіх континентах, окрім Антарктиди. Альвеолярний ехінококоз обмежений Північною півкулею, зокрема деякими районами Китаю, Росії, країнами Європи й Північної Америки [29].
У всьому світі понад мільйон людей заражені ехінококозом. В ендемічних районах показники захворюваності людей на ехінококоз можуть перевищувати 50 осіб на 100 000 населення на рік, а в деяких частинах Аргентини, Перу, Східної Африки, Центральної Азії і Китаю рівні поширеності серед населення можуть досягати 5–10 %. За оцінками експертної групи ВООЗ, створеної в 2015 році, у всьому світі ехінококоз щорічно викликає 19 300 випадків смерті [29]. Деякі із заражених людей можуть мати тяжкі клінічні синдроми, які за відсутності лікування можуть становити загрозу для життя. Навіть при лікуванні якість життя людей часто погіршується. При кістозному ехінококозі коефіцієнт постопераційної смертності при хірургічному лікуванні пацієнтів становить в середньому 2,2 %, і в 6,5 % випадків після операції спостерігаються рецидиви, що вимагають тривалого відновного періоду [29].
Інфікування людей відбувається при проковтуванні яєць паразита, що містяться в заражених харчових продуктах, воді, ґрунті, або після прямого контакту з твариною, яка є хазяїном паразита. При ковтанні яєць стрічкового черв’яка з них вивільняються онкосфери, які надалі мігрують у печінку або легені, рідше — в мозок, кістки, нирки, селезінку, м’язи або інші органи, де потім формуються кісти. Безсимптомний інкубаційний період хвороби може тривати багато років доти, поки кісти не досягнуть певних розмірів. Ультразвукові дослідження жителів Південної Америки виявили, що середній діаметр кіст у безсимптомних носіїв становить приблизно 4 см, а при появі симптомів — 10 см [30]. Кісти в печінці спричиняють біль у ділянці живота, нудоту, блювання, гепатомегалію, холестаз, біліарний цироз печінки, портальну гіпертензію, асцит, жовтяницю, утворення внутрішньоцистного або піддіафрагмального абсцесу; кісти в легенях можуть викликати біль, хронічний кашель, кровохаркання, задишку [31]. Близько 0,5–2 % пацієнтів із кістозним ехінококозом мають ураження серця, у тому числі кісти у стінці коронарної артерії, міжшлуночковій перегородці, у порожнинах серця [32]. Неспецифічні ознаки захворювання включають анорексію, втрату ваги й слабкість. За відсутності лікування ехінококоз прогресує і може призводити до летального кінця [29].
Існує великий арсенал протигельмінтних препаратів, що різняться за спектром активності, фармакодинамікою, профілем безпеки. На сьогодні препаратом з найширшим спектром активності і профілем безпеки є альбендазол.
Сьогодні впроваджується широкомасштабна програма Всесвітньої організації охорони здоров’я, метою якої є ліквідація геогельмінтозу до 2020 року в ендемічних районах світу. ВООЗ рекомендує періодичне лікування антигельмінтними (альбендазол, мебендазол) засобами без попередньої індивідуальної діагностики всіх дітей дошкільного й шкільного віку, що живуть в ендемічних щодо геогельмінтів районах. ВООЗ не рекомендує проводити індивідуальний скринінг на наявність гельмінтів, оскільки вартість скринінгу в 4–10 разів перевищує вартість самого лікування. Лікування рекомендується проводити один раз на рік, якщо поширеність інфекцій, викликаних геогельмінтами, у спільноті перевищує 20 %, і двічі на рік, якщо поширеність інфекцій перевищує 50 % [2].
Однак у метааналізі 51 дослідження, що проводилися в місцях із середньою і високою поширеністю геогельмінтів, виявили, що через 3, 6 і 12 місяців після дегельмінтизації поширеність A.lumbricoides досягла 26, 68 і 94 % відповідно [33]. Для T.trichiura відповідні показники поширеності реінфікування становили 36, 67, 82 %, а для анкілостомозу — 30, 55, 57 %. Це вказує на необхідність проведення регулярних профілактичних курсів дегельмінтизації в ендемічних регіонах. Однак це може привести до розвитку резистентності до даних препаратів, що вже спостерігається у ветеринарії [1, 33]. Алелі стійкості до бензімідазолу були виявлені в геогельмінтів людини, і відзначалося зростання їх частоти після курсу антигельмінтного лікування [1].
При ехінококозі й цистицеркозі лікування варіює залежно від особливостей паразита, розміру кісти, її розташування й ускладнень і може включати оперативне лікування, аспірацію вмісту кісти і/або тривале лікування альбендазолом (2–4 цикли тривалістю в 28–60 днів із 15-денними перервами між циклами) [34]. Однак комбіноване лікування альбендазолом і празиквантелом викликало більш високу сколіцидну й антицистову активність і з більшою ймовірністю приводило до одужання або поліпшення порівняно з одним альбендазолом [34].
У більшості випадків протигельмінтне лікування переноситься добре, частота побічних реакцій варіює від 0 до 20 % (табл. 1).
Із 243 зареєстрованих у Франції за 14 років спостережень побічних реакцій, пов’язаних із прийомом протигельмінтних препаратів, переважали симптоми з боку шлунково-кишкового тракту (30,5 %), шкірні висипання (29,2 %) і загальноінтоксикаційні симптоми (23,9 %) [36]. Це вказує на доцільність включення в комплекс лікування гельмінтозів антигістамінних препаратів (АГП) і ентеросорбентів. Серед численної групи антигістамінних препаратів актуальними є АГП останнього покоління, що мають високу біодоступність, швидкий початок дії, а також, крім антигістамінної, чинять протиалергічну й протизапальну дію. Сучасний вітчизняний АГП дезлоратадин (Едем), активний метаболіт лоратадину — антигістамінний препарат тривалої дії, що має високу афінність до Н1-рецепторів, випускається у формі сиропу для дітей із 6 місяців, а також у формі таблеток. Едем має високий профіль безпеки й ефективності при тривалому прийомі, чинить виражену протисвербіжну дію, що сприяє покращенню самопочуття й підвищенню якості життя пацієнтів.
У літературі описані випадки виникнення реакцій за типом реакції бактеріолізу (Яриша — Геркс–геймера) при проведенні антипаразитарної терапії гельмінтозів. M. Buslau, W.C. Marsch (1990) описали випадки її появи на тлі антигельмінтної терапії інвазій карликового ціп’яка (Hymenolepis nana), гостриків (Enterobius vermicularis) і волосоголовця (Trichuris trichiura) [37]. Даний факт також вимагає включення в комплексне лікування гельмінтозів з масивною інвазією, інвазією декількома гельмінтами антигістамінних препаратів і ентеросорбентів.
Використання ентеросорбентів сприяє нейтралізації і виведенню токсинів і продуктів обміну, що негативно впливають на метаболічні процеси хворого. Ентеросорбція знижує загальнотоксичне навантаження на організм. Варто відзначити, що використовуваний ентеросорбент повинен мати високу сорбційну ємність, інертність у просвіті кишечника, відсутність негативного впливу на слизову оболонку кишечника, зв’язувати низько- і середньомолекулярні токсичні речовини без нейтралізації молекул альбуміну й транс–портних білків, нетоксичність, відсутність неприємного запаху і смаку, зручну форму випуску. Усі вищеописані властивості має діосмектит (Апсорбін саше, АТ «Фармак»). Важливим аспектом включення в терапію саме діосмектиту є також потовщення й зміцнення слизової оболонки кишечника, посилення його бар’єрної функції (Su H.T. et al., 2005), протизапальна дія речовини.
Серйозні побічні реакції були пов’язані з тривалим прийомом протигельмінтних препаратів у високих дозах. Частота лікарського гепатиту на тлі лікування альбендазолом у пацієнтів з нейроцистерцеркозом зростала при збільшенні дози з 15 до 22,5 мг/кг/добу [38]. Описаний випадок тяжкого ураження печінки при лікуванні ехінококозу печінки альбендозолом у дозі 400 мг 2 рази на день, що проявилося через 6 тижнів лікування й потребувало трансплантації печінки [39].
При дегельмінтизації також слід приділяти увагу усуненню дисбіотичних порушень у кишечнику, тому що видовий і кількісний склад мікрофлори кишечника має тенденцію до зміни при зараженні паразитами. У заражених людей вміст бактерій родини Verrucomicrobiaceae (а саме Akkermansia muciniphila) і Enterobacteriaceae мав тенденцію до збільшення [40]. Можливо, зростання популяції А.muciniphila є наслідком різкого збільшення кількості муцину в кишечнику в інфікованих суб’єктів, бо основна функція А.muciniphila полягає в розкладанні муцину хазяїна [41], що відіграє головну роль у захисті паразитів від імунної відповіді хазяїна [40]. У заражених геогельмінтами людей в Еквадорі, Індонезії, Ліберії спостерігався підвищений вміст умовно-патогенних мікроорганізмів, що належать до типу Firmicutes, включно з рядом Clostridales і родиною Lachnospiraceae [42].
Зараження гельмінтами, особливо при зниженні ваги, прямо корелювало з родом Allobaculum (описаний його зв’язок із запаленням кишечника), що вказує на важливу роль паразитів в енергетичному балансі хазяїна і реакції кишечника [43]. Виявлено, що зниження активності арахідонової кислоти в кишечнику, інфікованому геогельмінтами, може відбуватися через збільшення кількості бактерій, які метаболізують арахідонову кислоту. З огляду на те, що арахідонова кислота є поперед–ником протизапальних лейкотрієнів із протигельмінтною активністю і показала виражений глистогінний ефект при лікуванні шистосомних інфекцій у мишей [43], можливо, завдяки корекції складу мікрофлори можна буде посилити лікування паразитарних інфекцій.
Дані про вміст молочнокислих бактерій в кишечнику інфікованих гельмінтами людей супе–речливі. Одні автори виявляли значне збільшення кількості Firmicutes родини Leuconostocaceae (ряд Lactobacillales) у неінфікованих суб’єктів порівняно з інфікованими гельмінтами людьми. В інших дослідженнях, проведених на людях, експериментально або природним шляхом інфікованих нематодами, не виявили суттєвих зв’язків між зараженням гельмінтами і збільшенням популяції молочнокислих бактерій [44]. Це вказує на необхідність проведення додаткових досліджень для вивчення цього питання.
За даними літератури, кишкова мікробіота реагує на дегельмінтизацію, але не наближається за кількісним складом до неінфікованого стану [40]. Тому додавання пробіотичних препаратів може підвищити ефективність протигельмінтного лікування.
Лактіалє — сучасний синбіотик (пробіотик + пребіотик), що містить комплекс семи корисних бактерій — біфідобактерій, лактобактерій і стрептокока, які в нормі присутні в мікрофлорі кишечника здорової людини, і пребіотик — фруктоолігосахариди. Кожен пакетик містить 7 корисних штамів пробіотичних мікроорганізмів: Lactobacillus casei, Lactobacillus rhamnosus, Streptococcus thermophilus, Bifidobacterium breve, Lactobacillus acidophilus, Bifidobacterium longum, Lactobacillus bulgaricus — сумарно 5,0 × 108 КУО на 1 пакет у Лактіалє малюк і 1,00 × 109 КУО на 1 пакет у Лактіалє для дітей, а також фруктоолігосахариди.
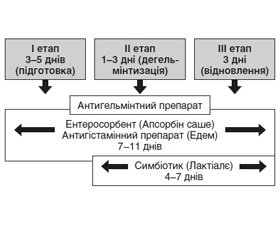
Отже, з огляду на вищезазначене пацієнтам із масивною інвазією гельмінтів, вираженими клінічними проявами гельмінтозу, інвазією декількох гельмінтів можна рекомендувати лікування за схемою: 3–4 дні підготовки (антигістамінний препарат, ентеросорбент), потім прийом антигельмінтного препарату згідно з інструкцією, продовження прийому антигістамінного препарату й ентеросорбенту, потім відновний етап (продовження прийому антигістамінного препарату й ентеросорбенту — 3–4 дні), включення в схему лікування пробіотика протягом 4 тижнів (рис. 1).
У пацієнтів із моноінвазією, відсутністю виражених клінічних проявів достатньо прийому тільки антигельмінтного препарату згідно з інструкцією і пробіотика протягом 4 тижнів.
Конфлікт інтересів. Автори заявляють про відсутність конфлікту інтересів і власної фінансової зацікавленості при підготовці даної статті.
1. Elfawal M.A., Savinov S.N., Aroian R.V. Drug Screening for Discovery of Broad-spectrum Agents for Soil-transmitted Nematodes. Sci Rep. 2019. Vol. 9. P. 12347.
2. WHO. Soil transmitted helminth infections. 2017.
3. Hotez P.J., Brindley P.J., Bethony J.M. et al. Helminth infections: the great neglected tropical diseases. J. Clin. Invest. 2008. Vol. 118(4). P. 1311-1321.
4. Silva N.R. Impact of mass chemotherapy on the morbidity due to soil-transmitted nematodes. Acta Tropica. 2003. Vol. 86(2–3). P. 197-214.
5. Gyorkos T.W., Maheu-Giroux М., Casapía М. et al. Stunting and early helminth infection in preschool-age children in the Amazon lowlands of Peru. Soc. Trop. Med. Hyg. 2011. Vol. 105(4). P. 204-208.
6. Зайков С.В. Взаимоотношения между гельминтозами и аллергическими заболеваниями. Новости медицины и фармации. Аллергология, пульмонология, иммунология. 2009. C. 295.
7. WHO Expert Committee on the Control of Schistosomiasis. Prevention and control of schistosomiasis and soil-transmitted helminthiasis: report of a WHO expert committee. WHO technical report series. Geneva: World Health Organization, 2002. № 912.
8. Blouin B., Casapia М., Joseph L. et al. A longitudinal cohort study of soil-transmitted helminth infections during the se–cond year of life and associations with reduced long-term cognitive and verbal abilities. PLoS Negl. Trop. Dis. 2018. Vol. 12(7). P. 0006688.
9. Hepworth M.R., Grencis R.K., Artis D. Regulation of immunity and inflammation following intestinal helminth infection in parasitic nematodes: molecular biology, biochemistry and immunology. Oxfordshire, UK: CABI, 2013. P. 106-129.
10. Кузнецова Л.В., Бондаренко Т.Н., Пшеничная И.В., Назар О.В. Oсобенности изменения показателей клеточной неспецифической защиты у пациентов с круглогодичным аллергическим ринитом с сопутствующим гельминтозом. Імунологія та алергологія: наука i практика. 2015. № 1. С. 79-84.
11. Leonardi-Bee J., Pritchard D., Britton J. Asthma and current intestinal parasite infection: systematic review and meta-analysis. Am. J. Respir. Crit. Care Med. 2006. 174. Р. 514-523.
12. Cooper P.J., Chico M.E., Vaca M.G. et al. Effect of early life geohelminth infections on the development of wheezing at 5 years of age. Am. J. Respir. Crit. Care Med. 2018. Vol. 197. P. 364-372.
13. Labeaud A.D., Malhotra I., King M.J. Do antenatal pa–rasite infections devalue childhood vaccination? PLoS Negl. Trop. Dis. 2009. Vol. 3. P. 442-10.
14. Dold S., Heinrich J., Wichmann H.E., Wjst M. Ascaris-specific IgE and allergic sensitization in a cohort of school children in the former East Germany. J. Allergy ClinImmunol. 1998. Vol. 102(3). P. 414-420.
15. Cooper P.J., Chico M., Losonsky G. et al. Albendazole treatment of children with ascariasis enhances the vibriocidal antibody response to the live attenuated oral cholera vaccine CVD 103-HgR. J. Infect. Dis. 2000. Vol. 182. P. 1199-1206.
16. Perzanowski M.S., Ng’ang’a L.W., Carter M.C. et al. Atopy, asthma, and antibodies to Ascaris among rural and urban children in Kenya. J. Pediatr. 2002. Vol. 140. P. 582-588.
17. Afifi M.A., Jiman-Fatani A.A., Saadany S.E., Fouad M.A. Parasites-allergy paradox: Disease mediators or therapeutic mo–dulators. J. Microsc. Ultrastruct. 2015. Vol. 3(2). P. 53-61.
18. van den Biggelaar A.H., Rodrigues L.C., van Ree R. et al. Long-term treatment of intestinal helminths increases mite skin-test reactivity in Gabonese schoolchildren. J. Infect. Dis. 2004. Vol. 189. P. 892-900.
19. Flohr C., Tuyen L.N., Lewis S. et al. Poor sanitation and helminth infection protect against skin sensitization in Vietnamese children: a cross-sectional study. J. Allergy Clin. Immunol. 2006. Vol. 118. P. 1305-11.
20. Mpairwe H., Webb E.L., Muhangi L. et al. Anthelminthic treatment during pregnancy is associated with increased risk of infantile eczema: randomised-controlled trial results. Pediatr. Allergy Immunol. 2011. Vol. 22. P. 305-312.
21. Cooper P.J., Chico M.E., Vaca M.G. et al. Effect of early life geohelminth infections on the development of wheezing at 5 years of age. Am. J. Respir. Crit. Care Med. 2018. Vol. 197. P. 364-372.
22. Tayfur M., Balci M.G. Pathological changes in append–ectomy specimens including the role of parasites: A retrospective study of 2400 cases of acute appendicitis. Niger J. Clin. Pract. 2019. Vol. 22(2). P. 270-275.
23. Oman J. Diffuse unilateral subacute neuroretinitis. Pratyusha Ganne and Pankaja Dhoble Ophthalmol. 2019. Vol. 12(1). Vol. 59-61.
24. Fan C.-K., Chuang T.-W., Huang Y.-C. et al. Enterobius vermicularis infection: prevalence and risk factors among preschool children in kindergarten in the capital area, Republic of the Marshall Islands. BMC Infect. Dis. 2019. Vol. 19. P. 536.
25. Kucik C.J., Martin G.L., Sortor B.V. Common intestinal parasites. Am. Fam. Physician. 2004. Vol. 69. P. 1161-1168.
26. Choudhury S., Kumar B., Kumar D.P. Enterobius vermicularis infestation of urinary tract leading to recurrent urinary tract infection. Trop. Parasitol. 2017. Vol. 7(2). P. 119-121.
27. Molina G.A., Torres A.R., Llerena P.S. et al. Ascaris lumbricoides and its almost deadly complication. J. Surg. Case Rep. 2018. Vol. 10. P. 262.
28. Шадрін О.Г., Ковальчук А.А., Дюкарева С.В. Стан шлунково-кишкового тракту та шляхи корекції його порушень при гельмінтозах у дітей. Современная педиатрия. 2015. 5. C. 88-91.
29. Эхинококкоз. URL: https://www.who.int/ru/news-room/fact-sheets/detail/echinococcosis.
30. Larrieu E.J., Frider B. Human cystic echinococcosis: contributions to the natural history of the disease. Ann. Trop. Med. Parasitol. 2001. Vol. 95. P. 679-687.
31. Eckert J., Deplazes P. Biological, epidemiological, and clinical aspects of echinococcosis, a zoonosis of increasing concern. Clin. Microbiol. Rev. 2019. Vol. 32(2). P. 00075-18.
32. Vural U., Aglar A.A., Kayacioglu İ. Intracoronary Hydatid Cyst Resulted in Coronary Artery Disease in a Young Patient. Braz. J. Cardiovasc Surg. 2019. Vol. 34(1). P. 107-110.
33. Jia T-W., Melville S., Utzinger J. ei al. Soil-transmitted helminth reinfection after drug treatment: a systematic review and meta-analysis. PLoS Negl. Trop. Dis. 2012. Vol. 6(5). P. 1621.
34. Velasco-Tirado V., Alonso-Sardón М., Lopez-Bernus А. et al. Medical treatment of cystic echinococcosis: systematic review and meta-analysis. BMC Infect. Dis. 2018. Vol. 5. Supp. 18(1). P. 306.
35. Product Information. Albenza (albendazole). SmithKline Beecham, Philadelphia, PA. URL: https://www.rlsnet.ru/mnn_index_id_2675.htm.
36. Bagheri H., Simiand E. Adverse Drug Reactions to Anthelmintics. Annals of Pharmacotherapy. 2004. Vol. 38(3). P. 383-388.
37. Buslau M., Marsch W.C. Papular eruption in helminth infestation-a hypersensitivity phenomenon? Report of four cases. Acta Derm. Venereol. 1990. V. 70.-P. 526-529.
38. Garcia H.H., Gonzales I., Lescano A.G. et al. Efficacy of combined antiparasitic therapy with praziquantel and albendazole for neurocysticercosis: a double-blind, randomised controlled trial. Lancet Infect. Dis. 2014. Vol. 14(8). P. 687-695.
39. Aasen T.D., Nasrollah L., Seetharam A. Drug-Induced Liver Failure Requiring Liver Transplant: Report and Review of the Role of Albendazole in Managing Echinococcal Infection. Exp. Clin. Transplant. 2018. Vol. 16(3). P. 344-347.
40. Jenkins T.P., Rathnayaka Y., Perera P.K. et al. Infections by human gastrointestinal helminths are associated with changes in faecalmicrobiota diversity and composition. PLoS One. 2017. Vol. 12(9). P. 0184719.
41. Derrien M., Collado M.C., Ben-Amor К. et al. The Mucin degrader Akkermansia muciniphila is an abundant resident of the human intestinal tract. Appl. Environ. Microbiol. 2008. Vol. 74(5). P. 1646-8.
42. Rosa B.A., Supali Т., Gankpala L. et al. Differential human gut microbiome assemblages during soil-transmitted helminth infections in Indonesia and Liberia. Microbiome. 2018. Vol. 6. P. 33.
43. El Ridi R., Tallima Н., Salah М. et аl. Efficacy and mechanism of action of arachidonic acid in the treatment of hamsters infected with Schistosoma mansoni or Schistosoma haematobium. J. Antimicrob. Agents. 2012. Vol. 39. P. 232-239.
44. Cantacessi C., Giacomin P., Croese J. et al. Impact of experimental hookworm infection on the human gut microbiota. J. Infect. Dis. 2014. Vol. 210(9). P. 1431-1434.

/256-1.jpg)
/257-1.jpg)