Журнал «» №3-4 (65-66), 2019
Вернуться к номеру
Аналіз гіполіпідемічної терапії у хворих на артеріальну гіпертензію
Авторы: Батушкін В.В.
ПВНЗ «Київський медичний університет», м. Київ, Україна
Рубрики: Кардиология
Разделы: Справочник специалиста
Версия для печати
Артеріальна гіпертензія (АГ) і порушення ліпідного обміну є одними з найголовніших причин несприятливого серцево-судинного прогнозу, кожна з яких спричиняє розвиток й прогресування захворювань, пов’язаних з атеросклерозом. У багатьох пацієнтів ці чинники ризику присутні разом. У статті на підставі клінічного випадку обґрунтовано необхідність призначення статинів хворому з артеріальною гіпертензією. Наведено клінічний випадок спостереження й лікування АГ у 47-річного пацієнта з дисліпідемією на різних часових етапах з подальшим аналізом сучасної інформації про комбінацію статинів і антигіпертензивних засобів — сартанів у процесі ведення хворих із високим кардіоваскулярним ризиком. Після декількох років ефективного антигіпертензивного лікування артеріальний тиск хворого стабілізувався на цільових рівнях. Він кинув палити, нормалізував масу тіла. Залишилася асимптомна дисліпідемія, яку він медикаментозно не контролював. Під час передостаннього візиту в пацієнта був виявлений неоклюзивний атеросклероз судин нижніх кінцівок, що перебігав асимптомно. З огляду на ознаки судинного атеросклерозу пацієнт потрапляє в групу високого кардіоваскулярного ризику. Йому потрібно призначити інтенсивну статинотерапію.
У цьому випадку важливо вибрати найбільш ефективний і безпечний препарат і відповідну дозу. При перегляді клінічного випадку комбінованого лікування нашого пацієнта кандесартаном (Кантаб) і аторвастатином (Толевас) слід звернути увагу на два моменти, що спровокували розвиток периферичного атеросклерозу. По-перше, до нас звернувся пацієнт молодого віку із симптомами гіпертонії, які вважалися основними для встановлення діагнозу й вибору терапії. Унаслідок цього він і отримував досить ефективне антигіпертензивне лікування. Супутня дисліпідемія мала субклінічний характер, і пацієнт самостійно перестав приймати статини. Високий загальний холестерин вважався лише фактором ризику. По-друге, у своїх медичних рекомендаціях ми керувалися критеріями оцінювання ступеня кардіоваскулярного ризику у хворих з АГ (Наказ МОЗ України від 24.05.2012 № 384), тому не наполягали на деяких етапах інтенсивної статинотерапії, як це рекомендується європейськими й північноамериканськими настановами 2017 року.
Артериальная гипертензия (АГ) и нарушения липидного обмена являются одними из главных причин неблагоприятного сердечно-сосудистого прогноза, каждая из которых способствует развитию и прогрессированию заболеваний, связанных с атеросклерозом. У многих пациентов эти факторы риска присутствуют вместе. В статье на основании клинического случая обоснована необходимость назначения статинов больному с артериальной гипертензией. Приведены клинический случай наблюдения и лечения АГ у 47-летнего пациента с дислипидемией на разных временных этапах с последующим анализом современной информации о комбинации статинов и антигипертензивных средств — сартанов в процессе ведения пациентов высокого кардиоваскулярного риска. После нескольких лет эффективного антигипертензивного лечения артериальное давление больного стабилизировалось на целевых уровнях. Он бросил курить, нормализовал массу тела. Осталась асимптомная дислипидемия, которую он медикаментозно не контролировал. Во время предпоследнего визита у пациента был обнаружен неокклюзивный атеросклероз сосудов нижних конечностей, протекающий асимптомно. С учетом признаков сосудистого атеросклероза пациент попадает в группу высокого кардиоваскулярного риска. Ему нужно назначить интенсивную статинотерапию. В этом случае важно выбрать наиболее эффективный и безопасный препарат и соответствующую дозу. При просмотре клинического случая комбинированного лечения нашего пациента кандесартаном (Кантаб) и аторвастатином (Толевас) следует обратить внимание на два момента, спровоцировавшие развитие периферического атеросклероза. Во-первых, к нам обратился пациент молодого возраста с симптомами гипертонии, которые считались основными для постановки диагноза и выбора терапии. В результате он и получал достаточно эффективное антигипертензивное лечение. Сопутствующая дислипидемия имела субклинический характер, и пациент самостоятельно перестал принимать статины. Высокий общий холестерин считался только фактором риска. Во-вторых, в своих медицинских рекомендациях мы руководствовались критериями оценки степени кардиоваскулярного риска у больных с АГ (Приказ МЗ Украины от 24.05.2012 № 384) и поэтому не настаивали на некоторых этапах лечения интенсивной статинотерапии, как это рекомендуется европейскими и североамериканскими рекомендациями 2017 года.
Arterial hypertension and lipid dysmetabolism are the key causes of unfavourable cardiovascular prognosis. Each of them provokes the development and progression of the diseases associated with atherosclerosis. A lot of patients have both of these factors. The article sounds the necessity of statins administration in hypertensive patients based on a case report. The paper deals with a clinical case of treatment of arterial hypertension in a 47-year-old patient with dyslipidemia at various stages with the further analysis of modern information on the combination of statins and antihypertensive agents sartans for the management of the patients with a high cardiovascular risk. After several years of effective antihypertensive therapy, the patient achieved target blood pressure parameters. He gave up smoking, improved his body mass. The patient presented with asymptomatic dyslipidemia not being controlled with any remedies. Asymptomatic non-occlusive atherosclerosis of the lower extremities was determined within the penultimate visit. Taking into account the signs of artery sclerosis, the patient is considered to be in a high-risk cardiovascular group. He needed intensive therapy with statins. This case requires the most effective and safe remedy and an adequate dose. The analysis of the clinical case of complex treatment of our patient with candesartan (Kantab) and atorvastatin (Tolevas) demonstrates two important factors provoked the peripheral artery disease development. First, a young man sought medical attention for arterial hypertension symptoms, which were the main for diagnosing and choosing the therapy. Concomitant dyslipi-demia was subclinical, and the patient discontinued the use of a medication by himself. A high level of cholesterol was a risk factor. Second, we kept up with the criteria of cardiovascular risk assessment in hypertensive patients (the Order of MH of Ukraine No 384 dated 24.05.2012), thus we did not insist on some stages of intensive statin therapy as the European and North American guidelines, 2017, recommend.
артеріальна гіпертензія в пацієнта середнього віку; модифіковані фактори ризику; дисліпідемія; субклінічний атеросклероз; особливості лікування
артериальная гипертензия у пациента среднего возраста; модифицированные факторы риска; дислипидемия; субклинический атеросклероз; особенности лечения
hypertension in middle-aged patient; subclinical atherosclerosis; features of treatment
Значний прогрес досягнутий у розумінні епідеміології, патофізіології та інших факторів ризику, пов’язаних із розвитком і прогресуванням серцево-судинних захворювань у всьому світі й у нашій країні. Артеріальна гіпертензія (АГ) і порушення ліпідного обміну є одними з найголовніших причин несприятливого серцево-судинного прогнозу, кожна з них спричиняє розвиток і прогресування захворювань, пов’язаних з атеросклерозом. У багатьох пацієнтів ці чинники ризику присутні разом [1, 2]. Так, за даними 3-го національного реєстру NHANES (National Health and Nutrition Examination Survey), близько 15 % населення США страждають від АГ і порушення ліпідного обміну [2].
В Україні поширеність співіснування вказаних факторів ризику також досить висока. Згідно з опублікованими даними В.М. Коваленка, В.М. Карнацького (2016), АГ виявляється в 47,8 % пацієнтів, які страждають від дисліпідемії [3]. При цьому тиск контролюють тільки 51 % хворих, які знають про свій високий артеріальний тиск (АТ) (рис. 1) [4].
Своєчасна нормалізація артеріального тиску і вмісту атерогенних ліпідів у плазмі крові допомагає запобігти прогресуванню серцево-судинних захворювань. У даний час існують препарати, що дозволяють ефективно контролювати АГ і порушення ліпідного обміну. Однак у повсякденній клінічній практиці лише в невеликої кількості (за деякими оцінками, менше ніж у 10 %) пацієнтів вдається досягти цільових значень АТ і цільового рівня холестерину в плазмі крові відповідно до національних рекомендацій [4–6]. Однією з причин цього є низька прихильність (комплаєнтність) пацієнтів щодо лікування. Встановлено, що близько 50 % пацієнтів самостійно припиняють прийом препаратів, рекомендованих лікарем [4].
Загальними причинами низької прихильності до лікування є висока вартість лікарських препаратів, побічні ефекти, а також складність режиму прийому й велика кількість одночасно призначуваних ліків [1–4]. При цьому зменшення кількості препаратів, упровадження нових, більш ефективних засобів сприяє покращанню комплаєнтності хворих на серцево-судинні захворювання [7]. У зв’язку з цим вихід на фармацевтичний ринок досить активних, але менш дорогих генеричних препаратів направлений на створення сприятливих умов для повноцінного лікування хворих з високим кардіоваскулярним ризиком при несприятливому прогнозі.
Поєднання деяких препаратів класу сартанів і статинів у допустимих терапевтичних дозах, що позитивно впливають на перебіг АГ у хворих на дисліпідемію, на сьогодні вважається досить актуальним. Оптимізація лікування таких пацієнтів направлена передусім на зниження ризику виникнення серцево-судинних захворювань найближчим часом і відстрочку розвитку гострої серцевої або церебральної патології на більш пізній час, що є прямою можливістю збільшення індивідуальної тривалості життя.
Широко відомо, що сартани, або блокатори рецепторів ангіотензину ІІ (БРА), реалізують свій терапевтичний вплив шляхом безпосередньої блокади рецепторів 1-го субтипу ангіотензину ІІ і, можливо, за рахунок опосередкованої стимуляції рецепторів 2-го субтипу ендогенним ангіотензином [8–11].
У цілому для БРА, крім основного антигіпертензивного ефекту, описані численні додаткові плейотропні властивості у вигляді протизапального, антиапоптотичного й антипроліферативного ефектів [9]. Також добре відома здатність БРА сприятливо впливати на жорсткість судинної стінки, індукувати відновлення функції ендотелію та зменшувати гіпертрофію міокарда лівого шлуночка, підвищувати чутливість тканин організму людини до інсуліну, переважно за рахунок стимуляції синтезу GLUT-1, GLUT-4 [10]. У клінічному аспекті всі ці ефекти реалізуються в зниженні ризику загальної та кардіоваскулярної смерті, включаючи ризики інсульту, вперше виявленої серцевої недостатності, виникнення й прогресування атеросклерозу, а також зменшення кількості нових випадків цукрового діабету, хронічного захворювання нирок і подовження додіалізного періоду
[1, 2, 9–13].
Хоча БРА, як і інгібітори АПФ, належать до блокаторів ренін-ангіотензинової системи й дуже поширені при лікуванні АГ як в Україні, так і в інших державах Європи (рис. 2), існують відомості, що торкаються низки переваг БРА перед інгібіторами АПФ [14]. На думку деяких фахівців, вони краще контролюють АТ і більш безпечні (рис. 3).
При порівнянні антигіпертензивної терапії в майже 1,5 тисячі хворих, які приймали основні групи препаратів, що знижують тиск (дослідження FLASH- 2), виявлено, що при використанні сартанів 73 % хворих тримали АТ на цільовому рівні (рис. 3) [15].
За результатами аналізу реєстру REACH (40 625 пацієнтів), використання БРА порівняно з інгібіторами АПФ супроводжувалося більш низькою частотою значних кардіоваскулярних подій на амбулаторному етапі лікування у хворих високого серцево-судинного ризику [12]. Безперечно, БРА більш ефективні в запобіганні новим випадкам цукрового діабету 2-го типу й хронічного захворювання нирок [16–18]. Використання БРА при АГ майже на 20 % більш ефективне, ніж будь-яка інша антигіпертензивна стратегія, що не заснована на хронічній блокаді ренін-ангіотензинової системи, і саме за рахунок реалізації клінічно значущої кардіо-, церебро- і ренопротекції [17].
Необхідно наголосити на відмінній переносимості БРА, що характеризувалася низькою частотою побічних реакцій і відмов від лікування з цих причин (порівнянна з плацебо), а також прийнятній вартості лікування.
У своїй статті ми подаємо клінічний випадок спостереження й лікування АГ у хворого з дисліпідемією на різних часових етапах з подальшим аналізом сучасної інформації про комбінацію статинів і антигіпертензивних засобів — сартанів у процесі ведення хворих із високим кардіоваскулярним ризиком.
Хворий на артеріальну гіпертензію С., 47 років, з АТ 160/95 мм рт.ст. звернувся за консультацією у квітні 2017 року. Пацієнт відмічав періодичний головний біль. Під час опитування розповів, що спостерігав підвищені цифри АТ (до 180/110 мм рт.ст.) протягом попередніх 4 років. Епізодично приймав каптоприл із гідрохлортіазидом, периндоприл.
Обстеження, проведене в нашій клініці у 2017 році, виявило ознаки ураження органів-мішеней у вигляді гіпертрофії міжшлуночкової перегородки на ехокардіограмі. Індекс маси міокарда лівого шлуночка становив 126 кг/м2 (нормальний показник — 115 кг/м2).
Було виявлено надлишкову вагу (індекс маси тіла 29,4 кг/м2), підвищення рівнів загального холестерину, тригліцеридів. Палить до 10 цигарок на день.
Під час автоматичного 24-годинного дослідження АТ (рис. 4) на фоні вживання периндоприлу 10 мг на добу максимальний систолічний АТ (САТ) становив 182 мм рт.ст., діастолічний АТ (ДАТ) — 102 мм рт.ст., добовий рівень частоти серцевих скорочень (ЧСС) коливався в межах 63–109 ударів за хвилину.
З антигіпертензивною метою хворому був призначений кандесартан (Кантаб виробництва компанії «Нобель Ілач», Туреччина) 8 мг 1 раз на добу.
З огляду на наявність високого кардіоваскулярного ризику, визначеного за табл. 1, пацієнту прописаний Толевас (аторвастатин) 20 мг для постійного прийому.
Наступний візит до лікаря 06.11.2017 розглядався як профілактичний огляд. Пацієнт скарг не пред’являв. ЧСС — 62 за хвилину, офісний АТ 130/80 мм рт.ст. У легенях везикулярне дихання, хрипів немає. Живіт м’який, безболісний, печінка — нижній край біля краю реберної дуги, фізіологічні відправлення в нормі.
За час, що минув з попереднього візиту, Кантаб (кандесартан) титрувався до добового рівня 32 мг на добу. АТ тримався в межах 120–130/80 мм рт.ст., хворий схуднув на 8 кг, кинув палити.
Лабораторні рівні холестерину й тригліцеридів знизилися до субоптимальних рівнів (загальний холестерин у плазмі становив 4,2 ммоль/л, тригліцериди — 1,4 ммоль/л).
Під час контрольного дослідження АТ протягом доби максимальний САТ становив 138 мм рт.ст., ДАТ — 89 мм рт.ст., добові коливання ЧСС становили 68–113 за хвилину (рис. 5).
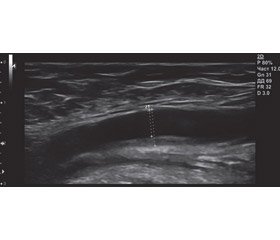
20.03.2018 пацієнт прийшов на профілактичний огляд. Скарг немає. ЧСС — 64 уд/хв, АТ — 124/80 мм рт.ст. Протягом останнього місяця гіполіпідні препарати приймав нерегулярно. Рівні загального холестерину й тригліцеридів у плазмі становили 5,5 ммоль/л і 1,9 ммоль/л відповідно. Пацієнту в процесі обстеження зробили ультразвукове дослідження (УЗД) і допплерівське дослідження судин голови й шиї (рис. 6). Був виявлений уніфокальний неоклюзивний атеросклероз, що перебігав асимптомно.
Згідно з даними УЗД (рис. 6), стінки брахіоцефальних судин ущільнені, потовщені. Товщина комплексу інтима-медіа в дистальних відділах загальної сонної артерії становить справа 1,1 мм, зліва — 0,9 мм. Нижче від біфуркації правої загальної сонної артерії по задній стінці гетерогенна атеросклеротична бляшка довжиною до 10 мм, що виступає в просвіт судини на 2,3 мм.
З огляду на ознаки судинного атеросклерозу пацієнт потрапляє в групу високого кардіоваскулярного ризику, йому необхідно призначати інтенсивну статинотерапію. І в цьому випадку важливо вибрати найбільш ефективний і безпечний препарат і відповідну дозу.
За рекомендаціями Європейського товариства кардіологів 2017 року лікування має бути спрямоване на досягнення цільового рівня ХС ЛПНЩ залежно від серцево-судинного ризику. Відомо, що ці цільові рівні рекомендовані на підставі низки великомасштабних досліджень (ORION, РRОVЕ-IТ, А-to-Z, ТNТ, UPITER та ін.), які свідчать про те, що більш виражене зниження ХС ЛПНЩ під впливом високих доз аторвастатину (80 мг), розувастатину (40 мг) запобігає більшій кількості серцево-судинних подій, ніж використання звичайних режимів ліпідознижуючої терапії (симвастатин 20 мг, аторвастатин 10 мг) [1]. Тому статинотерапія нашого пацієнта була продовжена Толевасом (аторвастатин) 40 мг на добу.
При перегляді клінічного випадку комбінованого лікування нашого пацієнта кандесартаном (Кантаб) і аторвастатином (Толевас) необхідно звернути увагу на два моменти, що спровокували розвиток церебрального атеросклерозу. По-перше, до нас звернувся пацієнт молодого віку із симптомами гіпертонії, які і вважалися основними, провідними для формування діагнозу й вибору терапії. Унаслідок чого він і отримував досить ефективне антигіпертензивне лікування.
Супутня дисліпідемія спочатку мала субклінічний характер, і пацієнт самостійно перестав вживати статини. Високий загальний холестерин вважався лише фактором ризику. По-друге, у своїх медичних рекомендаціях ми керувалися таблицею оцінки ступеня кардіоваскулярного ризику у хворих на АГ (Наказ МОЗ України від 24.05.2012 № 384) і, можливо, тому не наполягали на деяких етапах інтенсивної статинотерапії, як це рекомендується європейськими й північноамериканськими настановами 2017 року [1, 2].
Обговорення
Значна поширеність таких факторів високого кардіоваскулярного ризику, як гіпертензія та дисліпідемія, перебуває в зоні пильної уваги міжнародної медичної спільноти.
Як видно з рис. 7, максимальна поширеність АГ визначалася в 2005–2009 роках (29,9 %), на сьогодні вона повільно знижується й у 2020 році очікується на рівні 26,9 % [15].
Кандесартан вважається найбільш вивченим БРА у лікуванні хворих на АГ високого серцево-судинного ризику. Найбільш значущі результати відомих досліджень подані в табл. 3.
Привертають увагу результати аналізу 14 плацебо-контрольованих досліджень, подані C. Cuspidi, M.L. Muiesan, L. Valagussa еt al. (2002), що включали 2350 хворих на АГ, лікованих кандесартаном у широкому діапазоні доз (2–32 мг на добу), вони засвідчують імовірність зменшення САТ на 8–12 мм рт.ст., ДАТ — на 4–8 мм рт.ст. [37].
За деякими даними вітчизняних кардіологів, після 6 місяців лікування (78 пацієнтів з АГ ІІ ст.) кандесартаном у середній дозі 8 мг на добу систолічний АТ знижувався з 168,8 ± 8,4 мм рт.ст. до 132,4 ± 6,2 мм рт.ст., діастолічний АТ знижувався з 108,6 ± 6,4 мм рт.ст. до 85,4 ± 6,2 мм рт.ст. (p < 0,05) [38]. Ю.М. Сіренко і співавт. (2007) порівнювали антигіпертензивну дію кандесартану 8–16 мг на добу й еналаприлу 20–30 мг за два прийоми. Цільовий рівень офісного АТ досягався в 56 % пацієнтів при використанні кандесартану й у 63,3 % — еналаприлу [39]. Однак побічні явища частіше визначали при використанні еналаприлу (16,7 %), ніж кандесартану (8 %).
У міжнародному дослідженні CATCH вивчалася здатність кандесартану й еналаприлу зменшувати масу міокарда у хворих з АГ й ознаками гіпертрофії лівого шлуночка [37]. При однаковому зниженні АТ у групі кандесартану нормалізація маси міокарда визначалася значно частіше, ніж у групі еналаприлу (38 і 28 % хворих відповідно). T. Ogihara, A. Fujimoto, K. Nakao (2008) визначали більш виражене зниження індексу маси лівого шлуночка в групі кандесартану порівняно з групою амлодипіну [33].
Особливості впливу кандесартану на органи-мішені порівняно з іншими сартанами були продемонстровані R. Cernes, M. Mashavi, R. Zimlichman (2011) за результатами аналізу Шведського реєстру [41]. В аналіз пацієнтів були включені дані 72 центрів первинної медичної допомоги Швеції в період із 1999 по 2007 рік. Серед 24 943 відібраних пацієнтів 14 100 пацієнтів з діагнозом АГ отримували лозартан (n = 6771) або кандесартан (n = 7329). При достатньому антигіпертензивному ефекті в групі кандесартану відмічалося достовірно більш низьке скориговане відношення ризику для всіх серцево-судинних ускладнень — на 14 % ( р < 0,0062). Разом з тим частота розвитку серцевої недостатності була на 36 % нижчою в групі кандесартану (відносний ризик (ВР) 0,64; 95% довірчий інтервал (ДІ) 0,50–0,82; р < 0,0004), порушень серцевого ритму — на 20 % (ВР 0,80; 95% ДІ 0,65–0,92; p = 0,03), захворювань периферичних артерій — на 39 % (ВР 0,61; 95% ДІ 0,41–0,91; р < 0,014). Автори дослідження вважають, що, оскільки не було розбіжностей в ефективності контролю АТ в цільових межах, пояснити різні клінічні наслідки можуть особливі механізми, пов’язані з різними фармакологічними властивостями сартанів [1, 2].
Незважаючи на зменшення цільових значень АТ при лікуванні АГ й широке призначення гіполіпідемічних препаратів, рівні АТ і холестеринових фракцій у світі все ще оптимально не контролюються.
За даними Office of Disease Prevention and Health Promotion (2016), у 43 % пацієнтів з АГ, які отримують лікування, цифри АТ залишаються нецільовими (< 140/90 мм рт.ст.; < 140/80 мм рт.ст. — у пацієнтів із діабетом). Близько 81 % пацієнтів високого кардіоваскулярного ризику мають рівень ХС ЛПНЩ ≥ 1,8 ммоль/л. Майже 79 % пацієнтів з кардіо- або цереброваскулярною патологією, які приймають ліпідознижуючі препарати, не досягають рівня ЛПНЩ-С 1,8 ммоль/л або нижче [15].
І хоча частка хворих, які вживають статини, в Україні становить 80 %, ми далеко позаду більшості держав Європи (рис. 8).
На жаль, в Україні між офіційними рекомендаціями й реальною практикою існує велика прірва. За даними різних авторів, в Україні лікування дисліпідемії приймають не більше від 2–3 % від усіх, хто її потребує (Волков В.И., 2015; Батушкін В.В., 2018). Ці дані не стосуються пацієнтів, які перебувають на лікуванні в спеціалізованих кардіологічних відділеннях [5, 6]. Там, без сумніву, є позитивна динаміка й відсоток призначення статинів досить високий. Однак ніхто не знає, як довго пацієнти приймають препарат і якою мірою у них знижується рівень загального холестерину (ЗХ) і ХС ЛПНЩ [3].
Результати останніх досліджень з використання високоефективних гіполіпідемічних препаратів лягли в основу формування концепції щодо цільового рівня холестерину: чим нижче, тим краще. Однак, як показує ретельний аналіз результатів цих і низки інших досліджень, використання високих доз статинів виправдане далеко не для всіх пацієнтів [40]. Особливо це стосується лікування хворих із хронічними формами ішемічної хвороби серця (дослідження SATURN, TNТ, IDЕАL) [3, 5]. У дослідженні ТNТ відмінність у частоті кінцевих точок хоч і досягла достовірного рівня при дозі аторвастатину 80 мг порівняно з 10 мг, але ця різниця при 8-кратному збільшенні дози становила всього 2,1 %. Не було відмінностей у смертності з будь-яких причин.
У дослідженні IDЕАL при порівнянні ефективності у постінфарктних хворих високих доз аторва-статину (80 мг) зі звичайними дозами симвастатину (20 мг), незважаючи на більше зниження рівня ХС ЛПНЩ у групі аторвастатину, істотної відмінності в основних коронарних подіях (нефатальний інфаркт міокарда, зупинка серця з успішною реанімацією, коронарна смерть) і загальній смертності не відзначалося.
Чимало відомих кардіологів вказували на факт деякого зменшення ризику важливих серцево-судинних подій при лікуванні високими дозами аторвастатину (ТNТ) і симвастатину (А-tо-Z), однак це зменшення перекривалося підвищенням ризику побічних дій (підвищення ферментів печінки, міалгії — при застосуванні симвастатину) і необхідністю більш ретельного моніторингу.
Без сумніву, слід дотримуватися принципу: чим вищий ризик серцево-судинних ускладнень, тим агресивнішою повинна бути терапія. І хоча вихідний рівень ліпідів не завжди є визначальним фактором в оцінці ризику серцево-судинних подій, облік вихідної ліпідограми може сприяти більш правильному вибору препарату [1, 2, 40].
Так, аторвастатин у дозі 10–20 мг на добу, маючи більш м’який ефект щодо зниження ЗХ і ХС ЛПНЩ, може бути призначений при нормальному або помірно підвищеному вихідному рівні ХС ЛПНЩ і/або ЗХ. При цьому слід пам’ятати, що аторвастатин у малих дозах трохи більше підвищує ХС ЛПВЩ, ніж у великих.
Аторвастатин у дозі 40 мг з огляду на його більш потужний ефект щодо зниження ЗХ, ХС ЛПНЩ і тригліцеридів може призначатися широкому колу пацієнтів, тим більше що ця доза препарату також має більшу доказову базу при гострому коронарному синдромі й цукровому діабеті. Необхідно вказати на позитивні особливості лікування аторвастатином порівняно з розувастатином у вигляді додаткового зниження рівнів тригліцеридів і протеїну С (дослідження SATURN).
Практичному лікареві необхідно пам’ятати, що інтенсивна гіполіпідемічна терапія призначається без розрахунку сумарного ризику за шкалою SCORE в пацієнтів зі встановленим серцево-судинним захворюванням, у пацієнтів із загальним холестерином понад 8,0 ммоль/л, у пацієнтів з цукровим діабетом 1-го або 2-го типу, у пацієнтів з високими цифрами АТ (понад 180/110 мм рт.ст).
В описаному вище клінічному випадку поєднання гіполіпідемічної терапії Толевасом саме з Кантабом (кандесартану цилексетилом) обумовлене тим, що порівняльні дані досліджень вказують на те, що кандесартан (Кантаб) має антигіпертензивну ефективність таку ж високу або кращу, ніж інші основні БРА з тривалим періодом дії. Поряд з високою антигіпертензивною ефективністю кандесартан відрізняється чудовою переносимістю (відміна через побічні ефекти відбувається всього у 2,4 % пацієнтів, це менше, ніж плацебо, — 2,6 %).
При тривалому застосуванні кандесартан характеризується низьким рівнем варіабельності АТ — індекс варіабельності «залишковий ефект/найбільший ефект» (ЗЕ/НЕ) досягає майже 100 %. Чим ближча величина ЗЕ/НЕ до 100% (або 1,0), тим більш рівномірна антигіпертензивна дія препарату протягом доби, а отже, і менша варіабельність АТ. За зведеними даними контрольованих досліджень, середні значення відношення ЗЕ/НЕ для діастолічного АТ у кандесартану наближаються до 100 %, що значно більше, ніж у лозартану (60 %), валсартану (65 %), і це вказує на те, що кандесартан забезпечує більш рівномірне зниження АТ протягом доби, ніж лозартан та інші блокатори AT1-ангіотензинових рецепторів.
При тривалому застосуванні кандесартан (Кантаб) з індексом варіабельності ЗЕ/НЕ, наближеним до 100 %, викликає зворотний розвиток гіпертрофії лівого шлуночка, запобігає розвитку серцевої недостатності, прогресуванню захворювань нирок, сітківки й особливо запобігає розвитку мозкового інсульту, що підтверджують результати дослідження SCOPE: після 3,7 року спостереження в групі хворих, які отримували кандесартан, частота основних серцево-судинних подій була на 11 % менше, ніж у групі, що отримувала плацебо, причому терапія кандесартаном супроводжувалася значно меншим числом несмертельних інсультів (на 27,8 % менше), а також усіх інсультів (на 23,6 % менше). Ці властивості є підставою для широкого застосування кандесартану (Кантаб) при лікуванні артеріальної гіпертензії в осіб високого серцево-судинного ризику, що поряд із призначенням ліпідознижуючих препаратів — статинів, а саме аторвастатину (Толевас), в адекватних лікувальних дозах дозволяє не тільки уповільнити процес прогресування атеросклерозу, а й істотно подовжити життя цих пацієнтів.
Конфлікт інтересів. Не заявлений.
1. Williams B., Mancia G., Spiering W. et al. 2018 ESC Guidelines for the management of arterial hypertension. European Heart Journal. 2018. 39. 3021-3104. URL: https://doi.org/10.1093/ eurheartj/ehy339.
2. Whelton P.K., Carey R.M. The 2017 American College of Cardiology/American Heart Association Clinical Practice Guideline for High Blood Pressure in Adults. JAMA Cardiology. JAMA Cardiology Clinical Guidelines Synopsis, February 21, 2018. URL: https://jamanetwork.com/journals/jamacardiology/article-abstract/2672947.
3. Коваленко В.М., Корнацький В.М. Проблеми здоров’я і медичної допомоги та модель покращання в сучасних умовах: посібник для кардіологів, ревматологів, терапевтів, організаторів охорони здоров’я та лікарів загальної практики. Київ: Гордон, 2016. 261 с.
4. Abstract Book EuroPrevent 2017 Malaga, Spain. European Journal of Preventive Cardiology. 2017. Vol. 24. Issue 1. Suppl. URL: http://sagepub.com/toc/cprc/24/1_suppl.
5. Волков В.И., Исаева А.С. Эффективность терапии статинами у женщин. Ліки України. 2015. № 2. С. 4-9.
6. Батушкін В.В. Ефективність та безпечність статинів. Особливості вибору препарату. Кардиология: от науки к практике. 2018. 1(76). 68-81.
7. Heran B.S., Wong M.M., Heran I.K., Wright J.M. Blood pressure lowering efficacy of angiotensin receptor blockers for primary hypertension. Cochrane Database Syst. Rev. 2008. 4. CD003822. [PubMed]
8. Smith D.H. Comparison of angiotensin II type 1 receptor antagonists in the treatment of essential hypertension. Drugs. 2008. 68. 1207-1225. [PubMed]
9. Csajka C., Buclin T., Brunner H.R., Biollaz J. Pharmacokinetic-pharmacodynamic profile of angiotensin II receptor antagonists. Clin. Pharmacokinet. 1997. 32. 1-29. [PubMed]
10. Van Liefde I., Vauquelin G. Sartan-AT1 receptor interactions: in vitro evidence for insurmountable antagonism and inverse agonism. Mol. Cell. Endocrinol. 2009. 302. 237-243. [PubMed]
11. Miura S., Karnik S.S., Saku K. Review: angiotensin II type 1 receptor blockers: class effects versus molecular effects. J. Renin Angiotensin Aldosterone Syst. 2011. 12. 1-7. [PMC free article] [PubMed]
12. Barra S., Vitagliano A., Cuomo V., Vitagliano G., Gaeta G. Vascular and metabolic effects of angiotensin II receptor blockers. Expert Opin. Pharmacother. 2009. 10. 173-189. [PubMed]
13. Shargorodsky M., Hass E., Boaz M., Gavish D., Zimlichman R. High dose treatment with angiotensin II receptor blocker in patients with hypertension: differential effect of tissue protection versus blood pressure lowering. Atherosclerosis. 2008. 197. 303-310.
14. Winkelmayer W.C., Zhang Z., Shahinfar S., Cooper M.E., Avorn J., Brenner B.M. Efficacy and safety of angiotensin II receptor blockade in elderly patients with diabetes. Diabetes Care. 2006. 29. 2210-2217. [PubMed]
15. Office of Disease Prevention and Health Promotion. Social determinants of health. 2016. URL: https://www.healthypeople.gov/2020/topics-bjectives/topic/social-determinants-of-health (accessed March 13, 2016).
16. Desai A.S., Swedberg K., McMurray J.J. et al. Incidence and predictors of hyperkalemia in patients with heart failure: an analysis of the CHARM Program. J. Am. Coll. Cardiol. 2007. 50. 1959-1966. [PubMed]
17. McMurray J.J., Ostergren J., Swedberg K. et al. Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function taking angiotensin-converting-enzyme inhibitors: the CHARM-Added trial. Lancet. 2003. 362. 767-771. [PubMed]
18. Granger C.B., McMurray J.J., Yusuf S. et al. Effects of candesartan in patients with chronic heart failure and reduced left-ventricular systolic function intolerant to angiotensin-converting-enzyme inhibitors: the CHARM-Alternative trial. Lancet. 2003. 362. 772-776. [PubMed]
19. Yusuf S., Pfeffer M.A., Swedberg K. et al. Effects of candesartan in patients with chronic heart failure and preserved left-ventricular ejection fraction: the CHARM-Preserved Trial. Lancet. 2003. 362. 777-781. [PubMed]
20. Jackson E.A., El Khoudary S.R., Crawford S.L. Hot Flash Frequency and Blood Pressure: Data from the Study of Women’s Health Across the Nation. J. Womens Health. 2016. 25(12). 1204-1209.
21. Tamura Y., Kosuga M., Yamashita M. et al. Renoprotective effects of angiotensin II receptor blocker, candesartan cilexetil, in patients with stage 4–5 chronic kidney disease. Clin. Exp. Nephrol. 2008. 12. 256-263. [PubMed]
22. Rossing K., Christensen P.K., Hansen B.V., Carstensen B., Parving H.H. Optimal dose of candesartan for renoprotection in type 2 diabetic patients with nephropathy: a double-blind randomized cross-over study. Diabetes Care. 2003. 26. 150-155. [PubMed]
23. Féghali R.E., Nisse-Durgeat S., Asmar R. Effect of candesartan cilexetil on diabetic and non-diabetic hypertensive patients: meta-analysis of five randomized double-blind clinical trials. Vasc. Health Risk Manag. 2007. 3. 165-171. [PMC free article] [PubMed]
24. Ozaki N., Nomura Y., Sobajima H., Kondo K., Oiso Y. Comparison of the effects of three angiotensin II receptor type 1 blockers on metabolic parameters in hypertensive patients with type 2 diabetes mellitus. Eur. J. Intern. Med. 2010. 21. 236-239. [PubMed]
25. Knudsen S.T., Andersen N.H., Poulsen S.H. et al. Pulse pressure lowering effect of dual blockade with candesartan and lisinopril vs high-dose ACE inhibition in hypertensive type 2 diabetic subjects: a CALM II study post-hoc analysis. Am. J. Hypertens. 2008. 21. 172-176. [PubMed]
26. Philipp T., Martinez F., Geiger H. et al. Candesartan improves blood pressure control and reduces proteinuria in renal transplant recipients: results from SECRET. Nephrol. Dial. Transplant. 2010. 25. 967-976. [PubMed]
27. Grosso A.M., Bodalia P.N., Macallister R.J. et al. Comparative clinical- and cost-effectiveness of candesartan and losartan in the management of hypertension and heart failure: a systematic review, meta- and cost-utility analysis. Int. J. Clin. Pract. 2011. 65. 253-263. [PubMed]
28. Lithell H., Hansson L., Skoog I. et al. The Study on Cognition and Prognosis in the Elderly (SCOPE): principal results of a randomized double-blind intervention trial. J. Hypertens. 2003. 21. 875-886. [PubMed]
29. Schrader J., Lüders S., Kulschewski A. et al. The
ACCESS Study: evaluation of Acute Candesartan Cilexetil Therapy in Stroke Survivors. Stroke. 2003. 34. 1699-1703.
[PubMed]
30. Sandset E.C., Bath P.M., Boysen G. et al. The angiotensin-receptor blocker candesartan for treatment of acute stroke (SCAST): a randomised, placebo-controlled, double-blind trial. Lancet. 2011. 377. 741-750. [PubMed]
31. Chaturvedi N., Porta M., Klein R. et al. Effect of candesartan on prevention (DIRECT-Prevent 1) and progression
(DIRECT-Protect 1) of retinopathy in type 1 diabetes: randomised, placebo-controlled trials. Lancet. 2008. 372. 1394-1402. [PubMed]
32. Sjølie A.K., Klein R., Porta M. et al. Effect of candesartan on progression and regression of retinopathy in type 2 diabetes (DIRECT-Protect 2): a randomised placebo-controlled trial. Lancet. 2008. 372. 1385-1393. [PubMed]
33. Ogihara T., Nakao K., Fukui T. et al. Effects of cande-sartan compared with amlodipine in hypertensive patients with high cardiovascular risks: candesartan antihypertensive survival evaluation in Japan trial. Hypertension. 2008. 51. 393-398.
[PubMed]
34. Nakao K., Hirata M., Oba K. et al. Role of diabetes and obesity in outcomes of the candesartan antihypertensive survival evaluation in Japan (CASE-J) trial. Hypertens. Res. 2010. 33. 600-606. [PubMed]
35. Tronvik E., Stovner L.J., Helde G., Sand T., Bovim G. Prophylactic treatment of migraine with an angiotension II receptor blocker: a randomized controlled trial. JAMA. 2003. 289. 65-69. [PubMed]
36. Yamashita T., Inoue H., Okumura K. et al. Randomized trial of angiotensin II-receptor blocker vs dihydropiridine calcium channel blocker in the treatment of paroxysmal atrial fibrillation with hypertension (J-RHYTHM II study) Europace. 2011. 13. 473-479. [PubMed]
37. Cuspidi C., Muiesan M.L., Valagussa L. et al.; CATCH investigators. Comparative effects of candesartan and enalapril on left ventricular hypertrophy in patients with essential hypertension: the candesartan assessment in the treatment of cardiac hypertrophy (CATCH) study. J. Hypertens. 2002. 20(11). 2293-2300.
38. Підлісна В.С., Верещук Л.Л., Качан О.В. Вплив тривалої терапії кандесартаном на показники кардіогемодинаміки у пацієнтів з артеріальною гіпертензією, ускладненою хронічною серцевою недостатністю. 17.10.2017. URL: http://nobel.com.ua/doctor_article/1754-Vpliv-trivalo-terap-kandesartanom-na-pokazniki-kardogemodina-mіki -u-patcntv-z-arteralnoyu-gpertenzyu-u.
39. Сиренко Ю.Н., Донченко Н.В. Место кандесартана в современной терапии сердечно-сосудистых заболеваний: обзор доказательств. Артериальная гипертензия. 2011. 4(18). 114-126.
40. Campbell N.R., Gelfer M., Stergiou G.S. et al. A call to regulate manufacture and marketing of blood pressure devices and cuffs: a position statement from the World Hypertension League, International Society of Hypertension and Supporting Hypertension Organizations. J Clin. Hypertens. (Greenwich). 2016. 18. 378-80.
41. Cernes R., Mashavi M., Zimlichman R. Differential clinical profile of candesartan compared to other angiotensin receptor blockers. Vasc. Health Risk Manag. 2011. 7. 749-759.

/136-1.jpg)
/136-2.jpg)
/137-1.jpg)
/138-1.jpg)
/138-2.jpg)
/139-1.jpg)
/140-1.jpg)
/141-1.jpg)
/142-1.jpg)
/143-1.jpg)